去泛素化酶JOSD2通过调控DNA损伤修复影响非小细胞肺癌细胞对抗肿瘤药物的敏感性
葛孚晶,刘湘宁,张鸿宇,袁 涛,朱 虹,杨 波,何俏军
浙江大学药学院,浙江 杭州 310058
据统计,近年来亚洲新发肺癌患者逐年增加,我国肺癌发病率和病死率也呈逐年上升趋势[1]。肺癌中80%~85%为NSCLC,其具有发病隐匿、早期症状不明显的特点,确诊时往往为中晚期,病死率居高不下,患者5 年存活率不到20%[2-4]。近年来,虽然针对NSCLC 的分子靶向药物治疗获得一定进展,但仍有70%~80%的NSCLC 患者无法从中获益。因此,迫切需要探究NSCLC进展的分子机制,寻找治疗NSCLC新的靶点,从而开发行之有效的靶向治疗策略。
泛素化修饰是一种动态可逆的翻译后修饰,在细胞的蛋白降解途径中发挥重要调控作用[5]。DUB 能够特异性地移除底物蛋白上的泛素链,从而调控多种底物蛋白的降解过程。近年大量文献报道,DUB 通过调控细胞内多种信号通路,从而影响细胞周期和凋亡,并最终促进宫颈癌、黑色素瘤和前列腺癌等肿瘤的恶性进展[6-11]。因此,针对DUB展开研究有望发现治疗NSCLC新的靶点,为NSCLC 治疗提供新的思路。本研究基于公共数据库中数据的生物信息学分析,全面考察了NSCLC 中发挥关键调控作用的DUB,并分析其中分子机制,旨在为NSCLC的治疗提供新的策略。
1 材料与方法
1.1 主要仪器和试剂
人NSCLC 细 胞 株PC-9 和NCI-H1299 购 自 中国科学院典型培养物保藏委员会细胞库;依托泊苷、多柔比星和奥拉帕尼为美国MedChemExpress公司产品;RPMI-1640 培养基、胎牛血清、Opti-MEM®、非必需氨基酸和L-谷氨酰胺为美国Thermo Fisher Scientific 公司产品;SRB、丙酮酸钠、聚凝胺和JOSD2 抗体为美国Sigma-Aldrich 公司产品;GADPH抗体为戴格生物技术有限公司产品;γ-H2AX 抗体为美国Cell Signaling Technology公司产品;辣根过氧化合物酶标记二抗(兔抗与鼠抗)为杭州联科生物技术股份有限公司产品;DAPI 为 美 国Dojindo Molecular Technologies 公 司产品;pCDH-JOSD2-HA 质粒为山东维真生物科技有限公司产品;jetPRIME®为法国Polyplus 公司产品;si-JOSD2 为上海吉玛制药技术有限公司产品。
细胞培养箱和生物安全柜为美国Thermo Electron 公司产品;普通倒置显微镜和荧光显微镜为德国Leica 公司产品;电泳及转膜装置为美国Bio-Rad 公司产品;AI 600 成像仪为美国GE 公司产品;多功能酶标仪为美国Thermo Fisher Scientific公司产品。
1.2 NSCLC基因表达数据及临床资料的收集
从基因表达数据库(Gene Expression Omnibus)下载NSCLC 转录组表达数据及临床资料,筛选条件:①物种为人类;②疾病类型为NSCLC;③肿瘤原发位点为肺部;④数据形式为高通量测序或芯片数据;⑤数据类型为基因表达定量;⑥数据集样本数100 例及以上;⑦其余筛选条件为默认或不选。下载各数据集的基因表达矩阵和分组信息,在R 4.2.1 软件中利用相应的R 软件包进一步处理。
1.3 筛选与NSCLC 患者预后相关的DUB 相关差异表达基因
首先,将不同数据集转录组测序数据进行数据清洗,并根据样本来源分为正常组织和NSCLC组织。然后使用R 软件包factoMineR 2.8 和factoextra 1.0.7 进行主成分分析及可视化。接着,使用R 软件包limma 3.42.2 进行数据比较并计算差异表达基因,筛选上调差异表达基因的标准为P<0.05 且差异倍数大于 1,筛选下调差异表达基因的标准为P<0.05且差异倍数为>0~<1。再将多个数据集中的差异表达基因与DUB 列表取交集筛选出DUB 相关差异表达基因,并使用R 软件包ggplot2 3.4.2 对各数据集中的DUB 相关差异表达基因的表达水平进行可视化。最后,使用Kaplan-Meier Plotter(http://kmplot.com/analysis/)数 据 库分析NSCLC 样本中差异表达的DUB 表达量对患者总生存期的影响,筛选出与NSCLC 患者预后相关的DUB相关差异表达基因。
1.4 基因富集分析考察JOSD2 高表达患者信号通路的变化情况
将数据集NSCLC 样本按照JOSD2表达量中位数分为JOSD2高表达组和低表达组,利用limma 分析筛选组间差异表达基因,并采用R 软件包clusterProfiler 4.0 进行GO 与GSEA 富集分析。GO 富集分析包括生物过程、分子功能和细胞组分三个层次。R软件包org.Hs.eg.db 3.10.0用于ID 转换。GSEA 分析参考基因集数据库MSigDB(https://www.gsea-msigdb.org/gsea/msigdb/)进行注释。使用R 软件包GSVA 1.48.0 进行GSVA 分析,并通过皮尔逊相关系数评估JOSD2表达水平与DNA修复相关生物学功能的相关性。
1.5 细胞培养
PC-9 和NCI-H1299 细胞在添加10%胎牛血清、100 U/mL 青 霉 素 和100 µg/mL 链 霉 素 的RPMI-1640 培养基中,置于培养箱(37 ℃、5%二氧化碳)中培养。待细胞生长至合适密度时进行传代培养,经0.05%胰蛋白酶消化传代,所有实验细胞均传代十代以内。
1.6 转染JOSD2过表达质粒
待PC-9细胞长至适宜密度时开始转染,按照jetPRIME®转染试剂说明将Jet-Buffer、pCDHJOSD2-HA 质粒和Jet-PRIME 共转染至PC-9 细胞,转染4~6 h 后更换成新鲜培养基,并按照实验目的进行后续实验操作。
1.7 构建DNA损伤细胞模型
待PC-9 细胞长至适宜密度时,利用DNA 损伤诱导剂多柔比星和依托泊苷构建DNA 损伤模型。利用梯度浓度的多柔比星(1、2 µmol/L)和梯度浓度的依托泊苷(100、200 µmol/L)处理细胞8 h,构建长时间内DNA 损伤修复模型。依据造模效果,选定200 µmol/L 浓度的依托泊苷分别处理细胞0、1、2、4、6、8 h,构建时间梯度的DNA 损伤修复模型。
1.8 蛋白质印迹法考察JOSD2和DNA 损伤修复通路相关蛋白的表达水平
收集处理后的PC-9 或NCI-H1299 细胞,加入2.5×上样缓冲液裂解细胞,后置于95 ℃金属浴加热变性30 min 制成样本。样本进行SDS 聚丙烯酰胺凝胶电泳,转膜至聚偏二氟乙烯膜后用5%脱脂牛奶封闭1 h,加入γ-H2AX 一抗(1∶1000)、JOSD2 一抗(1∶1000)和内参GAPDH 抗体稀释液(1∶3000),4 ℃孵育过夜。1×PBST 漂洗三次后,加入对应属性的二抗稀释液(1∶5000)室温孵育1 h,1×PBST 漂洗三次将ECL 显影液按照1∶1 的比例配置,混合后均匀覆盖于聚偏二氟乙烯膜表面,采用AI-600曝光仪进行曝光采集图像。
1.9 免疫荧光法考察JOSD2细胞内定位
生长至合适密度的细胞弃去培养液,加入适量的4%多聚甲醛固定以及含有0.1% Triton X-100的1×PBS 透化细胞后,使用含有4%牛血清白蛋白的1×PBS 封闭细胞,随后使用JOSD2 荧光一抗(按1∶100用4%牛血清白蛋白的1×PBS进行稀释)4 ℃孵育过夜。第二天弃去荧光一抗,用1×PBS 洗涤,并加入荧光二抗孵育液(按1∶100 稀释),室温孵育1 h。弃去荧光二抗,用1×PBS洗涤后加入抗褪色的DAPI 染色液(按1∶1000 稀释),1×PBS 洗涤。加入适量体积的抗淬灭剂封片,置于风机下吹干后,用荧光显微镜拍照。
1.10 SRB染色考察细胞存活率
利用细胞转染技术进行RNA 干扰实验,构造阴性对照siRNA 和si-JOSD2 的NCI-H1299 细胞系。待NCI-H1299 细胞生长至合适密度时,分别以3.0×104个/孔 的 细 胞 密 度 接 种 于96 孔 板 中(100 µL/孔),于细胞培养箱中培养24 h 后,给予梯度浓度的 多 柔比星(200.00、100.00、50.00、25.00、12.50 和6.25 nmol/L)和奥拉帕尼(50.00、25.00、12.50、6.25、3.13 和1.56 µmol/L)孵育72 h。孵育结束弃上清液,每孔加入100 µL 10%三氯乙酸溶液固定,弃培养液,用双蒸水洗涤后烘干。每孔加入100 µL SRB染色液(用1%冰醋酸配置,每500 mL 加入1.5~2.0 g SRB 粉末),室温放置20 min,用1%冰醋酸洗涤干净后烘干。每孔加入100 µL Tris-base 碱溶液溶解结合到细胞内的SRB 染色液,置于室温摇床20 min 后,在波长为515 nm 下检测吸光度,计算细胞存活率。实验独立重复三次,每次设置三个复孔。
1.11 统计学方法
采用RStudio、Excel 软件和Graphpad Prism 7软件进行实验数据的分析和绘图。计量数据均以均数±标准差(±s)表示,采用双侧student’st检验分析两组数据间的差异,采用one-way ANOVA 分析多组数据间的差异,P<0.05 表示差异具有统计学意义。
2 结 果
2.1 JOSD2 在NSCLC 组织中高表达且与患者预后不良相关
经初步筛选,五个独立数据集GSE19188、GSE33532、GSE43458、GSE44077、GSE75037 纳入考察。主成分分析结果显示,不同队列中NSCLC组织与癌旁正常组织的转录组主成分均存在显著差异(图1)。其中,DUB 家族中的JOSD2、USP5和PSMD14的表达量均显著上调(P<0.05,图2、附图1)。Kaplan-Meier Plotter 分析结果显示,JOSD2表达水平与患者的总生存期和进展后生存期均显著相关(P<0.05),见图3、附图2。提示JOSD2表达水平高的NSCLC患者预后不良。

图1 基因表达数据库各数据集中NSCLC组织和正常组织转录组测序数据主成分分析结果Figure 1 Principal component analysis results of transcriptome sequencing data of NSCLC tissue and normal tissue in Gene Expression Omnibus

图2 各数据集中非小细胞肺癌组织共同高表达的DUB相关基因Figure 2 Cross analysis illustrating the overlap of DUB related genes with elevated expression in NSCLC patients within five independent cohorts

图3 JOSD2、PSMD14 和USP5 对非小细胞肺癌患者预后影响的生存分析结果Figure 3 Effect of JOSD2, PSMD14 and USP5 on the prognosis of non-small cell lung carcinoma patients
2.2 JOSD2高表达NSCLC组织中DDR相关通路显著激活
GO富集分析结果显示,JOSD2高表达组样本中蛋白泛素化调控、葡萄糖代谢过程等通路发生显著富集(均P<0.05),DNA 生物合成过程的正向调控、参与DNA修复的DNA合成等途径也发生显著富集(均P<0.05),见图4。GSEA 结果显示,JOSD2表达量高的样本中DNA修复、DNA损伤检查点信号传递、DNA构象改变和DNA双链断裂修复途径发生显著激活(均P<0.05),见图5。进一步行GSVA 和相关性分析结果显示,JOSD2表达水平与DNA双链断裂修复、经同源重组的双链断裂修复和经非同源末端连接的双链断裂修复等途径的激活呈显著正相关(均P<0.01,图6)。上述结果提示,JOSD2高表达患者DDR 相关通路均激活,JOSD2可能通过调控DDR 途径发挥促NSCLC作用。

图4 JOSD2 高表达组差异基因的基因本体论富集分析结果Figure 4 Gene ontology enrichment analysis of differentially expressed genes in the JOSD2 high-expression group
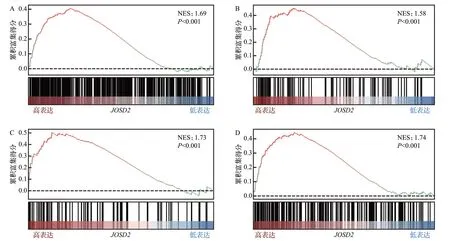
图5 JOSD2高表达组差异基因基因集富集分析结果Figure 5 Gene set enrichment analysis of differentially expressed genes in the JOSD2 high-expression group

图6 JOSD2表达水平与DNA损伤反应相关通路激活程度的相关性分析结果Figure 6 Correlation analysis of JOSD2 expression levels and the activation status of DNA damage response related pathways
2.3 JOSD2 是DNA 双链断裂修复的潜在调节因子
蛋白质印迹法检测结果显示,在多柔比星和依托泊苷处理的情况下,相比对照组,过表达JOSD2的PC-9 细胞中γ-H2AX 的表达水平降低(图7),提示JOSD2与DNA 损伤修复过程相关。

图7 过表达JOSD2 对不同药物诱导γ-H2AX 表达水平的蛋白电泳图Figure 7 Western blotting analysis of γ-H2AX expression levels induced by different drugs in cells overexpressing JOSD2
2.4 DNA 损伤后JOSD2 入核并加快DDR过程
蛋白质印迹法检测结果显示,与对照组比较,过表达JOSD2显著加快了γ-H2AX 的下调(图8)。免疫荧光检测结果显示,与对照组比较,200 µmol/L的依托泊苷处理2 h 后,JOSD2 在细胞核区域发生显著富集(图9)。提示JOSD2 在细胞DNA 损伤后入核并加快DDR过程。

图8 过表达JOSD2加速γ-H2AX下调的蛋白电泳图Figure 8 Western blotting analysis of γ-H2AX down-regulation rate in cells overexpressing JOSD2
2.5 si-JOSD2 显著提高NSCLC 细胞对多柔比星和奥拉帕尼的敏感性
蛋白质印迹法结果显示,si-JOSD2 组细胞中JOSD2 的表达量显著降低(图10)。SRB 结果显示,50 nmol/L 多柔比星处理72 h 的条件下,si-JOSD2组的存活率显著低于对照组(P<0.05),对照组和si-JOSD2 组多柔比星的IC50分别为(90.38±8.98)和(46.32±16.11)nmol/L(P<0.05);12.5 µmol/L奥拉帕尼处理72 h 的条件下,si-JOSD2 组的存活率显著低于对照组(P<0.05),对照组和si-JOSD2组奥拉帕尼的IC50分别为(22.58±1.75)和(13.26±4.14)nmol/L(P<0.05),见图11。提示si-JOSD2 可提高NSCLC 细胞对多柔比星和奥拉帕尼的敏感性。

与二甲基亚砜处理后的细胞比较,200 µmol/L 的依托泊苷处理2 h 后,JOSD2 在细胞核区域发生显著富集.标尺=100 µm.JOSD2:含约瑟芬结构域2蛋白;DAPI:4',6-二脒基-2-苯基吲哚.

图11 敲低JOSD2 后在不同浓度多柔比星和奥拉帕尼作用下细胞存活曲线Figure 11 Cell survival curves under different concentrations of doxorubicin and olaparib after depletion of JOSD2
3 讨 论
NSCLC 是世界上最为常见的癌症相关死亡原因之一,每年死亡人数超过6 万人[12]。研究显示,50%以上的NSCLC 患者存在致癌驱动突变,其中KRAS突变患者占比约25%,EGFR突变患者占比约15%,ALK 突变患者占比约7%[13]。靶向NSCLC 的驱动突变可以显著改善相关患者的生存期,为NSCLC 的临床治疗提供了新的范式[14]。尽管随着肿瘤标志物的不断发现和靶向药物的开发,NSCLC 患者的存活期显著延长[15],但对于缺乏明确致癌驱动的晚期NSCLC 患者,联合化疗仍然是主要的治疗手段[16]。研究报道,尽管化疗药物改善了晚期NSCLC 患者的生活质量,但中位生存期仍不足3 年。因此,亟须探究NSCLC 的全新靶点,以提高晚期NSCLC 患者化疗敏感性,延长晚期NSCLC患者的总生存期。
泛素化修饰是一种物种间高度保守的翻译后修饰类型,其主要依赖于泛素激活酶、泛素偶联酶和泛素连接酶将泛素分子连接到底物蛋白的赖氨酸残基上[17]。据研究报道,多聚泛素化修饰与底物蛋白的降解途径高度相关,经多聚泛素化修饰的蛋白主要通过泛素-蛋白酶体途径和自噬-溶酶体途径降解[18]。DUB 能够特异性地将底物蛋白上的泛素分子移除,从而逆转细胞内泛素化修饰的过程,维持细胞内泛素化-去泛素化的平衡[19]。近年来,DUB 被广泛报道参与多种恶性肿瘤的发生和进展[20-21]。例如,USP14 通过结合并移除IDO1 上的多聚泛素链,从而抑制IDO1 的降解并促进色氨酸代谢,最终抑制T 淋巴细胞的活性并促进结肠癌的进展[20]。研究显示,USP2 可调控E2F4 的稳定性,促进肿瘤细胞的自噬和锌稳态,最终调控肿瘤的恶性进展[21]。因此,靶向DUB 是开发抗肿瘤药物的潜在策略。基于此,本研究考察了多个独立NSCLC 队列中均发生显著失调的DUB。结果显示,JOSD2、USP5和PSMD14的表达水平均显著上调。基于数据库进一步考察了JOSD2、USP5和PSMD14对NSCLC患者预后的影响,结果显示JOSD2的表达水平与NSCLC 患者预后不良显著相关,提示JOSD2参与NSCLC 的恶性进展。
尽管USP5和PSMD14在预后分析中显示与患者预后无显著相关性,本研究未纳入考察,但两者在NSCLC 和其他肿瘤中的作用有广泛报道[22-24]。例如,USP5 被证实直接结合并介导细胞核Beclin 1 的去泛素化,从而稳定Beclin 1 并促进p53 的特异性降解,在KRAS 突变驱动的肺癌中发挥关键作用[22]。此外,也有研究证实USP5 直接结合并移除程序性死亡蛋白-1 上的多聚泛素链,从而促进程序性死亡蛋白-1 稳定和免疫疗法的耐受性[23]。除此之外,PSMD14 也被证实通过调控E2F1 的去泛素化激活AKT 信号通路,并最终介导头颈部鳞状细胞癌的化学耐药[24]。以上报道提示,尽管本研究中所使用的筛选方法具有较高的普适性,仍须对排除在外的潜在靶点进一步研究。
JOSD2 是马查多-约瑟夫结构域亚家族的成员之一,近年来不少研究报道其参与多种肿瘤的恶性进展[25-27]。例如,JOSD2 被鉴定为YAP/TAZ和CTNNB1 的去泛素化酶,能够直接结合并移除YAP/TAZ和CTNNB1 上的多聚泛素链,从而提高YAP/TAZ和CTNNB1的稳定性,促进肝细胞肝癌的恶性进展[25,27]。此外,JOSD2还被证实直接结合多种代谢酶,通过发挥去泛素化作用介导代谢酶的稳定和累积,并最终促进NSCLC 细胞的糖酵解和恶性演进[26]。然而,JOSD2 在NSCLC中发挥促肿瘤作用的分子机制仍未完全阐明。为此,本研究依据JOSD2相对表达量将队列中的样本分组,并基于GO分析和GSEA分析探究发生显著改变的信号通路。结果显示,DDR 相关通路被富集且在JOSD2较高表达水平的组中显著激活。
DDR 是细胞内一种维持基因组稳定性的复杂生物过程,其主要通过激活细胞周期检查点和协调细胞代谢反应以修复受损的DNA。有研究报道,癌症中多种参与编码DDR 的基因发生突变,从而引起肿瘤细胞基因组不稳定性,并最终介导肿瘤的发生和发展[28]。因此,靶向DDR 途径,从而增加肿瘤细胞额外的复制应激和复制压力,是抗肿瘤药物开发过程中的重要思路[29]。近年来,多项研究报道,DUB 广泛参与细胞中的DDR 过程[30-31]。例如,USP38 通过结合并移除HDAC1 上的K63 型多聚泛素链,从而促进了HDAC1 去乙酰化活性,并最终导致肿瘤细胞中NHEJ 过程的激活和DNA 损伤剂的不敏感性[30]。USP17 通过移除Ku70 上的泛素链从而促进NHEJ,是PTEN缺失肿瘤细胞中发挥DDR的主要原因[31]。本研究基于GSVA 分析,计算了JOSD2表达水平与DDR 途径的相关性。结果显示,JOSD2的表达水平与DDR 途径的激活程度呈显著正相关。体外实验进一步证实,细胞在发生DNA 损伤后JOSD2 的核定位显著增加,且过表达JOSD2能促进DNA 修复过程。以上结果提示,JOSD2 可通过调控DDR 途径发挥促NSCLC 进展的作用。
近年来,多种DNA 损伤类药物体现了靶向DDR 途径在肿瘤治疗中的巨大价值[32]。奥拉帕尼是多腺苷二磷酸核糖聚合酶特异性抑制剂,其通过靶向DDR 过程抑制BRCA 突变肿瘤的恶性进展,被广泛应用于BRCA 突变型乳腺癌、卵巢癌和急性白血病的临床治疗。多柔比星是一种强效的化疗药物,其主要通过诱导肿瘤细胞的DNA 损伤发挥抗肿瘤功能,被广泛用于多种肿瘤的新辅助化疗[33]。然而,多柔比星通过诱导氧化应激、细胞自噬和细胞凋亡产生严重的心脏毒副反应,极大限制了其在肿瘤治疗中的临床应用[34-35]。通过药物联用策略增强肿瘤细胞对DNA 损伤类药物的敏感性是提高其抗肿瘤作用并降低其毒副反应的重要思路。本研究通过转染技术和SRB 技术考察了敲低JOSD2对多柔比星和奥拉帕尼的敏感性。结果显示,敲除JOSD2能显著降低多柔比星和奥拉帕尼在NSCLC 细胞系上的IC50,提示靶向JOSD2 是增强NSCLC 细胞系对DNA损伤类药物敏感性的重要思路。
综上所述,本研究通过生物信息学分析和体外实验证实,JOSD2 通过调控DDR 发挥促NSCLC作用,靶向JOSD2是提高NSCLC 化疗敏感性的重要举措,为NSCLC 的临床治疗提供了新的思路。但是,尽管本研究证实JOSD2显著降低了DNA 损伤剂引起的γ-H2AX 上调,观察到JOSD2 在DNA损伤剂的诱导下入核,但具体的分子机制仍未完全阐明。近年研究报道,DUB 通过介导组蛋白和DNA 修复相关蛋白的去泛素化调控DNA 损伤修复途径[30-31]。因此,课题组后续将从JOSD2 直接结合的蛋白出发,通过体内外实验进一步考察JOSD2 经由酶活发挥促DNA 损伤修复作用,探索JOSD2发挥作用的具体分子机制。

本文附图见电子版。
志谢 研究得到浙江省重点研发计划(2022C03077)支持
Acknowledgements The work was supported by the Key R&D Program of Zhejiang Province (2022C03077)
利益冲突 所有作者均声明不存在利益冲突
Conflict of Interests The authors declare that there is no conflict of interests
©The author(s) 2023.This is an open access article under the CC BY-NC-ND 4.0 License (https://creativecommons.org/licenses/by-nc-nd/4.0/)

