核苷(酸)类似物治疗乙型肝炎肝硬化代偿期达到“功能性治愈”后停药的影响
陈怡
作者单位:434000 湖北省荆州市第二人民医院
乙型肝炎表面抗原(HBsAg)阴转与肝脏功能改善,组织病理改善及长期预后改善即为功能性治愈或临床治愈[1]。由于强效、安全的核苷(酸)类似物(NAs)长期治疗可通过显著的病毒抑制减少肝硬化相关并发症和肝细胞癌的发生,但长期使用该类药物利弊参半。一方面,由于NAs的强效抑制病毒作用,加之其口服方便、耐受性好及不良反应较为轻微等特性,临床现阶段使用频次较高;另一方面该类药物不能清除肝细胞共价闭合环状DNA(cccDNA),导致HBsAg年转阴率仅为0.15%~0.33%[2]。目前,欧美等国家的一些学者认为乙型肝炎患者使用NAs进行治疗乙型肝炎病毒表面抗原(HBsAg)消失且HBV-DNA检测不到后则可停药,而中国相关指南则认为肝硬化代偿期患者需长疗程用药[3-4]。因此,临床目前对于乙型肝炎肝硬化代偿期患者达到“功能性治愈”后是否停药及停药对患者的影响存在较大的争议。本研究观察乙肝肝硬化代偿期患者达到功能性治愈后停用NAs治疗的影响,报道如下。
1 资料与方法
1.1 一般资料 回顾性收集2019年5月—2020年5月于荆州市第二人民医院行NAs治疗的乙型肝炎肝硬化代偿期患者95例,男60例,女35例,年龄32~73(58.23±6.00)岁。依据达到“功能性治愈”后是否停止使用NAs将其分为停药组(40例)和继续用药组(55例)。停药组男23例,女17例,年龄32~75(58.45±5.96)岁;继续用药组男37例,女18例,年龄32~74(58.10±6.15)岁。2组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 选择标准 纳入标准:患者为肝硬化代偿期,且经影像学检查确诊;接受NAs治疗;依从性较高,能够按时完成随访;达到“功能性治愈”标准[5]。排除标准:肝硬化失代偿期患者;急危重症者;原发性肝癌患者;精神失常患者。
1.3 治疗方法 2组患者初始予拉米夫定多替拉韦片(GlaxoSmithKline LLC.生产,规格:300 mg ∶50 mg/片)1片口服,每天1次,待完成有限疗程治疗后,血清HBsAg及HBV-DNA持续检测结果良好,乙型肝炎E抗原(HBeAg)转阴、伴或不伴血清学转换,停药组予以停药,继续用药组则改用富马酸丙酚替诺福韦片(Patheon Inc.生产)25 mg口服,每天1次。
1.4 观察指标与方法 (1)患者达到“功能性治愈”与随访6、12、24个月时采用日本日立7600全自动生化分析仪及配套试剂检测丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、血清总胆红素(TBil);采用化学发光微粒子免疫分析法检测抗-HBs,抗-HBs≥10.00 mIU/L即为阳性;采用美国雅培ARCHITECT12000型全自动免疫分析仪及配套试剂检测乙型肝炎E抗原(HBeAg),HBeAg≥1.00 S/CO即为阳性。(2)随访6、12、24个月时采用罗氏lightcycle基因荧光定量分析仪检测HBV-DNA载量。(3)比较2组患者随访24个月的复发情况[HBV-DNA>20 IU/ml,伴(或)不伴HBsAg阳性,ALT>1×正常值上线值即为复发]和原发性肝癌发生率;采用海斯凯尔Fibrotoch 100采集2组患者随访24个月的肝弹性超声值。

2 结 果
2.1 达到“功能性治愈”ALT、AST、TBil水平与抗-HBs、HBeAg阳性率比较 达到“功能性治愈”时,2组患者ALT、AST、TBil水平与抗-HBs、HBeAg阳性率比较差异均无统计学意义(P>0.05)。见表1。
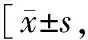
表1 停药组与继续用药组达到“功能性治愈”ALT、AST、TBil水平与抗-HBs、HBeAg情况比较例(%)]
2.2 随访时ALT、AST、TBil水平与HBV-DNA载量及抗-HBs、HBeAg阳性率比较 随访6、12、24个月,2组患者ALT、AST、TBil水平与HBV-DNA载量及抗-HBs、HBeAg阳性率比较差异均无统计学意义(P>0.05),见表2。
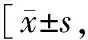
表2 停药组与继续用药组随访6、12、24个月ALT、AST、TBil水平与HBV-DNA载量及抗-HBs、HBeAg阳性率比较例(%)]
2.3 复发率、原发性肝癌发生率及肝弹性超声值 随访24个月,2组患者复发率、原发性肝癌发生率及肝弹性超声值比较差异无统计学意义(P>0.05),见表3。
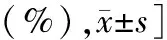
表3 停药组与继续用药组复发率、原发性肝癌发生率及肝弹性超声值比较 [例
3 讨 论
肝硬化通常为多种慢性肝脏疾病的共同结局,其极大威胁了患者的生存及预后[6]。肝硬化代偿期为肝硬化的早期,常无严重的并发症,既往认为乙型肝炎肝硬化为不可逆的过程,但随着临床实践的深入,证实长期的抗病毒治疗能够逆转肝硬化,同时改善肝纤维化的程度[7]。经过抗病毒治疗,大部分慢性乙型肝炎患者可使ALT复常,HBV-DNA降低乃至消失,部分患者可获得HBeAg阴转和(或)血清学转换,进而改善肝组织学情况,降低肝硬化及肝癌发生率。现阶段,对于乙型肝炎治愈的效果主要分为病毒学与功能性治愈两类,前者因为cccDNA的存在,加之临床尚未研制出针对cccDNA的靶向药物,故临床上治疗难度较大,而后者则与急性HBV感染后自发性病毒解除状态类似,其意味着免疫学上对乙型肝炎的控制,是现阶段国内外诸多指南公认的理想治疗宗旨[8]。
NAs因强效与耐药低的特性在临床上使用的频次较高,其对于慢性乙型肝炎患者的预后改善作用突出,主要体现在肝纤维化程度及肝硬化的逆转等方面[9]。该类药物的主要作用为抑制HBV的逆转录复制,明显降低病毒的载量,但长期使用会出现耐药性,且患者停药后会出现HBV-DNA复制与载量反跳情况,造成患者病情加剧。近年来有学者认为,对于行NAs长期治疗的功能性治愈患者予以停药,目的是在诊治过程或在短期的停药内帮助患者自身建立持续且有效的免疫机制,以控制病毒的复制及抗原的表达[10]。本研究结果显示,达到“功能性治愈”时,2组患者ALT、AST、TBil水平与抗-HBs、HBeAg阳性率比较差异均无统计学意义,但HBV-DNA载量无法测出,说明经过规范的NAs治疗后,乙型肝炎肝硬化代偿期患者的HBV-DNA已停止复制,达到了免疫复制,有突出的治疗作用,进一步证实了NAs的有效性和可行性。本研究结果显示,随访6、12、24个月,2组患者ALT、AST、TBil水平与HBV-DNA载量及抗-HBs、HBeAg阳性率比较差异均无统计学意义,提示乙型肝炎肝硬化代偿期患者使用NAs治疗后HBsAg消失,且停药组与继续用药组患者的机体状况未见明显差异。由此可见,乙型肝炎肝硬化代偿期患者达到“功能性治愈”后,临床即可停止抗病毒治疗,后续停药不会影响患者的肝功能等。我国原发性肝癌大多与乙型肝炎肝硬化相关,乙型肝炎肝硬化患者使用NAs治疗后可降低原发性肝癌的发生率[11]。但有学者指出,乙型肝炎肝硬化患者即便HBsAg消失后,仍无法避免肝癌的发生,但总体而言发生率降低[12]。本研究中,停药组与继续用药组患者复发率、原发性肝癌发生率及肝弹性超声值比较差异无统计学意义,说明乙型肝炎肝硬化代偿期患者停药后复发及原发性肝癌的发生情况与停药未见明显差异,但提示临床需要对使用NAs治疗的乙型肝炎肝硬化代偿期患者HBsAg消失,无论是否停药均需要开展定期的随访,以便于尽早发现原发性肝癌并及时进行处置。但在临床实践中,停药研究属于真实世界临床研究,非临床常规诊疗工作,因此停药必须符合伦理学规范,同时也需要在纳入停药随访对象时应有充分的风险预测,需要加强停药后的密切随访监测[13]。
综上所述,乙型肝炎肝硬化代偿期患者达到“功能性治愈”后可考虑停止NAs的使用。但本研究为回顾性研究,未对患者使用NAs的具体类型进行统计与归纳,加之随访的时间仅为2年,后续需要进一步行深入研究。
利益冲突:所有作者声明无利益冲突。

