桃红四物颗粒对原发性痛经模型大鼠下丘脑-垂体-卵巢轴功能的影响
唐林峰,聊晓玉,常昊,赵梦蝶,王丹丹,刘竹青,韩岚*(.安徽中医药大学药学院,现代中药安徽省重点实验室,合肥 23002;2.安徽省中药复方重点实验室,合肥 23002)
原发性痛经(primary dysmenorrhea,PD)是指患者在月经期间出现下腹部剧烈疼痛,伴有出汗、头痛、恶心等症状,无器质性病变,无其他妇科疾病发生,严重者发生休克、昏厥,严重影响患者的生活、工作和学习质量[1]。流行病学调查结果表明,原发性痛经具有覆盖面广、发病率高等特点[2-7]。因此,针对性治疗PD已成为临床研究热点之一。PD的发病机制与下丘脑-垂体-卵巢轴(hypothalamic-pituitary-ovarian axis,HPOA)的功能紊乱密切相关[8]。PD发生时可促进下丘脑分泌促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)[9],GnRH与促性腺激素释放激素受体(gonadotropin-releasing hormone-report,GnRH-R)结合后,刺激垂体黄体生成素(luteinizing hormone,LH)和促卵泡素(follicle-stimulating hormone,FSH)大量分泌,从而促进雌二醇(estradiol,E2)产生[10],抑制孕酮(progesterone,P)分泌,导致细胞膜磷脂中花生四烯酸的大量释放,引发子宫内前列腺素(prostaglandins,PG)等一系列致痛物质的产生[11-13]。
另一方面,PD引起的E2和P的分泌紊乱,可导致下丘脑GnRH脉冲分泌过多,形成恶性循环。β-内啡肽(β-endorphin,β-EP)可参与下丘脑-垂体功能调控,当β-EP水平降低时可诱发子宫收缩,引起痛经症状[14]。已有大量研究表明,药物可通过改善HPOA功能恢复起到治疗PD的作用[15-16]。
《素问·举痛论》曾记载“不通则痛”为PD的主要病机,“瘀血”为其主要病理改变,以“通”瘀血为主要治法,故活血化瘀为PD的重要治则[17]。桃红四物汤(Taohong Siwu decoction,THSWD)是出自《医宗金鉴》里的一味经典祛瘀生新方剂,全方由经典四物汤(熟地黄、川芎、当归、白芍)配伍红花、桃仁共奏养血补血、活血化瘀之功效[18],是治疗妇科瘀血症的常用方剂。在临床实践中,桃红四物汤对痛经有较好的治疗效果,其中桃红四物汤的总有效率为91.05%,在治疗痛经方面有较高的应用率,且无明显不良反应[19-21]。课题组前期研究表明,桃红四物汤对产后血瘀大鼠有明显的治疗作用,能明显减轻子宫的炎症反应,抑制全血黏度和血浆黏度[22],抑制血清溶血磷脂酸的含量[23],并通过调节PI3K/Akt信号通路促进一氧化氮(NO)和血管内皮生长因子(VEGF)的产生,起到“祛瘀生新”的作用,促进子宫修复[24-25]。与痛经相关的研究中发现桃红四物汤有明显的镇痛作用,其机制可能与调节性激素水平有关[26];同时,桃红四物汤通过调节血瘀综合征大鼠的雌激素及其受体水平来调节花生四烯酸的代谢[27-28]。与传统煎药相比,颗粒剂具有携带方便、便于保存和运输的优点。课题组前期对桃红四物颗粒剂制备工艺进行了探索和优化[29-30],在增加桃红四物颗粒的稳定性基础上,更加便于其临床应用。但桃红四物颗粒能否通过调控PD模型大鼠HPOA功能起到缓解痛经的治疗作用是值得深究的。本文通过建立PD模型大鼠,探讨了桃红四物颗粒对PD模型大鼠HPOA功能的影响,为其新药研发和现代临床应用提供参考。
1 材料
1.1 动物
健康的雌性Sprague-Dawley大鼠,体重200~240 g [安徽医科大学实验动物中心,伦理委员会批准文件号为No.AHUCM-2017001]。所有的大鼠都被安置在聚丙烯笼子里[温度(25±5)℃,相对湿度50%~60%],允许自由获取食物和水。
1.2 试药
采用课题组前期优化后的制备工艺制备桃红四物颗粒剂[30],并交由合肥华方医药公司进行批量生产(批号:190805)。戊酸雌二醇片(拜耳医药保健有限公司,批号:J20171038);妇科千金片(株洲千金药业有限公司,批号:Z43020027);催产素注射液(上海和丰药业,批号:J20171038);苏木精、伊红(珠海贝索生物技术有限公司);FSH、LH、E2、P、β-EP ELISA试剂盒(武汉基因美技术有限公司);β-actin抗体(北京中杉金桥生物技术有限公司,批号:19C10509);雌激素受体(estrogen receptor,ER)抗体(批号:0E00185623)、孕激素受体(progestogen receptor,PR)抗体(批号:AI12197160);缩宫素受体(oxytocin receptor,OTR)抗体(批号:AI08281924)、GnRHR抗体(批号:AF08042244)(北京博奥森生物技术有限公司);GnRH抗体(Santa Cruz,批号:K2403)。Novostart SYBR qPCR SuperMix Plus(北京安诺论生物科技有限公司,批号:0516511);PrimeScript抗体RT试剂盒与gDNAEraser(日本TaKaRa公司,批号:AJ51485A)。
1.3 仪器
EPS300型电泳仪、VE-186型转膜仪、PIKOREAL96型荧光定量PCR仪(上海天能科技有限公司);JS-1070P型自动曝光仪(上海培清科技有限公司);GT9612型基因扩增仪(杭州百恒科技有限公司);AF-10型自动制冰机(美国Scottsmann公司);HistoCore Arcadia型自动包埋机、CM1860型病理切片机(德国Leica公司);CX43型显微镜(深圳OLYMPUS公司);Bioprep-24型生物样品匀浆器(杭州澳盛仪器有限公司);Multiskan Spectrum型全波长酶标仪(美国Thermo Fisher公司)。
2 方法与结果
2.1 大鼠PD模型的建立[31]
通过阴道涂片法选择成熟雌性SD大鼠。除空白对照组外,连续灌胃戊酸雌二醇片10 d,1次·d-1(第1日与第10日给药0.2 mg,第2~9日给药0.1 mg),末次给药1 h后,除对照组大鼠外均腹腔注射催产素(2 U/只),观察各组大鼠在20 min内的扭体反应,记录大鼠首次发生扭体反应的潜伏期与扭体次数,并计算扭体次数抑制率,扭体次数抑制率(%)=(模型组扭体次数-给药组扭体次数)/模型组扭体次数×100%。其中发生扭体反应标准为:腹部内凹,后肢与躯干伸展,臀部抬高,并伴有一侧肢体内旋。
2.2 分组与给药
将大鼠随机分为正常组(Normal),模型组(Model),桃红四物颗粒高、中、低剂量组(18、9、4.5 g·kg-1),阳性药组[妇科千金片(FKQJ,0.08 g·kg-1)][32],每组10只。从造模的第5日起,按照10 mL·kg-1的体积灌胃给药,1次·d-1。正常组与模型组大鼠灌胃等量生理盐水。
2.3 样品采集
麻醉后迅速采集腹主动脉血液,放置20 min,以3000 r·min-1离心15 min,然后保留上清液置于-80℃保存。在冰浴环境下迅速分离大鼠子宫、下丘脑和卵巢组织,在-80℃冰箱中保存。同时将部分新鲜子宫组织保存在4%多聚甲醛溶液中,用于制作病理切片。
2.4 大鼠血清FSH、LH、E2、P和β-EP含量检测
按照“2.3”项下血清样本处理步骤,使用酶联免疫吸附法检测大鼠血清中FSH、LH、E2、P和β-EP的含量,操作步骤参考说明书。
2.5 Western blot法检测子宫中ER、PR、OTR及下丘脑与卵巢中GnRH、GnRHR蛋白表达水平
精密称取子宫、下丘脑和卵巢组织各80 mg,加入720 mL预冷的RIPA裂解液和PMSF混合物(RIPA∶PMSF=100∶1)。冰上裂解30 min后,低温离心(12 000 r·min-1,4℃)15 min,取20 mL上清液,使用BCA法测定蛋白浓度;剩余上清液加入5×上样缓冲液中,100℃煮沸10 min。样品变性后,使用不同浓度的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离等量的蛋白缓冲液,随后在低温下将蛋白转移到0.22 mm的NC膜上。用5%脱脂奶粉在室温下封闭2 h后,将膜与抗ER(1∶1000)、PR(1∶1000)、OTR(1∶1000)、GnRH(1∶2000)、GnRH-R(1∶1000)抗体在4℃下孵育过夜。将NC膜与HRP标记的山羊抗兔(1∶10 000)与山羊抗鼠(1∶10 000)抗体在室温下孵育2 h,TBST清洗结束后,使用超敏化学发光试剂显色,并使用Image J软件进行半定量分析。
2.6 免疫组化法检测子宫中ER、PR、OTR蛋白表达水平
采用石蜡包埋法制备子宫组织的病理切片。切片经程序脱水后加入0.1% Triton X-100进行破膜处理,滴加适量内源性过氧化物酶阻断剂室温孵育10 min,随即加入山羊血清室温封闭15 min,滴加抗ER(1∶200)、PR(1∶200)、OTR(1∶200)抗体湿盒4℃过夜。经PBS清洗后加入HRP标记的山羊抗兔IgG,37℃孵育10 min后,用PBS液清洗,加入DAB显色剂,在显微镜下观察,终止显色后用蒸馏水冲洗。随后采用苏木精染色1 min,清洗;1%盐酸酒精分化数秒,清洗;碳酸锂蓝1 min,清洗。最终脱水至透明,封片处理。使用CX43显微镜采集照片,并使用Image J软件进行分析。
2.7 荧光定量PCR检测下丘脑与卵巢中GnRH、GnRH-R mRNA表达水平
准确称取下丘脑和卵巢组织各80 mg,分别加入1 mL Trizol进行裂解匀浆处理。低温离心(12 000 r·min-1,4℃)10 min后,取上清液与0.2 mL氯仿混匀,冰上放置5 min。再次低温离心(12 000 r·min-1,4℃)10 min取上清液,加入相同体积的异丙醇,混合均匀,冰上孵育30 min。低温离心(12 000 r·min-1,4℃)15 min后,留取沉淀加入75%乙醇离心(12 000 r·min-1,4℃)5 min。冰上干燥RNA沉淀,加入50 μL DEPC水促溶,同时使用 Nanodrop2000 测定RNA浓度与纯度(A260nm/A280nm=1.8~2.0)。参照试剂盒说明书进行逆转录 cDNA 合成与荧光定量 PCR 反应。其中引物序列信息详见表1。

表1 引物序列信息Tab 1 Primer sequence information
2.8 统计学方法和处理
采用SPSS 23.0软件进行数据处理,连续变量用均数±标准差(±s)进行统计学描述。两组数据的比较采用独立样本t检验,多组平均值的比较采用单因素方差分析(P<0.05)。
3 结果
3.1 对PD模型大鼠扭体反应的影响
子宫强烈收缩引发的扭体反应是评判PD模型大鼠造模成功的经典指标[31]。如图1所示,与正常组相比,模型组大鼠扭体次数明显增加,扭体潜伏时间也明显缩短,提示造模成功。与模型组相比,桃红四物颗粒各剂量组可明显降低扭体次数,提高扭体次数抑制率,同时延长扭体潜伏时间。阳性药组同样可显著改善PD模型大鼠扭体反应。这提示桃红四物颗粒对PD模型大鼠具有良好的镇痛作用,且具备一定的剂量依赖性。
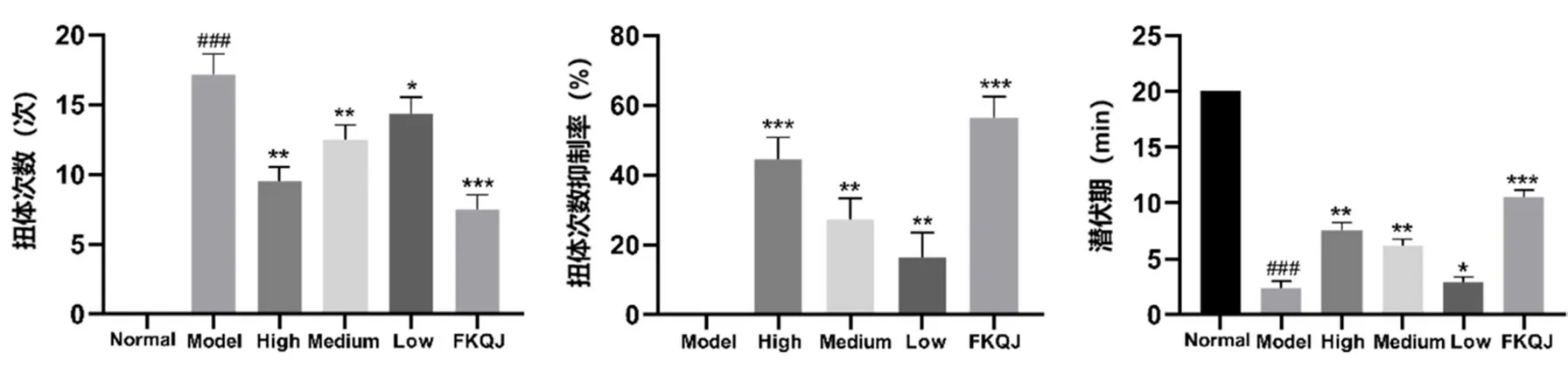
图1 桃红四物颗粒对PD模型大鼠扭体反应的影响(n=6)Fig 1 Effect of Taohong Siwu granules on the torsional responses in PD model rats(n=6)
3.2 对PD模型大鼠血清中FSH、LH、E2、P和β-EP含量的影响
如图2所示,与正常组相比,模型组血清中的FSH、LH与E2含量增加,相反,P和β-EP的含量则下调。与模型组相比,桃红四物颗粒高、中剂量组及阳性药组均可显著降低痛经大鼠血清中FSH、LH、E2水平,同时提高P及β-EP的表达水平。
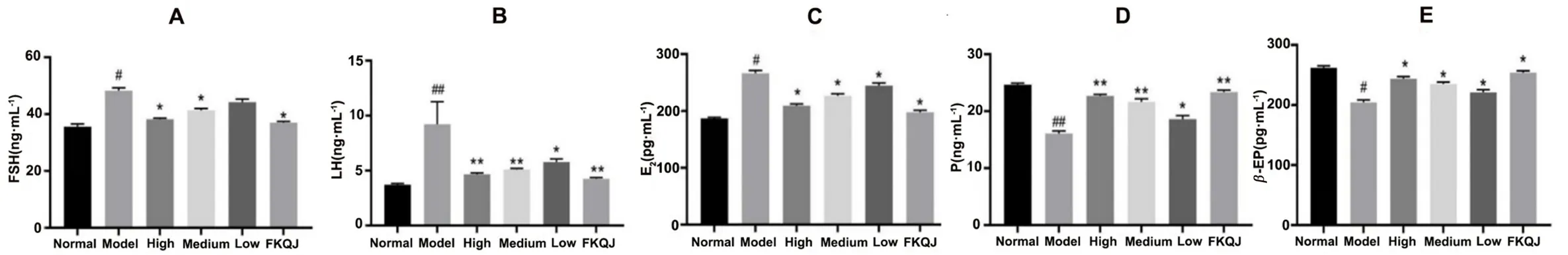
图2 大鼠血清中FSH(A)、LH(B)、E2(C)、P(D)及β-EP(E)的含量(n=6)Fig 2 Serum levels of FSH(A),LH(B),E2(C),P(D),and β-EP(E)in the rats(n=6)
3.3 对PD模型大鼠ER、PR、OTR、GnRH、GnRH-R蛋白表达量的影响
PR、OTR、ER分别能够识别和结合孕激素、缩宫素、雌激素及其类似物,从而发挥相应的生理效应。同时,激素水平的高低可直接或间接的调控激素受体水平[33]。为进一步阐释上述性激素与激素受体之间关系,我们检测了子宫组织中PR、OTR、ER蛋白表达水平。如图3所示,与正常组相比,模型组PR表达量下降,OTR和ER蛋白的表达量增加。与模型组相比,桃红四物颗粒高剂量组与阳性药组可有效提高PR表达量,同时降低痛经大鼠子宫组织中OTR和ER蛋白的表达。
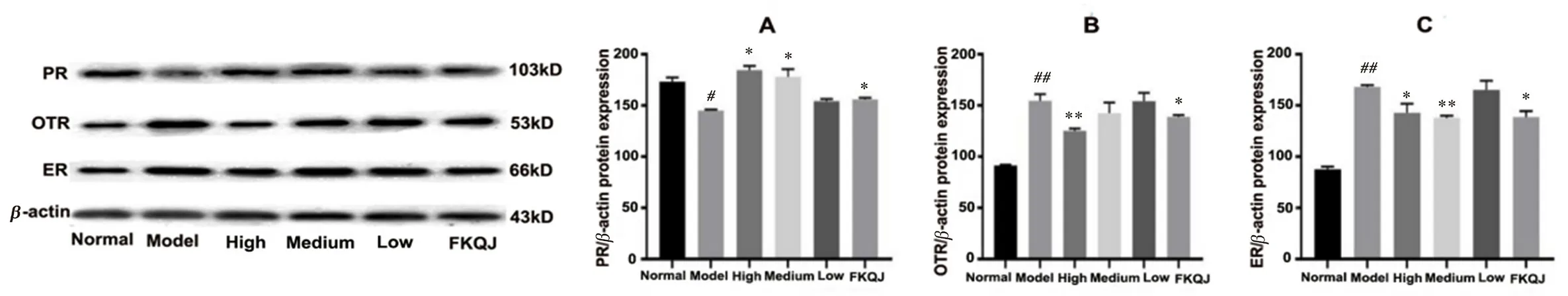
图3 子宫中PR(A)、OTR(B)及ER(C)蛋白的表达(n=3)Fig 3 Expression of PR(A),OTR(B),and ER(C)proteins in the uterus(n=3)
作为HPOA轴的上游,在PD模型中下丘脑与卵巢中的GnRH 2与GnRH-R结合,可进一步促进上述性腺激素的释放[34]。如图4所示,与正常组相比,模型组下丘脑和卵巢中GnRH 2及其受体GnRH-R的蛋白表达显著增加。与模型组相比,桃红四物颗粒高剂量组可有效降低痛经大鼠下丘脑和卵巢中GnRH和GnRH-R的蛋白表达。桃红四物颗粒高剂量组的效果与阳性对照药物的效果相似。
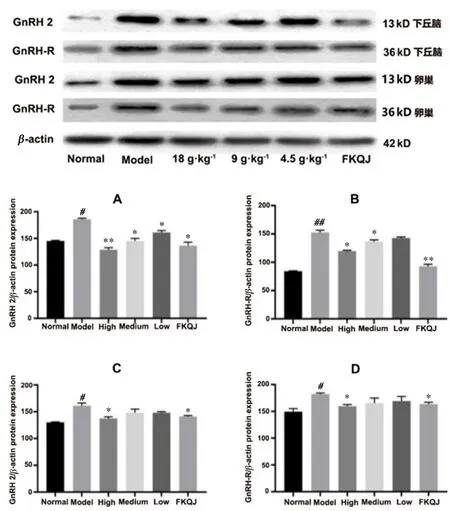
图4 下丘脑(A、B)与卵巢(C、D)中GnRH 2、GnRH-R蛋白的表达(n=3)Fig 4 Expression of GnRH 2 and GnRHR proteins in the hypothalamus(A and B)and ovary(C and D)(n=3)
3.4 免疫组化结果
为进一步观察子宫组织中ER、OTR、PR蛋白表达水平,本研究采用免疫组化评价上述指标。如图5与6所示,与正常组相比,模型组子宫组织中ER和OTR的阳性信号表达增加(P<0.01,P<0.05),PR表达下降(P<0.01)。与模型组相比,桃红四物颗粒高剂量组对痛经大鼠子宫组织中ER和OTR的阳性信号表达有显著抑制作用(P<0.05),可显著升高PR表达(P<0.05),且高剂量组桃红四物颗粒的效果与阳性对照组相似。
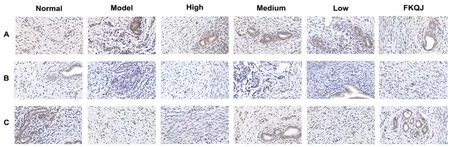
图5 免疫组化法测定各组子宫组织中ER、OTR及PR蛋白的表达(×400)Fig 5 Expression of ER,OTR,and PR proteins in the uterine tissues of each group by immunohistochemistry(×400)
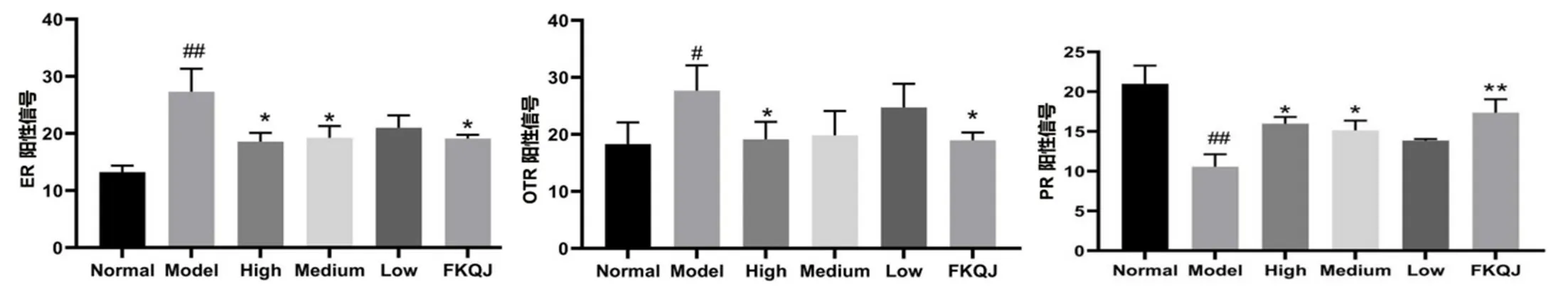
图6 各组大鼠子宫组织中ER、OTR及PR的表达(n=3)Fig 6 Expression of ER,OTR,and PR in the uterine tissue of rats in each group(n=3)
3.5 对PD模型大鼠下丘脑和卵巢中GnRH、GnRH-R mRNA的影响
下丘脑与卵巢中GnRH与GnRH-R含量检测常用GnRHmRNA与GnRH-RmRNA表达水平来表示。与正常组相比,模型组下丘脑(见图7A、7B)和卵巢(见图7C、7D)中GnRH及其受体GnRH-R的mRNA表达增加(P<0.01),与模型组相比,桃红四物颗粒各剂量组及阳性药组均可显著降低痛经大鼠GnRH和GnRH-R的mRNA表达。
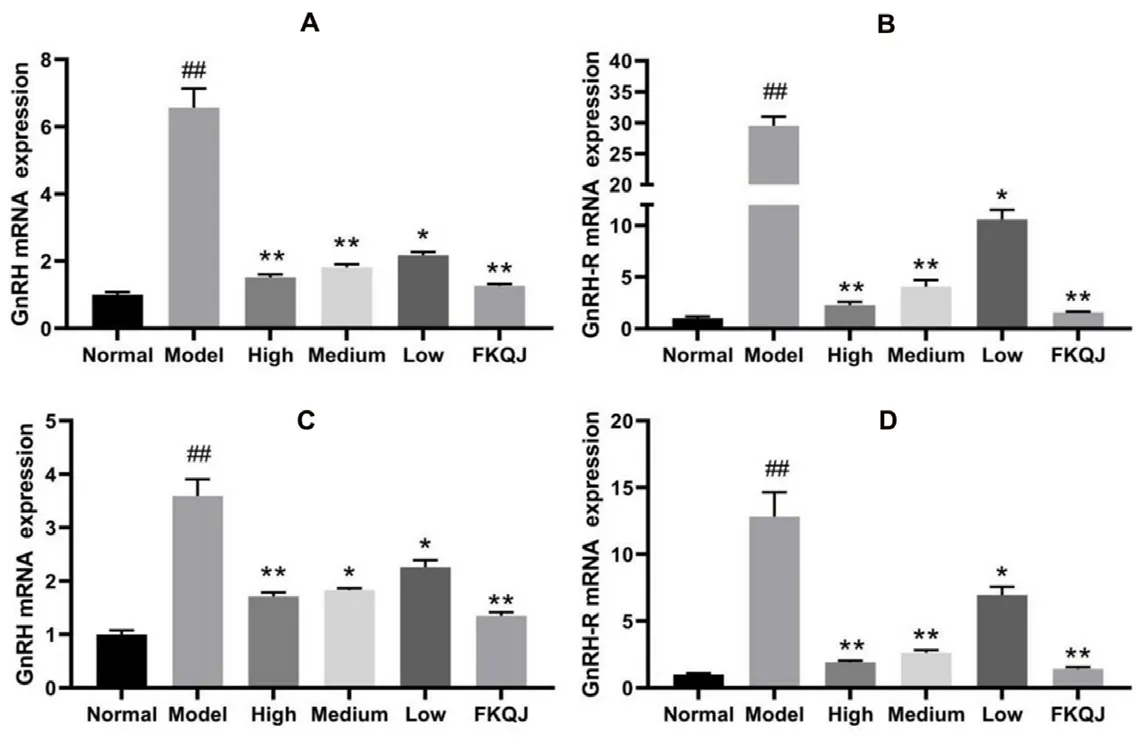
图7 下丘脑(A与B)和卵巢组织(C与D)中GnRH、GnRH-R mRNA的表达(n=6)Fig 7 Expression of GnRH,GnRH-R mRNA in hypothalamus(A and B)and ovarian tissue(C and D)(n=6)
4 讨论
PD是临床常见妇科疾病,研究表明其发病机制与HPOA功能紊乱密切相关[8]。下丘脑、垂体、卵巢及其分泌的激素之间的相互作用构成了HPOA系统,共同调节着身体的生理和病理状态[35-37]。下丘脑的神经内分泌细胞分泌GnRH,通过血液脉冲,输送到腺体,与GnRH-R结合,从而刺激垂体分泌FSH和LH,最后靶向卵巢,刺激卵巢分泌P和E2。同时,P和E2的分泌可以反馈调节下丘脑和垂体,实现整个系统的动态平衡,共同调节女性身体的健康,形成一个封闭的循环[38]。PD发生时,HPOA系统功能紊乱,诱发卵巢中的E2和P分泌紊乱,花生四烯酸经环氧化酶分解,于子宫处释放大量前列腺素等致痛物质,而引起痛经症状[39]。
本课题组前期研究表明,桃红四物汤具有良好的治疗痛经的效果,作用机制可能与调控HPOA性腺激素水平有关。本研究结果表明,桃红四物颗粒可有效改善PD模型大鼠扭体反应,有良好镇痛作用,其镇痛作用效果可能与降低下丘脑和卵巢GnRH、GnRH-R 蛋白和基因表达,抑制垂体与卵巢FSH、LH、E2的释放,升高P、β-EP 含量有关。其中,E2含量的降低与P含量的增加可以有效缓解子宫痉挛和血管收缩,起到镇痛效果[40-42]。此外,β-EP可以抑制GnRH脉冲发生器和LH的释放[43-45]。因此,下丘脑和卵巢中GnRH和GnRH-R的蛋白和基因表达的下降,可能与桃红四物颗粒增加β-EP的分泌有关。子宫内膜中含有丰富的ER、PR、OTR,其含量变化与PG的合成释放密切相关,其中ER与OTR含量变化与PG合成释放成正相关[33],而PR含量变化与PG合成释放成负相关[46]。桃红四物颗粒可显著降低子宫组织 ER、OTR的蛋白表达量,升高 PR 蛋白表达量,可能抑制子宫内前列腺素的合成与释放降低,发挥缓解PD模型大鼠痛经作用。
综上所述,桃红四物颗粒对PD模型大鼠有良好的治疗作用,其作用机制可能是通过调控HPOA系统的激素释放,间接影响性腺受体的产生,从而缓解痛经的症状,这为桃红四物颗粒进入治疗痛经的市场导向奠定了部分实验基础。然而PD的发病机制非常复杂,仍需进一步深入研究。

