ICU获得性衰弱模型大鼠细胞因子和骨骼肌病理结构的动态变化及意义
高 宇,谭旭宏,胡永胜
(1.贵州中医药大学 第二临床医学院,贵州 贵阳 550001;2.贵州中医药大学第二附属医院 重症医学科,贵州 贵阳 550001)
ICU获得性衰弱(ICU acquired weakness,ICU-AW)是一种以神经肌肉功能障碍为主,主要表现为对称性肌无力,常累及四肢及呼吸肌,且除危重症外没有其他合理的病因解释的临床综合征,是危重症病人常见的并发症[1]。近年来,随着危重症诊疗技术的发展,例如气管插管、机械通气的广泛应用以及充分的镇痛、镇静外加上广谱抗生素甚至激素的使用,虽然增加了危重患者的生存机会,但随之而来也要面临着ICU-AW的发病率逐渐升高[2-3]。调查显示,约80%的ICU-AW患者会发生膈肌功能障碍,这可能与感染导致细胞因子释放,进而诱导线粒体自由基生成,导致肌肉耐力和力量降低有关[4-6]。研究表明,在全身炎症反应中,相较于其他骨骼肌,膈肌损伤发生更早[7]。细胞因子作为神经、肌肉炎症级联反应及肌肉蛋白代谢的主要参与者,其不仅参与炎症反应,造成神经损伤,也会影响肌肉蛋白质代谢。目前关于ICU-AW骨骼肌损伤及细胞因子相关研究报道较少,故本次实验拟通过盲肠穿刺结扎法(CLP)构建大鼠ICU-AW模型,在观察ICU-AW模型大鼠骨骼肌损伤特点的基础上,进一步探讨骨骼肌损伤与炎症反应之间的关联,为ICU-AW的诊疗方向及炎症机制提供更多新的思路。
1 材料与方法
1.1 实验动物 54只SPF级SD雄性大鼠,6周龄,体重180~220 g,购于斯贝福(北京)生物技术有限公司[SCXK(京)2019-0010]。饲养条件:温度20~26 ℃,湿度45%~55%。
1.2 主要试剂与仪器 大鼠IL-1β、IL-6、IL-22(ELISA)测定试剂盒(MM-0046R1、MM-0190R1、MM-0670R1,江苏酶免实业有限公司);苏木素染液(G1004,Servicebio);苏木素返蓝液(G1040,Servicebio);伊红染色液(G1001,Servicebio);Masson三色染色液(G1006,Servicebio)。全自动酶标仪(WD-2012B,北京六一);电热恒温培养箱(DHP-9082B,上海-恒科学仪器有限公司);高速冷冻离心机(TGL-16.5M,上海卢湘仪离心机有限公司);组织脱水机(KD-TS3S1,浙江省金华市科迪仪器设备有限公司);石蜡包埋机(HistoCore Arcadia,Leica);切片机(HistoCore BIOCUT,Leica);摊片机(Leica HI1210,Leica);电热恒温干燥箱(HGZF-101-1,上海跃进医疗器械有限公司);显微镜(BX43,OLYMPUS)。
1.3 ICU-AW大鼠模型建立及分组 采用大鼠剪耳编号法,先将18只大鼠随机分为对照组、假手术组和模型组,每组6只,并记录各组大鼠体重,于造模后第6天全部处死后留取血清、膈肌及腓肠肌标本。随后将36只大鼠随机分为假手术组、模型组,每组18只,并记录各组大鼠体重,于造模后第1、3、6天,各组任意挑选6只大鼠,处死后取材。模型组通过CLP造模[8],术前禁食12 h,予腹腔注射1%戊巴比妥钠(50 mg/kg)麻醉满意后,开腹暴露盲肠,用4-0丝线在盲肠中段结扎,并于盲肠末端用18G针头对穿盲肠,挤出少量肠内容物后,回纳盲肠逐层缝合关腹。假手术组仅开腹拉出盲肠回纳腹腔后逐层缝合。对照组常规饲料正常喂养,不做处理。实验伦理审批编号为2022060201。
1.4 指标检测
1.4.1 一般情况 于实验开始后观察并记录各组大鼠的外观表现,包括精神行为状态、毛发光泽度及疏密情况、进食水情况、外界反应等。
1.4.2 体重、膈肌湿重、膈肌湿重/体重、腓肠肌湿重及腓肠肌湿重/体重 于造模后各时间点称取各组大鼠体重后处死,留取膈肌及双侧腓肠肌,分别称重,将一部分膈肌及左后肢腓肠肌置于-80 ℃冰箱中保存,用于后续ELISA检测。剩余膈肌及右后肢腓肠肌放入10%中性福尔马林溶液中待HE染色和Masson染色,并记录各组大鼠体重、膈肌湿重、膈肌湿重/体重、腓肠肌湿重及腓肠肌湿重/体重的变化。
1.4.3 ELISA检测 将待测大鼠血清、膈肌及腓肠肌组织匀浆离心后所得上清液,根据ELISA试剂盒说明书要求,测定吸光度(OD值),计算血清、膈肌及腓肠肌组织中IL-1β、IL-6及IL-22的水平。
1.4.4 大鼠膈肌、腓肠肌组织HE染色和Masson染色 将待测大鼠膈肌、腓肠肌组织用PBS(磷酸缓冲盐溶液)清洗后,滤纸吸干,各取2 cm组织放置于10%中性福尔马林溶液中固定24 h,依次进行脱水、包埋、切片、捞片、烤片、脱蜡水化、HE染色,封片后显微镜下观察拍照,并使用图像分析软件ImageJ对膈肌及腓肠肌纤维平均横截面积(cross-sectional area,CSA)进行统计。将组织石蜡切片依次进行常规梯度脱蜡至水,重铬酸钾染色,铁苏木素染色,丽春红酸性品红染色,磷钼酸染色,苯胺蓝染色,常规封片后显微镜下观察拍照,并使用图像分析软件ImageJ对膈肌及腓肠肌组织中胶原容积分数(collagen volume fraction,CVF)进行统计。CVF=同一视野中的胶原面积/所测视野总面积×100%。

2 结果
2.1 通过CLP建立ICU-AW模型 通过CLP建立ICU-AW大鼠动物模型,对照组与假手术组比较,在各项指标上均无显著差异(P>0.05);模型组大鼠体重、膈肌及腓肠肌湿重、膈肌湿重/体重及腓肠肌湿重/体重相较于对照组和假手术组均减低(P<0.05),而IL-1β、IL-6及IL-22的水平均增加(P<0.05,图1)。对照组和假手术组大鼠的骨骼肌组织结构无明显异常,组织中的胶原纤维含量较少;模型组膈肌及腓肠肌的肌纤维排列紊乱、间隙增宽,炎性细胞浸润,组织中的胶原纤维大量堆积;模型组肌纤维横截面积相较于对照组和假手术组均减低(P<0.05),而组织中胶原容积分数增加(P<0.05,图2)。

A1:各组大鼠体重比较;A2:各组大鼠膈肌及腓肠肌湿重比较;A3:各组大鼠膈肌湿重/体重及腓肠肌湿重/体重比较;B1:各组大鼠IL-1β水平比较;B2:各组大鼠IL-6水平比较;B3:各组大鼠IL-22水平比较;*:与同组对照组比较,P<0.05。 图1 各组大鼠体重、膈肌湿重、腓肠肌湿重、膈肌湿重/体重及腓肠肌湿重/体重和细胞因子水平比较

A:HE染色;B:Masson染色;标尺=50 μm;*:与同组对照组比较, P<0.05。图2 各组大鼠膈肌及腓肠肌病理变化和纤维横截面积及胶原容积分数比较
2.2 大鼠体重及膈肌、腓肠肌湿重 与同时间点假手术组相比,模型组大鼠体重、膈肌湿重、膈肌湿重/体重、腓肠肌湿重及腓肠肌湿重/体重在各时间点均减低(P<0.01)。假手术组体重、膈肌湿重、膈肌湿重/体重、腓肠肌湿重及腓肠肌湿重/体重在6 d中持续增加(P<0.05);模型组体重、膈肌湿重、膈肌湿重/体重、腓肠肌湿重及腓肠肌湿重/体重在6 d中持续减低(P<0.05,图3)。

*:与同时间点假手术组比较,P<0.01;a:与假手术组第1天比较, P<0.05;b:与假手术组第3天比较,P<0.05;c:与模型组第1天比较,P<0.05;d:与模型组第3天比较,P<0.05。图3 两组大鼠不同时间点体重、膈肌湿重、膈肌湿重/体重、腓肠肌湿重及腓肠肌湿重/体重比较
2.3 ELISA检测 与同时间点假手术组相比,模型组大鼠血清、膈肌及腓肠肌组织中IL-1β、IL-6及IL-22的水平在各时间点均增加(P<0.01)。假手术组所有细胞因子在各时间点差异无统计学意义(P>0.05);模型组血清、膈肌组织中IL-1β在第1天达到高峰(图4A1、A2);腓肠肌组织中IL-1β在6 d中持续升高(图4A3);模型组血清中IL-6在第3天达到高峰,第6天有所降低(图4B1);模型组膈肌组织中IL-6在第1天达到高峰(图4B2);模型组腓肠肌组织中IL-6在6 d中持续升高(图4B3);模型组血清、膈肌组织中IL-22在第1天达到高峰(图4C1、C2);模型组腓肠肌组织中IL-22在6 d中持续升高(图4C3)。

*:与同时间点假手术组比较,P<0.01;c:与模型组第1天比较, P<0.05;d:与模型组第3天比较, P<0.05。图4 两组大鼠不同时间点血清、膈肌及腓肠肌组织中IL-1β、IL-6、IL-22的水平比较
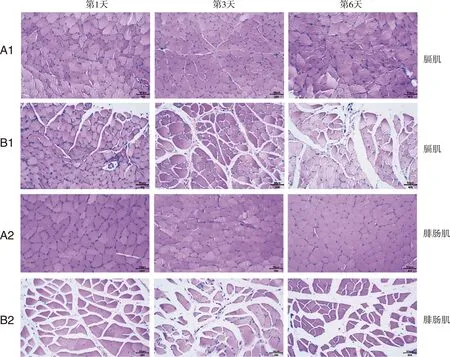
A1、A2:假手术组;B1、B2:模型组;标尺=50 μm;HE染色。图5 两组大鼠不同时间点膈肌和腓肠肌病理变化
2.4 膈肌及腓肠肌病理变化 如图5所示,假手术组大鼠各时间点膈肌及腓肠肌的纤维横切面呈多边形,排列均较为整齐,大小粗细均等,无充血、水肿及炎性细胞浸润的情况,细胞核呈圆形或椭圆形位于边缘。模型组大鼠膈肌及腓肠肌的肌纤维横切面呈不规则多边形,肌纤维排列紊乱、大小不均、间隙增宽,有大量炎性细胞浸润,且以弥散性炎性细胞增多为主,部分肌纤维肿胀,间质充血、水肿,术后第6天模型组病理情况较第1天和第3天逐渐严重化。与同时间点假手术组相比,模型组大鼠膈肌及腓肠肌纤维横截面积在各时间点均减低(P<0.01);假手术组膈肌和腓肠肌纤维横截面积在6 d中持续增加,而模型组膈肌和腓肠肌纤维横截面积在6 d中持续减低(P<0.05,见图6)。
如图7所示,假手术组大鼠各时间点膈肌、腓肠肌组织中的胶原纤维含量较少,排列整齐。模型组大鼠膈肌、腓肠肌组织中的胶原纤维大量堆积,排列紊乱,部分肌纤维肿胀。与同时间点假手术组相比,模型组大鼠膈肌及腓肠肌中胶原容积分数在各时间点均增加(P<0.01);假手术组膈肌及腓肠肌中胶原容积分数在各时间点均无显著差异(P>0.05);模型组膈肌和腓肠肌中胶原容积分数在6天中持续增加(P<0.05,图8)。

A1、A2:假手术组;B1、B2:模型组;标尺=50 μm;Masson染色。图7 两组大鼠不同时间点膈肌和腓肠肌病理变化

*:与同时间点假手术组比较,P<0.01;c:与模型组第1天比较,P<0.05; d:与模型组第3天比较,P<0.05。图8 两组大鼠不同时间点膈肌和腓肠肌胶原容积分数比较
3 讨论
目前ICU-AW常用的造模方法主要有糖皮质激素-去神经支配模型、脓毒症模型、废用性模型、高水平糖皮质激素模型、模拟ICU模型及兔烧伤模型等[9]。为了研究ICU-AW的骨骼肌内在炎症情况,本研究采用了CLP构建ICU-AW模型,结果显示,ICU-AW模型大鼠出现精神萎靡、竖毛、体毛干枯、进食水量减少、少动扎堆、腹泻等表现,症状随着时间推移逐渐加重,体重及骨骼肌湿重明显减低,体内炎性细胞因子显著增加,膈肌及腓肠肌病理切片可见肌纤维排列紊乱、间隙增宽、骨骼肌纤维萎缩、胶原纤维增多。这与唐章等[10]构建的ICU-AW大鼠模型结果相符。本文通过CLP成功构建了ICU-AW模型大鼠,为后续研究提供了基础。
炎性细胞因子可加重全身炎症反应,导致蛋白质代谢失衡和骨骼肌线粒体损伤,进而造成肌肉萎缩、肌肉氧化代谢能力减退和骨骼肌细胞凋亡[11-12]。IL-1β、IL-6、IL-22作为主要的炎性因子,不光由免疫细胞分泌,骨骼肌细胞也是其重要的分泌场所[13]。IL-1β作为细胞因子IL-1家族中的成员,由活化的巨噬细胞和非免疫细胞合成,基础状态下IL-1β在骨骼肌纤维中呈低水平表达,而在剧烈运动后和炎性肌病中表达升高[14]。Friedrich等[15]研究发现,IL-1β具有减少大鼠腓肠肌重量和降低蛋白含量的作用,而其受体拮抗剂能够对抗肌肉萎缩。李昊等[16]研究发现,肌萎缩侧索硬化模型小鼠骨骼肌和脊髓内IL-1β高水平表达,提示炎性反应可能与肌肉的去神经化和萎缩有关。IL-6是经典的炎症因子,具有多种生物学功能,在健康人体内处于极低水平,一般不超过7 pg/mL,但在感染早期2 h内可达到峰值,高水平升高时可造成神经细胞损伤[17]。过量的IL-6会刺激中性粒细胞,产生过量的弹性蛋白酶及活性氧,并进一步对神经系统造成损害[18]。Zanders等[19]研究发现,IL-6通过调控gp130/JAK2/STAT3信号通路可引起C2C12成肌细胞萎缩,参与脓毒症介导肌肉萎缩的发生。尹爱凝等[20]研究发现,榄香烯能够通过降低IL-6水平,调控泛素-蛋白酶体途径,缓解恶病质小鼠骨骼肌萎缩的发生。IL-22属于IL-10家族中的成员,主要由适应性及固有免疫细胞分泌,在抗微生物防御、保护及修复组织损伤、急性期反应等方面起关键作用,但高水平表达的IL-22在多种炎症性疾病、自身免疫性疾病、恶性肿瘤等条件下会诱导其他促炎因子的表达,引起组织损伤和慢性炎症等致病性效应[21-22]。IL-22所具有的促炎、抗炎双重特性,在不同的疾病中表现出的作用也不尽相同。刘爽等[23]研究也发现脓毒症患者外周血Th22和IL-22水平明显提高,外周血Th22与PCT、APACHE Ⅱ评分呈正相关。因此,本实验选择上述指标来研究ICU-AW模型大鼠细胞因子与骨骼肌损伤的关系。
本实验结果显示,模型组大鼠出现了明显的全身中毒症状;模型组大鼠体重、膈肌湿重、膈肌湿重/体重、腓肠肌湿重及腓肠肌湿重/体重相较于同时间点假手术组均减低(P<0.01),并随着病程进展,呈进行性下降;模型组大鼠骨骼肌存在肌纤维排列紊乱、间隙增宽、间质充血水肿、炎性细胞浸润和胶原纤维增多等病理表现;骨骼肌纤维横截面积低于同时间点假手术组(P<0.01),并持续减低;骨骼肌中胶原容积分数高于同时间点假手术组(P<0.01),并持续增加;这表明模型组大鼠存在骨骼肌萎缩及胶原纤维增加等病理表现,这与既往对于ICU-AW模型大鼠骨骼肌病理研究结果相一致[24]。另外,模型组大鼠血清、膈肌及腓肠肌组织中IL-1β、IL-6及IL-22的水平在各时间点均高于假手术组(P<0.01),且呈动态变化,说明ICU-AW模型大鼠不仅存在全身炎症反应,且膈肌及腓肠肌组织中也存在局部炎症反应。
综上所述,通过CLP建立的ICU-AW模型大鼠存在着全身中毒表现的外观特征,血清及骨骼肌组织中炎性细胞因子也呈高水平表达,骨骼肌组织切片中出现了明显的肌肉萎缩、胶原纤维增多及炎性细胞浸润等病理变化,并随着造模时间延长持续加重,表明了ICU-AW中表现出的骨骼肌损伤与炎症反应之间存在着密切联系,其机制可能与肌肉细胞中炎性因子的过度表达有关,但其更深的调控机制还需要进一步研究。

