自发性膀胱破裂致假性肾衰竭
李 喆 罗 松 易晓明 王 杨 许书添 李世军
[作者单位]1东部战区总医院 国家肾脏疾病临床医学研究中心(南京,210016);2医学影像科;3泌尿外科
病史摘要
现病史54岁男性患者,因“腹胀、血尿、少尿、血清肌酐(SCr)升高1周余”于2023-04-23入院。
2023-04-14夜间患者饮用53°白酒约400 mL,次日晨起酒醒后自觉腹胀,解出鲜红色尿液,尿量偏少(200~400 mL/d)。至当地医院查SCr 598 μmol/L、血尿素氮(BUN)29.6 mmol/L、尿酸(UA)826.4 μmol/L、肌酸激酶482 U/L、血钾5.0 mmol/L、钠127.8 mmol/L、抗中性粒细胞胞质抗体(ANCA)、抗肾小球基膜(GBM)抗体、抗核抗体谱全阴性,迅速进展至无尿。4月17日SCr升至813.3 μmol/L、BUN 33.4 mmol/L,予右侧颈内静脉置管后开始血液透析治疗。期间行腹腔穿刺置管,查腹水白细胞1 920×106/L、李凡他试验阳性、总蛋白11.7 g/L、血清白蛋白6.5 g/L、球蛋白5.2 g/L、乳酸脱氢酶134.5 U/L、腺苷酸脱氨酶0.7 U/L,连续引流出腹水3 000 mL/d。上述症状持续不缓解,出现腹痛并逐渐加重。患者精神萎靡,乏力、纳差,睡眠一般,大便正常,无尿。
既往史平素体健,患者分别在今年3月26日、4月2日、4月9日完成3次全程马拉松比赛,均在4 h以内完成。
家族史父母已故,家族中无传染病及遗传病史。
体格检查体温36.1 ℃,脉搏91次/min,呼吸17次/min,血压149/96 mmHg,脉氧100%,右侧颈内静脉透析导管固定在位,腹部膨隆,全腹部压痛阳性,无反跳痛,移动性浊音阳性。
实验室检查
尿液 无尿。
血常规 白细胞9.41×109/L、中性粒细胞71.1%、淋巴细胞16.8%、血红蛋白146 g/L、血小板234×109/L、C反应蛋白3.3 mg/L。
血生化 降钙素原0.12 μg/L、脑利钠肽前体5.05 pmol/L、肌红蛋白46.5 ng/mL、肌酸激酶86 U/L、总胆红素14.2 μmol/L、总蛋白81.4 g/L、白蛋白48.2 g/L、球蛋白33.2 g/L、谷丙转氨酶20 U/L、谷草转氨酶22 U/L、乳酸脱氢酶236 U/L、SCr 537.0 μmol/L、BUN 25.1 mmol/L、胱抑素C(CysC)1.18 mg/L、钠130 mmol/L、钾4.6 mmol/L、氯96 mmol/L、钙2.26 mmol/L、磷2.75 mmol/L、总二氧化碳11.5 mmol/L、淀粉酶112 U/L、脂肪酶529 U/L。
免疫检查 补体C3 1.39 g/L,C4 0.386 g/L,抗核抗体(ANA)、抗双链DNA(dsDNA)抗体、ANCA、抗GBM抗体、抗核抗体谱、自身免疫性肝病相关抗体均阴性,IgG 14.9 g/L、IgA 4.14 g/L、IgM 2.06 g/L、IgE 45.3 IU/mL、IgG4 0.528 g/L,血沉48 mm/h,类风湿因子、抗“O”阴性,血管内皮生长因子(VEGF)57.56 pg/mL,透明质酸、层黏连蛋白、Ⅲ型前胶原N端肽、Ⅳ型胶原等肝纤维化指标均正常,血单特异性游离轻链κ15.3 mg/L,λ15.1 mg/L,κ/λ 1.01,免疫固定电泳未见单克隆免疫球蛋白条带。
腹水 淡红色,微混,李凡它实验阴性,红细胞3 692/μL,白细胞339/μL,中性粒细胞8%,淋巴细胞92%,葡萄糖 10.4 mmol/L,总蛋白 20.0 g/L,乳酸脱氢酶 87 U/L,腹水培养无菌生长,腹水脱落细胞未找到癌细胞。
辅助检查
B超 左肾:108 mm×54 mm×54 mm;右肾:107 mm×48 mm×53 mm,皮质回声增强,皮髓界限清楚。输尿管、肝门静脉未见异常。前列腺增生。
例如,我们首先对全部的KiK-Net-SF数据集进行反演,得到初步的滑动模型。在输入的数据集中如果某一观测的地表位移值与预测值失配超过一定阈值则定为离群值。作为例子,图5显示了去除与模型偏差超过15°的离群值矢量后的KiK-Net两个数据集。这里选择15°作为方向阀值,使得滤波后的KiK-Net-SF数据仍然表现出空间变化的合理相干性。我们没有根据矢量幅度对离群位移值滤波,因为它对约束震源定位影响不大。对离群值滤波后,与GPS数据相比,KiK-Net-BH数据集的统计偏差由之前的37%降至20%。
CT 腹盆腔积液,胆囊结石,左肺下叶炎症,主动脉及冠状动脉管壁钙化。
CTA 胸主动脉、腹主动脉结构、位置、走行正常。
诊疗分析本例患者临床特点:(1)中年男性,既往体健;(2)突发腹胀、血尿、少尿,并迅速进展至无尿、大量腹水,腹水性质倾向于漏出液,血液透析及持续腹腔引流,症状无缓解;(3)低钠、高钾血症,SCr和BUN明显升高,但CysC正常;对患者发现急性肾损伤(AKI)的病因鉴别如下。
布加综合征(BCS) 由各种原因导致肝静脉和下腔静脉阻塞性病变引起的肝后门脉高压症,常伴下腔静脉高压。静脉血栓或静脉炎引起的梗阻为原发性BCS,恶性肿瘤压迫或侵犯肝静脉、下腔静脉导致的梗阻为继发性BCS。在亚洲多见于中青年男性,常见临床症状包括发热、黄疸、右上腹痛、迅速出现的大量腹水和由于肾脏灌注不足导致的少尿。本例患者肝功能、胆红素、CT肝脏大小及密度均正常,超声探查肝门静脉未见异常,故不支持BCS诊断。
急性主动脉夹层(AAD) AAD病因包括高血压、动脉粥样硬化、马凡综合征,常见临床症状为血管壁撕裂导致的剧烈胸背疼痛、腹痛、肢体麻木,夹层累及肾动脉时影响肾脏血供,可出现少尿、无尿。本例患者血压正常,无其他基础疾病,且AAD无法解释顽固性腹水。进一步完善胸腹主动脉CTA排除了AAD的可能。
横纹肌溶解症(RM) 由过量运动、肌肉挤压、极端体温、药物毒物等多种原因导致的横纹肌损伤,大量肌红蛋白、乳酸脱氢酶、磷酸肌酸激酶等细胞内成分进入外周血,进一步引起肌红蛋白尿,导致AKI。常见临床症状包括肌肉酸痛、肿胀,全身乏力、酱油色尿、无尿等。本例患者起病前有大运动量体育活动,是RM的高发人群。但起病时最近一次马拉松比赛已结束5 d,无肌肉酸痛,血肌酶不高,解鲜红色尿液,而非酱油色尿液,故不支持RM诊断。
急进性肾炎综合征(RPGN) 以血尿、蛋白尿、肾功能急剧进行性恶化为特点的一组临床综合征,肾脏病理常表现为新月体肾炎。本例患者入院后完善多种自身抗体检查均为阴性,排除ANCA相关血管炎、抗GBM肾炎、狼疮性肾炎的可能。
诊疗经过及随访患者入院后查SCr高、CysC正常,考虑假性肾衰竭可能,送检腹水尿素 47.3 mmol/L、肌酐 2 598.6 μmol/L,腹水/血液肌酐>1.0,进一步考虑腹腔积液为尿液外渗可能,CT尿路造影(CTU)显示,膀胱前壁局部缺损(图1A、B),盆腔内造影剂外漏、聚集(图1C),提示腹膜内型膀胱破裂。予头孢哌酮舒巴坦抗感染,留置导尿管,尿量立即恢复至2 000~3 000 mL/d,腹水引流减少至100~150 mL/d,并逐步消退。送检尿红细胞186.3/μL、尿白细胞 45.3/μL、尿C3 2 mg/L,尿α2巨球蛋白(尿α2-M) 8.1 mg/L、尿N-乙酰-β-D-氨基葡萄糖苷酶(NAG)16 U/(g·Cr)、视黄醇结合蛋白(RBP)0.15 mg/L、中性粒细胞明胶酶相关脂质运载蛋白(NGAL)30 ng/mL。次日SCr降至128.7 μmol/L、BUN 16.1 mmol/L,拔除颈内静脉血透导管。1周后复查SCr 63.8 μmol/L、BUN 3.8 mmol/L,腹水肌酐 50.3 μmol/L、尿素4.3 mmol/L。2周后膀胱造影及CTU均未见造影剂外漏,膀胱破裂口愈合(图2),拔除导尿管,完全康复。
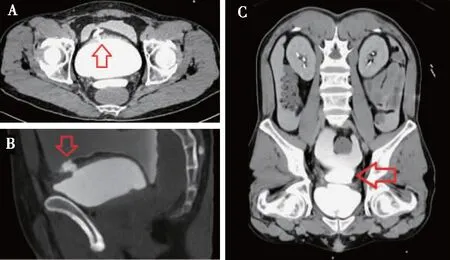
图1 A、B:患者CT尿路造影膀胱前壁局部缺损();C:盆腔内造影剂外漏、聚集()
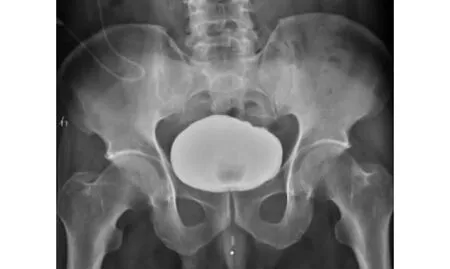
图2 患者留置导尿管2周后膀胱造影未见造影剂外漏,膀胱破裂口完全愈合
最后诊断(1)腹膜内型自发性膀胱破裂(SRUB);(2)假性肾衰竭;(3)大量腹腔积尿;(4)中度低钠血症;(5)前列腺增生。
讨 论
膀胱破裂是一种潜在危及生命的紧急状况,需要及时诊断和治疗。根据破裂的解剖部位可分为腹膜外型、腹膜内型和混合型膀胱破裂。根据损伤原因可分为创伤性和非创伤性,前者常见于骨盆损伤,非创伤性很少见,包括医源性损伤和SRUB。医源性损伤可能与泌尿外科手术、结直肠和妇科手术以及导尿管置入术有关[1]。SRUB相对罕见,早年报道其发病率为1∶126 000,近年发现实际发病率达1∶50 000。尽管发病率偏低,但死亡率曾达47%~80%,死亡风险与导致膀胱破裂的潜在未诊断疾病相关[2]。
SRUB常见病因包括恶性肿瘤、盆腔放疗、慢性膀胱感染或炎症、神经源性膀胱、酒精中毒、膀胱憩室和膀胱流出道梗阻,导致膀胱内压力增加或膀胱壁强度减弱。膀胱圆顶是受骨盆膈肌支撑最少的区域,也是唯一被腹膜覆盖的部分。随着膀胱内压力增加,肌束广泛分离,膀胱过度扩张、变薄,导致增大的膀胱圆顶突出至下腹部而失去骨盆保护,更易破裂[3]。腹膜外破裂最常见的表现是腹痛和排尿困难。腹膜内破裂经典三联征为肉眼血尿、腹痛、排尿困难或无法排尿。酒精中毒通过多种机制增加膀胱破裂的风险:(1)酒精的利尿作用产生的大量尿液;(2)酒精可直接加重既有的前列腺肥大,导致膀胱颈梗阻恶化;(3)酗酒时恶心呕吐增加腹内压力;(4)醉酒时感觉受损导致膀胱过度扩张;(5)醉酒后可能忘记或忽视轻微创伤[4]。本例患者为醉酒后起病,超声可见前列腺增生,追问病史,为提高马拉松比赛成绩,长期主动憋尿,是SRUB的高危人群。近期关于SRUB的系统评价发现,351例患者的中位年龄47.5(33,65)岁,出现症状的中位时间48(24,96)h,主要症状包括腹痛(76%)、恶心呕吐(23%)、腹胀(21%)和急性尿潴留或排尿困难(18%)。盆腔放疗(13%)和酒精中毒(11%)是最常见的诱因。89%为腹膜内型,其中膀胱圆顶破裂最常见(55%)。中位SCr 393.0 (199.8,590.8)μmol/L、BUN 21.5 (13.0,35.0)mmol/L。误诊率高达64%,死亡率为15%[2]。我国学者曾回顾文献总结SRUB常见确诊方式为剖腹探查(51.89%)、膀胱造影(22.64%)、CTU(14.15%)、膀胱镜(8.02%)、美蓝试验(3.3%)。主要误诊疾病为急腹症(78.57%)、消化系统炎症(11.69%)、膀胱肿瘤或炎症(5.84%)、AKI(4.55%)[5]。
由于创伤性和医源性膀胱破裂病史明确,确诊不难,及时处理不会出现SCr升高和氮质血症[6]。但腹膜内型SRUB的破裂口与腹腔相通,尿液可进入腹腔,引起急性腹膜炎。早期低渗尿液进入腹腔后引起的腹膜刺激征较轻,尤其当合并其他疾病时易被忽视而导致漏诊。后期发展成感染性尿性腹膜炎时腹部症状明显加重。由于腹膜吸收能力强,大量尿液进入腹腔后,有毒代谢产物吸收入血,产生“反向腹膜透析”,导致以低血钠、高血钾、高SCr和氮质血症为特征的假性肾衰竭[7](图3)。假性肾衰竭目前定义为非肾前、肾性或肾后性肾损伤的SCr升高,无肾脏灌注不足,无尿路梗阻,亦无肾脏疾病。由于肌酐、尿素产生或重吸收增加,测量出SCr、BUN升高,而实际肾小球滤过率正常。除SRUB外,静脉注射地塞米松、口服肌酸补充剂、以及头孢西丁和丙酮酸盐均是干扰SCr测量,导致假性肾衰竭的原因[8]。
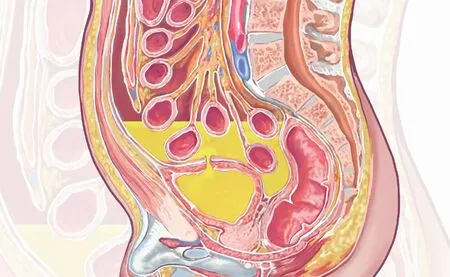
图3 反向腹膜透析示意图
曾有外科医师总结,在评估患者的病史、腹水生化和血液电解质特征后,一旦怀疑膀胱破裂,立即留置导尿管,并根据腹水、血液、尿液的肌酐比值进行鉴别。生理状态下,腹水/血液肌酐接近1,尿液/血液肌酐在30~100。而膀胱破裂时尿液/血液肌酐通常接近5,腹水/血液肌酐显著>1,尿液/腹水肌酐显著<50。如符合上述特征可进一步完善膀胱造影或CTU明确诊断(图4)[9]。CysC从肾小球滤过后可完全被肾小管上皮细胞重吸收并于细胞内降解,不重新回到血液中,同时肾小管上皮细胞也不分泌CysC。因此,其血液浓度主要由肾小球滤过率决定,与BUN、SCr比较,具有更高的敏感度和特异度[10]。本例患者假性肾衰竭时SCr、BUN高,而CysC正常,反映肾小球GBM通透性的尿C3、α2微球蛋白和肾小管损伤程度的尿NAG、RBP、NGAL均不高,展现了上述指标在真假肾衰竭鉴别诊断中的独特价值。
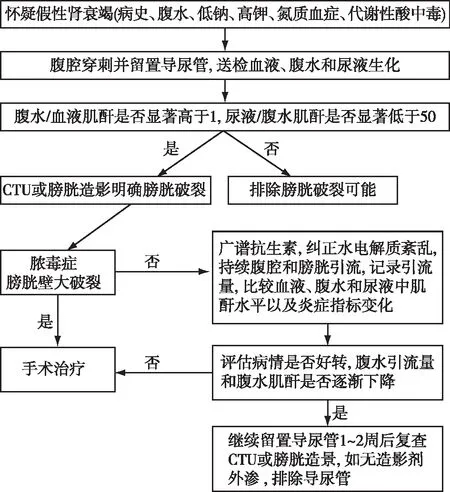
图4 膀胱破裂导致的假性肾衰竭诊疗流程图[9]
SRUB的早期诊断和治疗与良好的预后密切相关,剖腹探查术是确诊的金标准,膀胱造影是首选诊断方法,敏感度(90%~95%)和特异度(100%)均较高。由于CTU能全面显示腹部多个器官的优点,被视为疑似膀胱破裂的最佳术前评估手段,但由于膀胱膨胀不全和造影剂稀释,即使导尿管夹闭被动充盈膀胱也不能完全排除膀胱破裂可能,一些小破口并不能被发现,其假阴性率高(64%~84%),而准确率低(15%~25%),因此CTU不能单独作为膀胱破裂的首选诊断方法[11]。
由于腹膜内型膀胱破裂口通常较大,美国和欧洲的泌尿外科协会指南均推荐手术治疗,以避免感染性尿性腹膜炎和腹腔脓毒症的出现,可选择开放手术或腹腔镜手术[12-13]。但当患者延迟诊断时间较长时,膀胱破裂口处于水肿状态,手术难度较大,可先留置导尿管7~10 d,充分引流膀胱内尿液,同时积极应用抗生素预防感染,必要时待水肿消退后,行二期手术进行膀胱修补。膀胱破裂口较小的患者可优先考虑留置导尿管保守治疗[14-15]。SRUB系统评价中开放手术占71%、保守治疗占13%、腹腔镜手术占4%,与开放手术相比,保守治疗的膀胱破裂复发率更高(23%vs6.8%),需要加强健康宣教,出院后密切门诊随访[2]。
小结:SRUB临床表现非特异性,易漏诊误诊,醉酒是常见诱发因素。膀胱造影是首选无创诊断方法,CTU是最佳术前评估手段。尿液外渗腹腔后吸收入血的“反向腹膜透析”是SRUB诱发假性肾衰竭的致病机制。对于无严重感染、出血或破裂口较小的患者,可先行采用留置导尿管充分引流尿液的保守治疗。
致谢:插画师罗琼英为本文绘图

