基于两样本孟德尔随机化研究探究ω-3脂肪酸与年龄相关性黄斑变性之间的因果关系
朱露,蒋洪湖,朱静吟
复旦大学附属华东医院眼科,上海 200040
年龄相关性黄斑变性(age-related macular degeneration, AMD)是老年人视力障碍和视力丧失的主要原因。据统计,当前我国70岁及以上人群AMD的患病率为20.2%[1]。随着我国人口老龄化程度加剧, AMD的患者数也在持续上升。临床上常根据是否有新生血管将AMD分为干性AMD和湿性AMD[2]。目前,靶向血管内皮生长因子(vascular endothelial growth factor, VEGF)治疗湿性AMD已取得重大突破,但对视力丧失的晚期AMD患者暂无有效的防治手段[3]。ω-3脂肪酸是生命活动所必需的多不饱和脂肪酸,包括二十碳五烯酸(eicosapentaenoic acid, EPA)和二十二碳六烯酸(docosahexaenoic acid, DHA)等。由于人体内ω-3的转化能力十分有限[4],因此经由饮食摄入丰富的EPA和DHA(如鱼类和海产品)是获得足够ω-3脂肪酸的重要途径。研究显示,饮食中富含ω-3与较低风险的AMD相关[5]。然而,年龄相关性眼病研究2(Age-Related Eye Disease Study 2, AREDS2)[6]和营养性AMD治疗2(Nutritional AMD Treatment-2, NAT-2)[7]发现,补充ω-3并不能防止AMD进展。孟德尔随机化研究(Mendelian randomization study, MR)利用与暴露因素强相关的遗传变异作为工具变量,评估暴露因素与结局之间的关系[8]。虽然ω-3会对AMD的发生发展产生影响,但是各项研究结果间存在很大的异质性。因此本研究采用两样本MR设计,将ω-3相关的遗传变异作为工具变量,通过MR来研究ω-3与AMD是否存在关联,以期为防治AMD发生发展提供循证依据。
1 资料与方法
1.1一般资料本研究设定ω-3为暴露因素,以AMD和干性AMD为结局,使用两样本MR评估ω-3与AMD的因果效应。其中, ω-3数据来自IEU Open全基因关联研究(genome-wide association, GWAS)数据库(https://gwas.mrcieu.ac.uk/datasets/met-d-Omega_3/)。包括114 999例欧洲个体,单核苷酸多态性(single-nucleotide polymorphism, SNP)数量为12 321 875个。AMD数据来自FinnGene研究(https://gwas.mrcieu.ac.uk/datasets/finn-b-H7_AMD/)。截至2021年该数据包括3 763例AMD病例和205 359例对照, SNP数量为16 380 424个,人群年龄中位数为76.58岁(其中男性76.51岁,女性76.64岁)。干性AMD数据(https://gwas.mrcieu.ac.uk/datasets/finn-b-DRY_AMD/)包括2 469例干性AMD病例和206 221例对照, SNP数量为16 380 423个,人群年龄中位数为76.19岁(其中男性75.95岁,女性76.42岁)。见表1。

表1 两样本MR研究中GWAS数据库
1.2工具变量SNP筛选从ω-3的GWAS数据库中筛选出P<5×10-8的SNP。设置连锁不平衡参数(R2=0.001,区域宽度10 Mb),确保选定的SNP之间相互独立。从AMD的GWAS数据库中提取与ω-3密切相关的SNP,将2组SNP数据集合并,同时移除与AMD直接相关(P<5×10-8)的SNP,去除存在回文变异的SNP。回文变异定义为相同的等位基因出现在正链和负链。本研究通过F=beta2/se2计算统计强度,避免出现弱工具偏倚,F>10定义为无弱工具偏倚,去除F<10的SNP[9]。
1.3两样本MR分析因果效应的主要估计方法为逆方差加权法(inverse-variance weighted, IVW),在无异质性和水平多效性存在的情况下,这种方法可以提供最准确的分析结果[10]。水平多效性定义为SNP通过与暴露无关的途径影响结局。异质性定义为SNP之间的差异[11]。此外,本研究还使用了MR-Egger回归和加权中位值(weighted median, WME)作为IVW结果的补充证据。当水平多效性和异质性存在的情况下,这2种方法可以提供相对准确的估计,本研究中更关注其方向和效应大小[12]。
1.4敏感性分析使用敏感性分析评估潜在的异质性和水平多效性是否对结果有显著影响。Cochran’s Q检验评估SNP之间的差异,差异越小提示异质性越小,P<0.05表示具有异质性。通过MR-Egger回归中SNP的截距评估潜在的水平多效性,若截距与0相隔较远,则存在水平多效性,反之则无,P<0.05表示存在水平多效性。通过MR多效性残差和离群值(MR pleiotropy residual sum and outlier, MR-PRESSO)检验中的全局测试检测SNP中水平多效性和异常值的存在(P<0.05)。留一法逐一剔除SNP,并计算其余SNP的合并效应,以此评估每1个SNP对结局的效应[13]。
1.5统计学分析所有统计学分析均在R版本4.2.2中进行,比值比(odds ratio,OR)和95%置信区间(confidence interval,CI)用以估计由暴露存在引起的相对风险[13]。P<0.05 认为差异有统计学意义。
2 结果
2.1工具变量共有49个SNP纳入本研究,所有SNP与ω-3密切相关(P<5×10-8),F统计量均>10,提示49个SNP均为有效工具变量,而由弱工具变量所造成的偏倚不会对MR分析的因果推断产生影响。
2.2两样本MR分析结局为AMD的两样本MR分析, IVM结果显示遗传预测的ω-3水平与AMD风险降低相关(OR=0.837, 95%CI: 0.747~0.937,P=0.002)。结局为干性AMD的两样本MR分析, IVM结果显示遗传预测的ω-3水平与干性AMD风险降低相关(OR=0.837, 95%CI: 0.735~0.953,P=0.007)。MR-Egger回归和WME结果显示OR<1,提示因果效应方向一致。见表2。
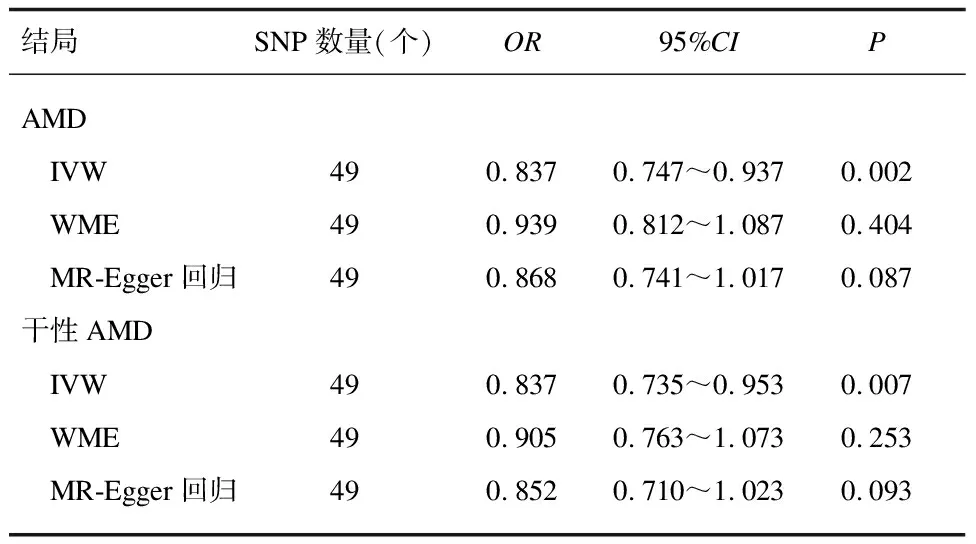
表2 ω-3与AMD风险之间的关联
2.3敏感性分析Cochran’s Q检验结果显示, SNP之间无异质性(PAMD=0.295,P干性AMD=0.473)。漏斗图显示纳入的SNP基本对称,提示因果关联受到潜在偏倚的影响较小。MR-Egger回归的截距显示不存在水平多效性(PAMD=0.515,P干性AMD=0.785),说明SNP只能通过ω-3影响AMD。MR-PRESSO检验未检测到异常的SNP,且不存在水平多效性(PAMD=0.234,P干性AMD=0.437)。逐个剔除SNP后IVW分析结果与全部SNP的分析结果相似,提示不存在对因果效应影响较大的SNP。见表3。

表3 ω-3与AMD风险之间关联的敏感性分析
3 讨论
本次研究结果显示, ω-3水平与AMD风险降低相关(OR=0.837, 95%CI: 0.747~0.937,P=0.002); ω-3水平与干性AMD风险降低相关(OR=0.837, 95%CI: 0.735~0.953,P=0.007)。与传统的观察性研究和随机对照试验相比, MR是一种兼具灵活性和稳健性的统计方法,通过使用遗传变异作为工具变量,从而减少观察性研究中的混杂、反向因果关系和回归稀释偏倚。该研究中的ω-3数据来自IEU Open GWAS数据集, AMD数据来自FinnGene研究,以上数据人群分层相对集中,且病例群体主要为76岁左右的老年人,上述因素可以最大限度减少人群分层偏差的可能性,这种相似性提升了两样本MR假设的可行性,即遗传关联结果是从相同或可比人群的样本中获得的[14]。此外,通过MR-Egger回归分析和MR-PRESSO检验来估计效果,为验证研究结果的非水平多效性提供了依据。MR-Egger回归截距显示不存在水平多效性(PAMD=0.515,P干性AMD=0.785), MR-PRESSO检验显示未检测到异常SNP且不存在水平多效性(PAMD=0.234,P干性AMD=0.437),以上结果提示所筛选的49个SNP只能通过ω-3影响AMD及干性AMD。
ω-3对视网膜结构的保护具有重要作用[15], DHA在光感受器的膜上富集达到最高浓度,对光感受器的分化和存活以及视网膜功能具有重要影响。而炎症因子也是AMD的发病因素之一[16], EPA和DHA的抗炎特性[17]对AMD有益。ω-3可能会增加黄斑色素密度,这种色素可以过滤蓝光,并具有局部抗氧化和抗炎活性[18],对黄斑区视网膜有保护作用。而在AREDS2[6]和NAT-2[7]中发现,单纯补充ω-3并不能直接预防AMD进展。考虑AREDS2中的样本量是基于AREDS的预期进展率所获得,研究将试验组相较于安慰剂组进展为晚期AMD的发生率减少25%定义为有意义,如补充ω-3的有益效能低于AREDS的预期进展率,则AREDS2显示结果无意义[19]。此外, AREDS2中超过60%的受试者受过本科及以上教育,日常饮食营养丰富;而对照组中超过11.1%的受试者自行服用ω-3,违反了协议指导方针,这些受试者并未按照干预组管理细则进行进一步分类,这种错误分类可能导致主要结果无效[20]。事实上, AREDS2受试者的一些关键基线营养参数(包括血清叶黄素、玉米黄质、 DHA和EPA)高于一般人群,以上干扰因素并未在AREDS2研究中排除[6]。而在NAT-2中假设DHA组和安慰剂组3年内发生脉络膜新生血管形成(choroidal neovascularization, CNV)的风险分别为19.8%和33.0%,检验效能为80.0%,计算样本量。DHA组3年以上CNV发生率(28.4%)高于预期,安慰剂组3年以上CNV发生率(25.6%)低于预期,其样本量估算的参数设置不合理,不符合临床实际情况,这可能导致主要结果无效[7]。此外, NAT-2补充分析发现DHA对CFH Y402H非风险等位基因纯合的患者有显著保护作用(HR=0.14, 95%CI: 0.03~0.59,P=0.008),但DHA对纯合子(HR=2.33, 95%CI: 0.98~5.55,P=0.06)或杂合子风险等位基因(HR=1.19, 95%CI: 0.56~2.51,P=0.65)均无显著影响[21]。可见补充DHA和CNV之间的联系可能受到遗传易感性的影响,特别是与CFH Y402H变异有关, CFH Y402H所赋予的AMD遗传易感性可能限制DHA补充剂所提供的益处。膳食补充剂ω-3配伍的不同也可影响人体的生物利用度,例如AREDS2中DHA与EPA的比例为1∶2,而NAT-2中DHA与EPA的比例3∶1。
AMD是导致老年人失明的主要原因,55岁以上人群的发病率与年龄呈正相关[22]。中国约有500多万AMD患者,随着我国经济、医疗水平和平均预期寿命的提高, AMD的患病率一直在上升[2]。AMD严重影响患者视力功能,致使其阅读和驾驶等重要活动减少,抑郁和情绪障碍等疾病发生率增加[22]。治疗AMD的首要目标是提高视功能,最大限度减少患者视力丧失或延缓病情进展。AMD的主要非遗传危险因素是年龄、高血压、高胆固醇血症、吸烟、缺乏运动、肥胖和饮食中抗氧化剂的低摄入[22]。AMD相关的主要遗传变异是补体因子H(complement factor H, CFH)和补体因子I,补体成分C2、 C3以及年龄相关性黄斑病变易感基因2[23]。根据眼底表现, AMD分为湿性AMD和干性AMD,湿性AMD约占AMD的10%,可通过玻璃体注射抗VEGF药物治疗,然而对于更常见的干性AMD尚无有效的药物[24]。针对危险因素中抗氧化剂的低摄入,研究者选用类胡萝卜素、姜黄素、锌、ω-3等营养素作为膳食补充剂,结果证实类胡萝卜素(即叶黄素和玉米黄质)与ω-3的膳食补充组合对延缓或改善早/中期AMD患者进展的效果最好[25]。此外,有证据表明携带AMD不同风险等位基因的患者可能受益于个性化营养补充[23]。然而目前对遗传表型和不同营养补充剂对AMD的进展影响了解仍十分有限。高分辨率视网膜成像技术的进步使AMD在体内可以精确表型,结合临床病理和遗传相关性,强调了AMD的异质性。目前众多学者认为AMD代表一种由不同表型和不同发病机制组成的疾病谱[3]。综上,针对特定的表型和阶段量身定制营养支持方法,可能是未来预防AMD发生发展的有效措施,但需更多临床研究数据来验证。
本研究通过两样本MR探讨ω-3是否对AMD有影响,结果与ω-3对黄斑区视网膜的保护作用一致,提示AMD患者可能缺乏ω-3的保护,而通过补充剂或饮食富集提供ω-3,可能有助于延缓AMD的发生发展。然而本研究仍有局限性:(1)研究无法精准评估EPA、 DHA等ω-3脂肪酸与AMD之间的因果关联; (2)ω-3的GWAS效应大小是基于血浆浓度计算的,无法准确反映细胞膜的ω-3浓度,这些膜浓度可能会直接影响AMD的风险[7]; (3)鉴于难以直接确定饮食对AMD的因果关系,需要更多高水平研究来验证ω-3对各类AMD亚型的具体影响。鉴于现有研究的局限性和结果的多样性,亟待确定ω-3补充需要的剂量和维持时间等对各类型AMD患者的影响,进而为改善AMD患者生活质量提供临床诊疗思路。

