阶梯式营养干预配合量化式目标锻炼对老年急性髓系白血病化疗患者营养状态及生活质量的影响
唐亚丽,罗婷,沈宏宇,袁晓晶,杜丹丹
1. 四川大学华西医院血液内科/四川大学华西护理学院,四川成都 610041; 2. 成都上锦南府医院手术室,四川成都 611730; 3. 江油市人民医院呼吸与危重症医学科,四川江油 621700
急性髓系白血病(acute myeloid leukemia, AML)是临床常见血液系统恶性肿瘤,我国发病率约为5.1例/10万人,其中多发于老年群体,患者中位确诊年龄为68岁,超过2/3的患者确诊年龄超过55岁,且除急性早幼粒细胞白血病(M3)具有较好的治疗预后外,其他类型的AML患者预后均较差,且死亡率较高[1-3]。老年AML治疗以化疗药物诱导缓解治疗为首要,对部分患者建议进行造血干细胞移植,但由于身体状态较差、基础疾病较多等不利因素,常造成老年AML患者对化疗的耐受性较差,治疗中断次数较多,对其预后造成不良影响[4]。报道[5]显示,癌症患者预后情况与其营养状态具有密切联系,当患者营养不良程度较为严重时,其化疗耐受性越差,进而造成预后较差。因此,为提高老年AML患者化疗预后,还需对患者进行营养干预。目前针对老年AML化疗患者的营养干预尚未形成统一规范,常规干预主要是根据患者营养状况安排饮食,保证能量摄入,但此法未能综合考虑患者个体差异及耐受程度,难以获得有效营养改善效果,对提高患者化疗耐受性效果欠佳。阶梯式营养干预是一种基于量化指标、分层管理的个性化干预方法,报道[6]显示,此法可有效改善患者营养状态,对治疗有利。然而,阶梯式营养干预配合量化式目标锻炼对老年AML化疗患者的临床效果如何,尚待研究。于是,本研究观察阶梯式营养干预配合量化式目标锻炼对老年AML化疗患者营养状态、生活质量及化疗耐受性的影响,结果如下。
1 资料与方法
1.1一般资料四川大学华西医院进行化疗治疗的老年AML患者自2020年8月开展阶梯式营养干预,选取2019年5月—2020年7月接受传统营养干预的患者55例及2020年8月—2021年12月接受阶梯式营养干预的患者55例的临床资料进行回顾性分析。按照患者不同营养干预方式分为观察组(目标锻炼基础上给予阶梯式营养干预)和对照组(目标锻炼基础上给予传统营养干预)。2组一般资料差异无统计学意义(P>0.05)。见表1。

表1 一般资料对比例(%)]
1.2纳入及排除标准纳入标准: (1)确诊为非M3型AML者[7]; (2)按预定方案接受住院诱导化疗治疗者; (3)年龄≥65岁者; (4)预计生存期>3个月者; (5)患者主观整体评估(PG-SGA)量表得分>2分[8],结合血清学指标判断为营养不良及存在营养不良风险者; (6)有智能通讯设备; (7)有常驻本地; (8)签署研究知情同意书。符合上述全部选项的患者才纳入本研究。排除标准: (1)继发性AML者; (2)伴有其他恶性肿瘤者; (3)肝肾功能严重障碍者; (4)无法配合治疗者; (5)既往系统性接受营养干预指导。具备上述任意1项的患者不纳入本研究。
1.3方法2组患者均接受低强度常规化疗[9],诱导缓解方案包括: DA、 HA、 HAG、 CAG。2组均接受量化式目标锻炼,具体操作: (1)制定锻炼方案:干预开始前,对患者身体情况进行评估,并与患者及其家属进行沟通后制定锻炼方案,标注每日锻炼量,并告知患者及其家属量化式目标锻炼的目的及内容; (2)呼吸锻炼:指导患者进行腹式呼吸,即腹部在鼻吸气时缓慢隆起,之后憋气5 s再缓慢吐气, 1组重复40次,3组/d; (3)运动锻炼:各项运动锻炼均1组重复20次, 3组/d;指导患者进行前伸屈锻炼,即伸直双臂后曲肘;进行下肢膝关节伸屈锻炼;平躺于床上,进行足背过屈过伸锻炼,脚趾进行上翘下压锻炼;弯曲双膝,掌心向下支撑床面,臀部进行抬起放下锻炼;于床上侧卧,双手抓住固定栏杆,双脚连续蹬床面。
对照组在量化式目标锻炼基础上给予传统营养干预,具体操作:根据患者实际身体状态建立营养档案,并联合营养科制定营养干预计划,确保患者三大营养素的摄入量及摄入质量,合理搭配碳水化合物。蛋白质及脂肪的摄入比例,并注意补充维生素和微量元素;患者定期进行复诊,复诊时根据患者淀粉酶等常规检测结果调整饮食结构,并及时向患者及其家属反馈修改后的营养搭配方案。
观察组在量化式目标锻炼基础上给予阶梯式营养干预,具体操作: (1)评估营养状态:患者入组后使用护理人员用PG-SGA评估患者营养状态,得分2~4分为可疑营养不良风险,得分5~8分为中度营养不良,得分>8分为重度营养不良。(2)计算能量消耗、设定目标:根据Harris-Benedict公式(男性: 66.47+13.75×体质量(kg)+5.003 3×身高(cm)-6.775×年龄(y);女性: 655.1+9.563×体质量(kg)+1.850×身高(cm)-4.676×年龄(y)计算患者基础代谢[10],根据患者病情计算应激系数,总热量=基础代谢×应激系数×活动系数,计算患者总能量。(3)阶梯式干预:根据患者入院首次营养状态评估结果采取分级干预方式,可疑营养不良患者接受营养宣教+常规饮食指导,中度营养不良患者接受营养宣教+常规饮食指导+口服营养补充,重度营养不良患者接受营养宣教+常规饮食指导+肠外营养+肠内营养。初始阶段以摄取60%总能量为目标,为患者准备饮食或提供建议,每2 d评估患者能量摄取达标情况,对达标患者维持当前护理操作,对未达标患者提升阶梯层行上层营养干预操作,干预2 d后再次评估能量摄入达标情况,对能量摄入为100%总能量的患者行降阶梯层营养干预操作。干预期间重复上述操作,每2 d统计能量摄入达标情况,以60%总能量和100%总能量为条件调节患者阶梯层及对应操作。(4)质量控制:患者出院前检查相关指标,调整营养分级,出院后依托微信平台和电话随访确保日常营养干预措施落实,院外期间患者每天记录空腹体质量、每日运动量、对三餐饮食进行拍照发送给护理人员,护理人员结合体质量、运动、饮食进行评价及针对性指导,每2 d对患者评估日常摄入与耗能差值,调整护理层级,每周日电话随访1次结合本周体质量变化趋势及日常饮食执行情况进行个人指导,每月患者返院复查人体成分并测量皮褶厚度。2组患者均进行干预3个月。
1.4观察指标与方法(1)疗效评价: 于2组患者干预3个月后,评估2组患者临床治疗效果,分为完全缓解(CR)、部分缓解(PR)、未缓解(NR),临床治疗总有效率=(CR例数+PR例数)/总例数×100%[11]。(2)营养状态评估:于干预前、出院前、干预3个月后,使用全自动生化分析仪检测患者血清中TRF、ALB水平;采用PG-SGA量表[8]评估患者营养状态,该量表总分0~35分,得分越高说明患者营养状态越差;统计患者BMI、三头肌皮褶厚度。(3)生活质量评估:于2组患者干预前、出院前、干预3个月后,采用癌症生命质量测定量表(FACT-G)评估,该量表分为生理状况(PWB)、社会/家庭状况(SWB)、情感状况(EWB)、功能状况(FWB)4个分量表,总分分别为0~28、 0~28、 0~24、 0~28,得分越高说明患者生活质量越高[12]。(4)化疗耐受性评估:于2组患者干预前、出院前、干预3个月后,采用美国东部肿瘤协作组(ECOG)评分评估患者化疗耐受性,该评分总分0~5分,得分越低说明患者化疗耐受度越好[13];记录2组患者干预期间治疗中断次数。(5)不良反应发生情况:记录干预期间骨髓抑制等不良反应发生情况。总不良反应发生率=(发生1种不良反应例数+发生2种不良反应例数)/总例数×100%。

2 结果
2.12组疗效比较干预3个月后,观察组患者治疗总有效率高于对照组(P<0.05)。见表2。

表2 临床治疗效果比较[例(%)]
2.22组营养状态指标值比较干预前, 2组患者TRF、 ALB水平、 BMI、三头肌皮褶厚度差异均无统计学意义(P>0.05)。出院前及干预3个月后, 2组患者TRF、 ALB水平、 BMI、三头肌皮褶厚度均明显高于同组干预前(P<0.05),观察组患者TRF、 ALB水平、三头肌皮褶厚度均明显高于对照组(P<0.05), 2组患者出院前BMI差异无统计学意义(P>0.05);出院前及干预3个月后, 2组患者PG-SGA评分明显低于同组干预前,而观察组患者PG-SGA评分明显低于对照组(P<0.05)。见表3。

表3 2组营养状态指标值比较
2.32组患者FACT-G各项评分比较干预前, 2组患者FACT-G各项评分差异均无统计学意义(P>0.05)。出院前及干预3个月后, 2组患者FACT-G各项评分均明显高于同组干预前,而观察组FACT-G各项评分均明显高于对照组(P<0.05)。见表4。

表4 2组患者FACT-G各项评分分)
2.42组患者ECOG评分和治疗中断次数比较干预前, 2组患者ECOG评分差异无统计学意义(P>0.05)。出院前及干预3个月后, 2组患者ECOG评分明显低于同组干预前(P<0.05), 2组患者出院前ECOG评分差异无统计学意义(P>0.05);干预3个月后,观察组患者ECOG评分低于对照组(P<0.05);干预期间,观察组患者治疗中断次数少于对照组(P<0.05)。见表5。
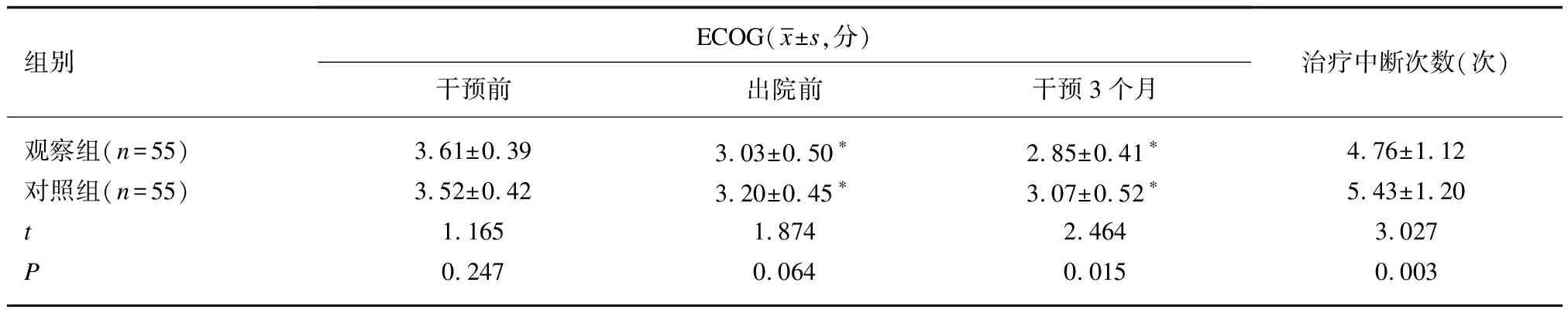
表5 2组患者ECOG评分和治疗中断次数比较
2.52组不良反应发生情况比较干预期间, 2组总不良反应发生率差异无统计学意义(P>0.05)。见表6。

表6 2组不良反应发生情况比较[例(%)]
3 讨论
化疗是老年AML患者主要临床治疗方案,具有较好的治疗效果,但多数老年患者因体能、合并症等因素,对化疗耐受度较低[14],且化疗还会诱发恶心呕吐等消化道不良反应,造成患者营养不良状态,严重者需终止化疗[15]。
能量与蛋白质摄入均达标是肿瘤患者较为理想的营养干预目的[16],而对患者提供合理、有效的营养干预可保证患者能量摄入水平,有利于患者恢复[17]。本研究结果显示,进行营养后, 2组营养状况及化疗耐受性均较干预前明显提升,分析是因为AML患者由于收到疾病等因素影响,长期处于营养摄入及吸收不足的状态,且由于老年患者机体消化能力下降、心理作用、化疗后不良反应等因素影响,导致老年AML患者摄食量进一步降低,最终导致患者临床疗效降低、生活质量下降等,而对老年AML患者进行量化式目标锻炼可促进患者肌张力恢复,提高患者机体血液循环水平及氧合能力,同时还可增强患者心肺功能,且对患者进行合理的日常锻炼还可放松患者心情,间接减缓患者身体衰老过程[18]。而出院前及干预3个月后比较2组间各项数据显示,观察组较对照组表现更佳,说明联合阶梯式营养干预更有助于改善老年AML患者营养状态,提高其化疗耐受性。考虑是因为:阶梯式营养干预有别于传统营养干预,强调循序渐进,首先入院时通过PG-SGA量表对患者营养状态进行评估,将患者营养不良程度分级,拟定初始营养干预阶梯设计对应营养干预策略,对可疑营养不良患者专注健康宣教增强患者自我管理能力,促进其主动参与营养干预;而对于中度营养不良的患者则根据患者胃肠道耐受能力逐级选择合适的人工营养方案,在保证患者营养摄入足够的同时刺激患者胃肠蠕动,以促进患者胃肠功能恢复,提升机体吸收水平,而对于重度营养不良的患者,则给予全人工营养方案,以保证患者摄入足够营养物质[19]。值得强调的是,本研究对患者营养阶梯层级的更改严格遵循定量参数,对患者营养状态评估分级同时依据公式计算每个患者的总能量,以60%总能量为节点判断是否需要提高营养阶梯层级,保证患者获得更佳的营养摄入,而对于阶梯层级下调则更加严格,以100%总能量为节点确保患者恢复良好营养状态。
有研究发现,患者的营养水平对癌症治疗效果具有一定影响,体质量减轻较快的患者其预后更差[20]。本研究结果显示,观察组患者临床治疗总有效率显著高于对照组;干预后,观察组患者FACT-G各项评分均显著高于对照组,提示阶梯式营养干预联合量化式目标锻炼可有效改善老年AML患者生活质量,且可有效提升老年AML患者化疗临床治疗效果。推测是由于联合干预措施通过改善老年AML患者营养状态,提高患者对化疗治疗耐受性,减少患者因不耐受导致的治疗暂停次数,最终达到提高患者临床治疗效果的目的,这与戴科军等[21]研究结果一致。值得一提的是,干预期间, 2组不良事件总发生率无明显差异,与临床相关研究有所差异,张晓萌等[22]研究认为,使用阶梯式营养干预有助于改善患者免疫功能,增强化疗耐受力,可见此法有效改善营养状态不仅可以直接提高机体对化疗药物的耐受性,而且可以通过提高机体免疫力,减少干预期间化疗不良事件发生。基于保障化疗次数、提高治疗效果,可帮助改善患者身体情况,进而提高其生活质量。而本研究中无明显差异考虑与样本量较少相关。
阶梯式营养干预联合量化式目标锻炼干预老年AML患者为临床干预制定每阶段目标,根据患者不同阶段身心情况,给予针对性干预,可全面满足患者个性化护理需求,为临床老年AML营养护理提供新方法。但本研究观察期较短,且样本量较少,临床可进一步扩大样本量、延长观察时间,分析此干预方案对于老年AML患者生存期、生存率的影响效果。
综上所述,阶梯式营养干预联合量化式目标锻炼可有效改善进行化疗治疗的老年AML患者营养水平,提高患者对化疗治疗的耐受度,患者生活质量得到明显改善,且保障化疗治疗效果,降低不良事件发生风险,具有临床参考应用价值。

