阿司匹林对老年结直肠腺癌患者术后的预后影响
林小萍,彭冲,吕晓敏,朱勇莉,陆平,杨柳
1. 上海交通大学医学院附属第九人民医院老年病科,上海 200011; 2. 上海交通大学医学院附属第九人民医院药剂科,上海 200011; 3. 上海市消化道微生态相关重大疾病研究重点实验室,上海 200125
结直肠癌(colorectal cancer, CRC)是发生于结肠或直肠的消化系统恶性肿瘤,截至2020年我国CRC的发病率在恶性肿瘤中已经上升至第2位[1]。90%以上的病例确诊时年龄>55岁[2],因此CRC已成为威胁老年人生存的重大疾病之一。随着我国人口老龄化进程加剧以及健康预期寿命延长, CRC的防治明显加重了医疗和经济负担[3]。虽然近年来CRC的治疗方案有所完善,但多数患者仍易在采用一线化疗方案后复发[4],部分患者对新型靶向药物不敏感[5],因此CRC患者的治疗仍面临极大的挑战。研究显示,阿司匹林(aspirin, ASP)能够提高CRC患者的术后生存率,价格低廉、不良反应较少有望成为防治CRC的有效药物[6]。但ASP对老年CRC患者的预后影响一直存有争议,且目前将我国老年人群作为独立群体的研究仍较少。因此,本研究以老年患者为研究对象,回顾性观察ASP对老年CRC的预后影响。
1 资料与方法
1.1一般资料回顾性分析2013年1月—2018年5月于上海交通大学医学院附属第九人民医院手术治疗的老年CRC患者资料。纳入标准:(1)年龄≥60岁; (2)符合《中国结直肠癌诊疗规范(2020年版)》[7]的诊断标准,病理诊断为结直肠腺癌; (3)手术治疗。排除标准:(1)其他原发性肿瘤; (2)合并其他重症疾病; (3)精神障碍者; (4)病历资料不全。最终纳入274例老年CRC患者,年龄60~92岁,平均(72.2±8.2)岁,其中男性188例、女性86例。根据患者确诊后有无连续服用ASP(100 mg/d)≥6个月分为ASP组(n=60)和非ASP组(n=214)。
1.2方法收集受试者的年龄、性别、吸烟史、饮酒史、合并心脑血管疾病史、临床首发症状、合并肠梗阻等一般资料。明确患者的手术方式、肿瘤部位、肿瘤最大直径、分化程度、淋巴结转移、脉管浸润、新肿瘤-淋巴结-远处转移(tumor-node-metastasis, TNM)分期[8]等手术资料。记录患者入院后术前的中性粒细胞、淋巴细胞、单核细胞、血小板、白蛋白、血红蛋白、甲胎蛋白(alpha fetoprotein, AFP)、癌胚抗原(carcinoembryonic antigen, CEA)、糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)以及糖类抗原125(carbohydrate antigen 125, CA125)。明确患者术后是否接受放化疗。
1.3观察指标分析患者术后5年内的复发与生存情况,统计患者的无病生存期(disease-free survival, DFS)。复发指患者手术治愈后出现原发部位的再次生长或其他部位的转移。患者手术治愈后至肿瘤复发或远处转移的时间定义为DFS。

2 结果
2.12组一般资料比较老年CRC患者ASP组与非ASP组一般资料差异均无统计学意义(P>0.05)。见表1。
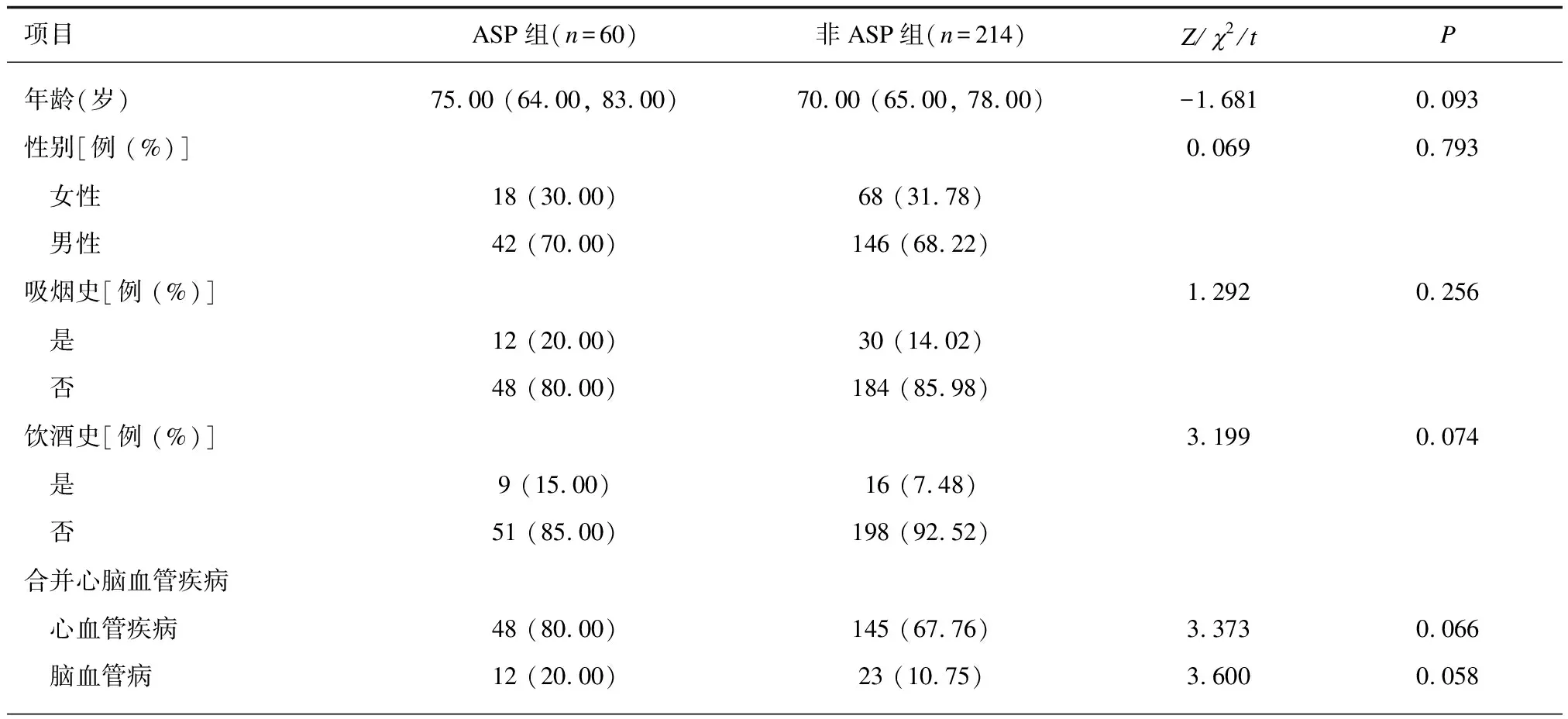
表1 2组一般资料比较
2.22组复发情况与DFS比较与非ASP组比较, ASP组复发患者较少(36.92%vs18.33%,χ2=7.336,P=0.007)。Kaplan-Meier生存分析显示,与非ASP组比较, ASP组3年、 4年和5年累积DFS较长(P<0.05)。见图1。
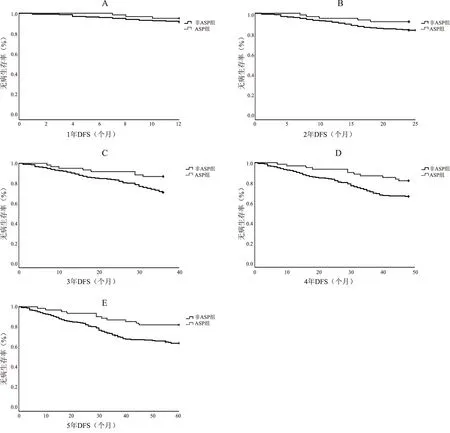
注: A. 1年DFS(P=0.324); B. 2年DFS(P=0.107); C. 3年DFS(P=0.015); D. 4年DFS(P=0.019); E. 5年DFS(P=0.008)。
2.3老年CRC术后复发的影响因素以CRC术后有无复发为因变量(0=未复发,1=复发),以年龄(原值输入)、 TNM分期(0=Ⅰ期,1=Ⅱ期,1=Ⅲ期)、肿瘤最大直径(原值输入)、 CA19-9(原值输入)、 CEA(原值输入)、 CA125(原值输入)、 ASP(0=非ASP组, 1=ASP组)为自变量,行logistic回归分析。结果显示,年龄增大、 TNM分期Ⅲ期、肿瘤最大直径增大、 CA125升高是老年CRC术后复发的危险因素,服用ASP是术后复发的保护因素(P<0.05)。见表2。

表2 Logistic回归分析老年CRC术后复发的影响因素
2.4老年CRC术后DFS的影响因素以CRC术后DFS为因变量(0=未复发,1=复发),以年龄(原值输入)、 TNM分期(0=Ⅰ期, 1=Ⅱ期, 1=Ⅲ期)、肿瘤最大直径(原值输入)、 CA19-9(原值输入)、 CEA(原值输入)、 CA125(原值输入)及ASP(0=非ASP组, 1=ASP组)为自变量,行COX回归分析。结果显示,年龄增大、 TNM分期Ⅲ期、肿瘤最大直径增大是老年CRC术后DFS的危险因素。服用ASP是术后DFS的保护因素(P<0.05)。见表3。
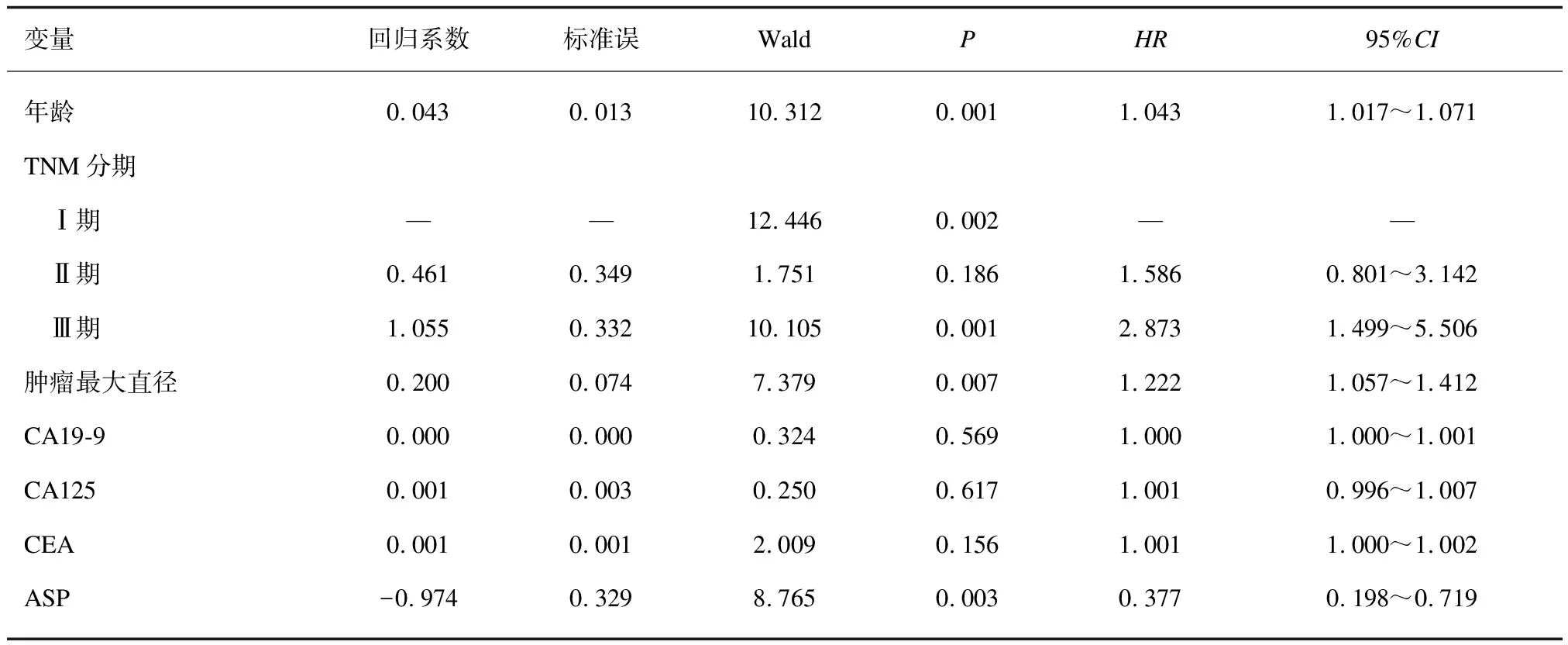
表3 Cox回归分析老年CRC术后DFS的影响因素
3 讨论
老年CRC患者手术或放化疗后,其癌症的复发和死亡率仍较高。既往研究显示, ASP能有效减少CRC患者术后复发[9]。本研究发现,服用ASP的老年CRC患者术后复发率低于非ASP组(36.92%vs18.33%),可见老年CRC患者术后使用ASP或能改善预后。
ASP是非甾体抗炎药,主要用于止痛、解热与消炎等,能有效抑制血小板聚集,长期低剂量使用可减少罹患冠心病、脑卒中及血栓的风险。近年来随着临床应用的不断深入,已有研究者发现ASP在CRC中具有一定的防治效果[10]。2017年的结直肠癌临床实践指南建议以ASP作为CRC根治术后的辅助治疗,实现CRC的二级预防[11]。现有研究显示, ASP主要通过2种途径影响CRC的发生发展:(1)环氧合酶(cyclooxygenase, COX)依赖性途径中ASP可下调异常表达的COX-2基因,抑制COXs活性,降低前列腺素E2生成。而前列腺素E2能活化不同类型的细胞膜受体,促进多种肿瘤的形成与发展,提高肿瘤的侵袭性,减少细胞的凋亡[12]。Sheng等[13]认为COX-2在CRC中表达升高,并与CRC的复发与转移密切相关。进一步提示ASP减少CRC复发可能与COX依赖途径相关。(2)非COX依赖途径中ASP能通过抑制核因子κB[14]、 B淋巴细胞瘤-2相关蛋白[15]及Wnt/β-catenin信号通路[16]诱导癌细胞凋亡,延缓CRC进展。由此可见, ASP可以从多种途径影响CRC的发生发展,减少复发,从而延长术后DFS。
本研究ASP组患者因心脑血管疾病服用ASP,虽然队列研究显示心脑血管疾病会减少CRC患者的总生存期[17],但也有学者认为CRC患者的死亡风险与是否合并心脑血管疾病无关[18],因此心脑血管疾病对于CRC术后复发的影响仍存在争议,仍需进一步研究验证。术后2~3年是CRC复发的高峰阶段[19],根据本次研究老年CRC患者从术后第3年起, ASP组与非ASP组的DFS就存在差异,可见ASP在肿瘤复发的高峰阶段能减少CRC复发。研究显示,使用ASP治疗超过2.5年的患者,其CRC的发病率与死亡率均降低;若继续延长ASP治疗时间, CRC的发病率和死亡率可持续降低[20]。有学者认为,老年CRC患者确诊后使用ASP与更长的生存期相关[10]。然而随机对照试验(randomized controlled trial, RCT)显示[21], ASP可能会增加≥70岁CRC患者的相关死亡风险。既往研究显示, ASP抑制COX的作用仅需≤100 mg的剂量[22]。另有研究表明,每日服用75~325 mg ASP 可有效降低CRC的死亡率[20]。本组患者每日服用ASP 100 mg即能改善老年CRC的生存预后。因此,关于ASP在老年CRC中的起效时间和剂量仍需更多的RCT。
高龄CRC患者自身营养条件较差,不能及时有效治疗,使得整体预后较差[23]。Lieu等[24]将年龄作为连续性变量进行评估,结果发现年轻与高龄均为CRC患者总生存期和无进展生存期的危险因素。而本研究仅发现增龄是CRC术后复发和DFS的危险因素,考虑本次研究只选取了≥60岁的老年患者所致。近期研究表明[25], TNM分期是CRC患者行根治性手术后预后的独立影响因素,在本组患者中也发现了类似的结果。本研究还发现,肿瘤最大直径增大是老年CRC患者术后生存的危险因素,这与国内研究者[26]的结论基本相似。因此,老年CRC患者可以根据TNM分期和肿瘤直径情况进行全面评估,从而采取适当的处理方式,改善患者的预后。
综上所述,服用ASP能一定程度减少老年CRC患者术后5年的复发,延长患者的DFS, ASP或能改善老年CRC患者的术后预后。本研究存在以下局限性: (1)单中心研究人群较为单一,样本较少,今后仍需进行多中心、大样本量的研究; (2)部分老年CRC患者可能存在ASP抵抗[27],影响ASP的疗效; (3)研究未将ASP的不良反应纳入考量,老年CRC患者使用ASP的获益与风险仍待评估。

