局限性脉络膜凹陷的临床研究进展
刘雪英,丁珊,陈鸣 综述,张富文, 审校
(1.成都中医药大学眼科学院,成都 610075;2.成都中医大银海眼科医院,成都 610084;3.成都市中西医结合医院,成都 610041)
局限性脉络膜凹陷(focal choroidal excavation,FCE)是表现为光感受器细胞层、视网膜色素上皮层(retinal pigment epithelium,RPE)向脉络膜层凹陷的眼底病变,但不合并巩膜扩张和后巩膜葡萄肿,多位于黄斑区。随着OCT的发展和普及,越来越多的FCE被发现,且临床证实FCE并非长期稳定,可合并脉络膜新生血管(choroidal neovascularization,CNV)、中心性浆液性脉络膜视网膜病变(central serous chorioretinopathy,CSC)、年龄相关性黄斑变性(agerelated macular degeneration,AMD)等疾病。目前,国内对FCE的报道较少,FCE并发症的发病机制并未明确,故本文将结合国内外文献报道,对FCE的研究进展进行综述。
1 FCE的命名
1959年,Klien[1]首次报道在病理组织切片中发现了脉络膜缺损的存在。2006年,Jampol等[2]通过OCT观察到黄斑区特殊的脉络膜视网膜变化,并首次以“脉络膜凹陷”对该病变进行命名。OCT征象表现为视网膜神经上皮层下有与浆液反射一致的透明空间,局部脉络膜组织凹陷。2011年,Margolis等[3]正式提出局限性脉络膜凹陷的病名,提出该病变无明显种族差异,可双眼发病,并根据OCT征象将其分为贴服型(confirming type)和非贴服型(non confirming type)。
2 FCE的发病机制
FCE 的发病机制多有争议,早期因临床报道及研究较少,Margolis等[3]假设其是一种先天性后段畸形。2013年,Kumano等[4]报道FCE患者的吲哚菁绿血管造影显示多灶性强荧光和弱荧光,显示出脉络膜血管扩张、脉络膜血管高通透性的病理特征,推测FCE是由于脉络膜血管异常引起的对黄斑的向外牵拉;同时OCT图像显示病变区Bruch膜基底层与脉络膜上层明显粘连,认为FCE是由于脉络膜胚胎发育异常引起的脉络膜血管病变,而在中心凹的光感受器尖端与RPE之间的分离可能是导致视物变形的原因。但两种观点均不能解释FCE的进行性发展。而FCE与多种视网膜脉络膜疾病相关,2014年,Hashimoto等[5]通过研究一例白点综合征患者,推测外层视网膜和内层脉络膜的炎症病变导致RPE和Bruch膜受损,引起外层视网膜和脉络膜组织相互黏附。同时,纤维性脉络膜病变的收缩和眼压也会使视网膜组织向脉络膜突出。除此之外,部分研究者认为FCE是因为视网膜脉络膜组织局灶性炎症,引起脉络膜组织局灶性瘢痕,瘢痕组织牵拉脉络膜组织形成脉络膜凹陷[6-8]。
3 FCE的OCT分型及其影像学特征
早期根据光感受器尖端与视网膜色素上皮层是否分离将FCE分为贴服型和非贴服型[3],且随着病情变化,非贴服型可转化为贴服型。Matsubara等[9]报道一例白点综合征患者,初期OCT表现为RPE与Bruch膜分离,中央凹视网膜下高反射信号,治疗3个月后视网膜下液吸收,非贴服型FCE转化为贴服型,推测炎症导致RPE与Bruch膜功能紊乱,脉络膜厚度逐渐减少,在眼内压的作用下,受损的RPE与Bruch膜向脉络膜凹陷,随着炎症的改善,RPE功能逐渐恢复,视网膜下液被吸收,使非贴服型的FCE变成贴服型。
Shinojima[10]等通过增强深度成像光学相干断层扫描(enhanced depth imaging optical coherence tomography,EDI-OCT)将FCE在形态上进一步分为锥形、碗状和混合型,且碗状FCE的RPE层多不规则,在荧光血管造影和ICGA上均表现为萎缩。国内一项研究提示紧密型与碗型凹陷临床多见[11]。现根据中央脉络膜厚度可分为3种亚型[12]:1)1型为近视型,中央脉络膜厚度<100 μm;2)2型为疑似先天型,无相关脉络膜视网膜病变,中央脉络膜厚度为100~200 μm;3)继发型或获得型,并发相关脉络膜视网膜疾病,中央脉络膜厚度>200 μm,此分型对临床有着较大的指导意义,因为3型FCE中多与中心性浆液性脉络膜视网膜病变等脉络膜疾病相关,且脉络膜新生血管在3型FCE中更为常见。
眼底检查中,因脱色素的程度不同,FCE可表现为中心凹处或其周围轻微的色素紊乱至黄白色斑块[13],当出现CNV等并发症时,可有视网膜下出血等征象[14]。在FCE检测中,SD-OCT提供了形态学特征,而近红外自发荧光(near-infrared autofluorescence,NIA)可有效检测病变范围,提供较为精确的FCE面积数据。大多数情况下,色素变化与眼底自发荧光(fundus autofluorescence,FAF)图像上的低自发荧光区域相对应,红外成像中则表现为不均匀、低反射信号。而FCE在荧光素血管造影(fundus fluorescein angiography,FFA)和吲哚菁绿造影(indocyanince green angiography,ICGA)检查中的表现各异,无明显特异性。在FFA检查中,FCE及其周围可表现为窗样缺损(图1)及不规则的强荧光或弱荧光。Chen等[14]认为FFA中荧光的变化与CNV引起的RPE功能紊乱、视网膜下出血和视网膜下积液等病理变化有关。在ICGA检查中,FCE表现为弱荧光,透见脉络膜血管,晚期显示斑块状或点状强荧光等染色异常,并发CNV时出现荧光素的渗漏。然而FAF和ICGA荧光的改变与FCE的边缘无明显的关系[13-14]。
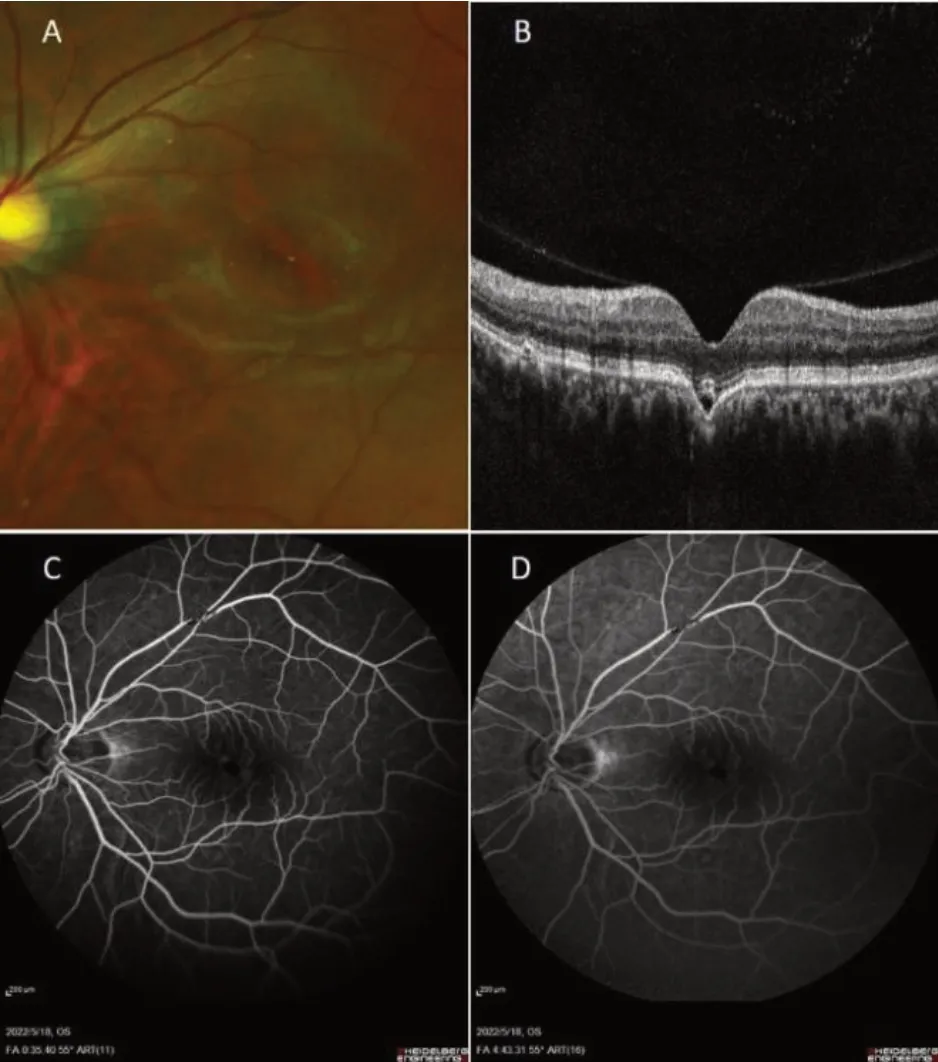
图1 一例左眼FCE患者眼底照相、OCT及FFA检查结果Figure 1 Images of fundus color photo,OCT and FFA in the left eye of a patient with Focal choroidal excavation
4 FCE的常见并发症
目前临床报道的FCE患者年龄以40~60岁多见,Park等[15]统计了在儿童眼科和神经眼科就诊的1 697例患者(年龄<40岁),其中仅有3例为FCE患者,但低发病率是否反映FCE与后天获得性相关有待进一步考证。FCE患者多为单眼发病,但也有报道提示部分患者可双眼患病[13]。FCE患者大多因视物变形、视力下降等症状就诊。同时也有研究者在脉络膜新生血管[6]、脉络膜骨瘤[16]等疾病的治疗随访过程中发现脉络膜凹陷的形成。局灶性脉络膜凹陷是多种脉络膜视网膜疾病的常见征象[17],当FCE并发CNV、CSC、AMD等疾病,对患者视力影响较大,且随着治疗的进展,FCE的形态将发生进一步的改变。根据其并发症的不同,总结如下。
4.1 FCE与脉络膜新生血管
脉络膜新生血管是由于异常生长的脉络膜毛细血管穿过Bruch膜,进入视网膜色素上皮下或神经视网膜下,按病因可分为变性疾病(如AMD)、炎症性疾病、外伤性疾病、特发性CNV等。因其管壁高通透性,易出血或渗出,临床多采用玻璃体腔注射抗VEGF药物治疗[18]。CNV并发FCE患者经抗VEGF治疗后,CNV病变消退,视网膜下液体逐渐吸收,而脉络膜凹陷内的液体最后吸收,且少数患者深部脉络膜凹陷内可见残余积液[19]。
在Zheng等[13]对18例(25眼)非获得性FCE患者的长期随访中,有4眼出现CNV。Sato[7]报道了一例贴服型FCE,在随访过程中继发2型CNV,根据其对侧眼CNV病史及其长期吸烟史,结合患者年龄,推测FCE与局灶性炎症或其他原因导致的Bruch膜的损伤有关,且脉络膜毛细血管的损伤可诱导FCE的CNV发展。除此之外,临床也有FCE并发炎性脉络膜病变继发CNV的报道,例如点状内层脉络膜病变(punctate inner choroidopathy,PIC)[20]。根据Rajabian等[21]对FCE的OCTA研究,FCE患者病变区域脉络膜厚度较正常人薄,且深层毛细血管和脉络膜毛细血管丛改变明显。Zhu等[20]推测凹陷处局灶性脉络膜缺血、RPE改变以及视网膜神经上皮层与RPE层的分离可能是CNV发生的易感因素。而继CNV后出现的FCE与治疗后局部瘢痕收缩有着密切的关系[6,22]。
4.2 FCE与中心性浆液性脉络膜视网膜病变
FCE属于肥厚脉络膜谱系疾病,脉络膜厚度是否增厚仍有争议。Ellabban等[8]认为FCE并发CSC患者的脉络膜厚度大于正常人眼睛。然而,Suzuki等[23]观察到FCE并发CSC患者中心凹下脉络膜厚度(subfoveal choroidal thickness,SFChT)与对眼脉络膜厚度无明显差异。因此,Wang[24]等认为脉络膜厚度可能不是导致FCE发病的关键因素。研究中发现FCE凹陷区脉络膜毛细血管层OCTA表现为暗色血流信号缺失区域,周围环绕高灌注区域。FFA提示[23,25-26]FCE边缘可见渗漏点,晚期呈强荧光点,进一步提示脉络膜循环障碍和RPE层萎缩是其发病的关键因素;而CSC系视网膜外屏障被破坏,脉络膜毛细血管内的液体通过RPE病变处渗漏。FCE与CSC似乎均与脉络膜高通透性有关。在Docherty等[27]的病例报道中,FCE的类型可以在贴服型和非贴服型之间相互转化,推测大多数情况下FCE类型可能取决于视网膜神经上皮下液体的积聚与吸收之间的平衡,非贴服型FCE中的透明空间可能是脉络膜高通透性导致的持续性视网膜下液体。
4.3 FCE与卵黄样黄斑营养不良
FCE并发卵黄样黄斑营养不良(best vitelliform macular dystrophy,BVMD)的临床报道最早见于2014年,并认为卵黄样物质与FCE有着一定的关系[28],后有研究者在对BVMD患者的长期随访中发现卵黄样病变和FCE可长期保持稳定[29]。2018年,Kuma等[30]对19例(38眼)BVMD患者进行研究,用频域光学相干断层成像(spectral-domain optical coherence tomography,SD-OCT)观察纤维化柱与FCE的形态关系,其中6例患者(8眼)并发FCE,研究结果提示除萎缩期外的7眼可见低反射性视网膜下间隙,有4眼的FCE位于圆柱形纤维化柱的正下方。研究者认为卵黄样物质是由于神经感觉层与RPE层分离所致,不一定是FCE引起的,且BVMD的局限性脉络膜凹陷多见于卵黄期,在FCE的形成过程中纤维性支柱发挥着重要的作用,但需进一步验证。
4.4 FCE与白点综合征
Matsubara等[9]报道了一例白点综合征,1名40岁妇女感冒后出现左眼视物模糊,SD-OCT显示RPE和Bruch膜中断分离,中央凹下的外层视网膜可见高反射病变,中心凹旁可见椭圆体带的缺失,脉络膜可见异常的高反射病变。经糖皮质激素治疗后4周后OCT显示中心凹下脉络膜凹陷的形成,脉络膜凹陷中心和边缘的脉络膜厚度分别为183 μm和228 μm。3个月后,视网膜下液体已完全吸收,最终形成FCE,FCE中心和边缘的脉络膜厚度改变为147 μm和200 μm。由此可见轻度炎症可能会引起Bruch膜和RPE层损伤变薄,随着炎症改善,引起压力比例失调,导致Bruch膜和RPE层向后凹陷。
4.5 FCE与脉络膜骨瘤
脉络膜骨瘤是一种由成熟骨逐渐取代脉络膜组织的良性肿瘤,其病程包括肿瘤的成长、钙化与脱钙化,常并发CNV[31]。脉络膜骨瘤并发FCE多以临床病例报道为主要,据Bernabei等[32]的临床病例报道,其眼底征象无明显特异性,多表现为黄橙色隆起性病变。OCT显示脉络膜骨瘤对应的高反射海绵状结构,以及中央凹的局灶脉络膜凹陷,病灶脉络膜的上缘陡坡,沿其顶端挤压视网膜内层。但此例患者缺乏长期随访,据Rajabian等[33]在对一例脉络膜骨瘤患者进行5年的随访过程中发现,后期脉络膜骨瘤病变区域明显扩大,在FCE附近形成广泛的CNV,伴随周围视网膜下出血、积液、视网膜下高反射以及干叉征(pitchfork sign)的形成,而这些都是炎症反应的标准。炎症反应是否为脉络膜骨瘤患者发生FCE的重要驱动因素,有待考证。
5 结语
FCE的发病机制极其复杂,OCT研究是当前研究焦点。根据OCT形态可将其分为不同类型,病变并非长期稳定,凹陷下脉络膜厚度、凹陷宽度可能是FCE患者并发症发生的危险因素,其中FCE并发CSC和CNV较为常见,对视力的影响也较大。对于FCE临床尚无特殊治疗手段,所以,我们希望通过总结相关病例的临床表现,为其治疗和预后提供一定的帮助。
利益冲突所有作者均声明不存在利益冲突
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。详情请访问:https://creativecommons.org/licenses/by-nc-nd/4.0/。

