血清T淋巴细胞亚群水平变化与狼疮性肾炎患者疾病转归的相关性
李飞,常洁,董少卿
(河南科技大学第一附属医院 肾内科,河南 洛阳 471003)
系统性红斑狼 疮(systemic lupus erythematosus,SLE)是一种累及肾脏、神经、肺脏、皮肤等多系统的自身免疫性结缔组织病,狼疮性肾炎(lupus nephritis,LN)属于SLE 常见并发症,其发病率占据SLE 的50%~80%[1]。临床常采用糖皮质激素等免疫抑制剂治疗,但不同患者病情转归不同,因而寻找新型非侵入性标志物对改善病情具有重要意义。CD4+、CD3+、CD16+/CD56+、CD19+属于T 淋巴细胞亚群,其中CD4+、CD3+、CD19+属于特异性免疫应答,CD16+/CD56+属于非特异性免疫应答,可参与自身免疫性疾病发生过程[2]。CD19+属于Ⅰ型跨膜糖蛋白,可刺激B 细胞分化,促进浆细胞分泌抗体,还可分泌细胞因子,进而调控免疫应答[3-4]。目前关于T 淋巴细胞亚群与LN 疾病转归相关性尚未明确,本研究将检测其水平变化对疾病转归的预测价值,为LN 治疗提供新思路。
1 资料与方法
1.1 一般资料
选取2019 年1 月至2022 年3 月河南科技大学第一附属医院收治的82 例LN 患者为研究对象,依据病情严重程度[5]分为轻度21 例、中度32 例、重度29 例。治疗6 个月后根据疾病转归情况分为转归良好组65 例、转归不良组17 例。转归良好组:男25 例,女40 例;年龄24~42 岁,平均(32.16±2.72)岁;体重指数22~26 kg/m2,平均(24.01±0.52)kg/m2;病程1~3 年,平均(1.52±0.14)年。转归不良组:男10 例,女7 例;年龄23~43 岁,平均(33.52±2.85)岁;体重指数21~27 kg/m2,平均(23.85±0.41)kg/m2;病程1~2 年,平均(1.46±0.11)年。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经院伦理委员会批准。
1.2 纳入与排除标准
纳入标准:符合LN 诊断标准[6]且病理类型均为Ⅲ型及以上狼疮;无血液疾病者;无过敏性疾病者;首次确诊者;签署知情同意书。排除标准:自身免疫性溶血性贫血者;合并其他肾病者;凝血功能异常者;精神障碍者;合并恶性肿瘤者;近3 个月内发生严重感染或发热者;近期接受抑制机体免疫反应药物治疗者。
1.3 方法
1.3.1 治疗方法 所有患者接受糖皮质激素治疗,口服醋酸泼尼松片(辅仁药业集团有限公司,国药准字H20073323,规格:5 mg),1 mg/(kg·d);口服免疫抑制剂霉酚酸酯(上海罗氏制药有限公司,国药准字H20031240,规格:0.25 g),1 g/次,2 次/d,连续治疗6 个月。治疗结束后评价疾病转归情况,转归良好定义为:临床症状基本消失,尿蛋白含量降低50%,血清蛋白水平≥30 g/L,血肌酐恢复至正常水平,否则视为转归不良[7]。
1.3.2 检测血清T 淋巴细胞亚群水平 分别于治疗前、治疗1 个月、3 个月后采集空腹外周静脉血5 mL,放入含有肝素抗凝采血管内,分别加入CD4+、CD3+、CD16+/CD56+、CD19+标记的荧光抗体(美国Abnova 公司),使用FACSAriaⅡ流式细胞仪(美国贝克曼库尔特公司)检测CD4+、CD3+、CD16+/CD56+、CD19+。
1.4 观察指标
①比较入组时两组不同生化指标:包括血清白蛋白、血肌酐、尿素氮、24 h 尿蛋白、补体C3、补体C4、白细胞、红细胞沉降率(ESR)、尿沉渣红细胞数。②比较治疗前、治疗1 个月、3 个月后两组及不同病情严重程度(入组时)患者血清T淋巴细胞亚群水平。③分析各指标与生化指标、病情严重程度相关性。④分析治疗1 个月、3 个月后各指标对疾病转归的预测价值。
1.5 统计学方法
采用SPSS 24.0 软件处理数据。计数资料以百分率(%)表示,采用χ2检验;计量资料以均数±标准差()表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(两两间比较采用LSD-t检验);应用Pearson 分析T淋巴细胞亚群与生化指标的相关性;应用Spearman 分析T 淋巴细胞亚群与病情严重程度相关性;采用受试者工作特征(ROC)曲线分析T淋巴细胞亚群水平对疾病转归的预测价值,不同方案间的曲线下面积(AUC)比较采用DeLong 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组生化指标比较
转归不良组血清白蛋白、补体C3、补体C4水平低于转归良好组,血肌酐、尿素氮、24 h 尿蛋白水平,尿沉渣红细胞数高于转归良好组,差异有统计学意义(P<0.05)。见表1。
表1 两组生化指标比较()
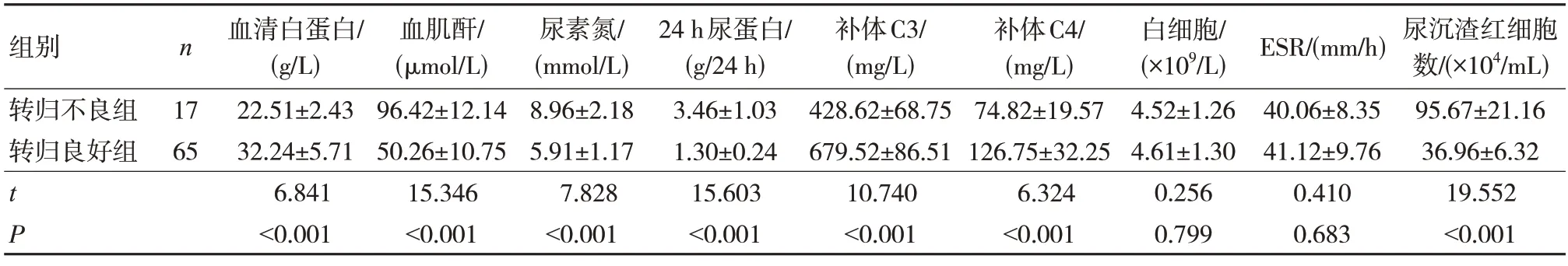
表1 两组生化指标比较()
2.2 两组治疗前后血清T 淋巴细胞亚群水平比较
治疗1 个月、3 个月后两组CD4+、CD3+、CD16+/CD56+高于治疗前,CD19+低于治疗前,差异有统计学意义(P<0.05);治疗1 个月、3 个月后转归良好组CD4+、CD3+、CD16+/CD56+高于转归不良组,CD19+低于转归不良组,差异有统计学意义(P<0.05)。见表2。
表2 两组治疗前后血清T 淋巴细胞亚群水平比较()
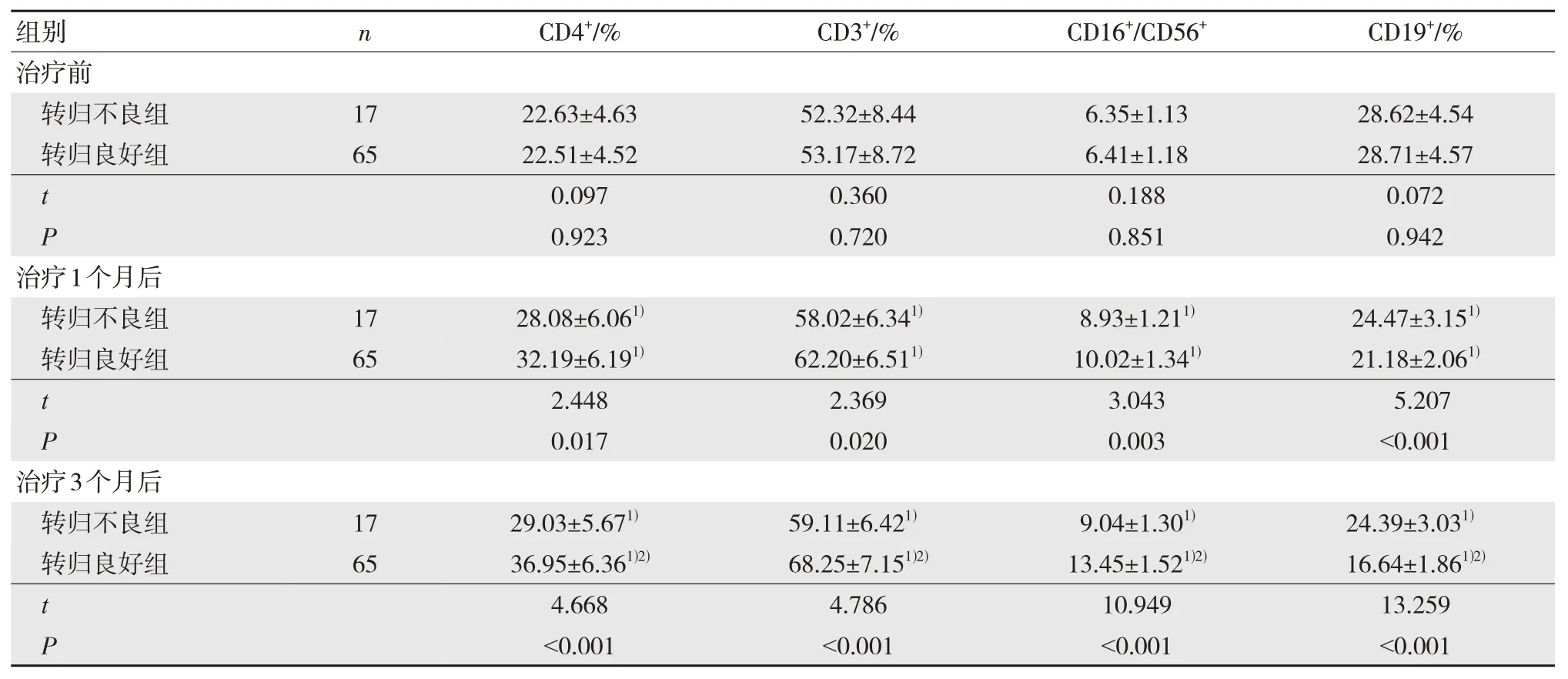
表2 两组治疗前后血清T 淋巴细胞亚群水平比较()
注:1)与治疗前比较,P<0.05;2)与治疗1 个月后比较,P<0.05。
2.3 不同病情严重程度患者各指标水平
随着病情严重程度增加,CD4+、CD3+、CD16+/CD56+降低,CD19+升高,差异有统计学意义(P<0.05)。见表3。
表3 不同病情严重程度患者各指标水平()
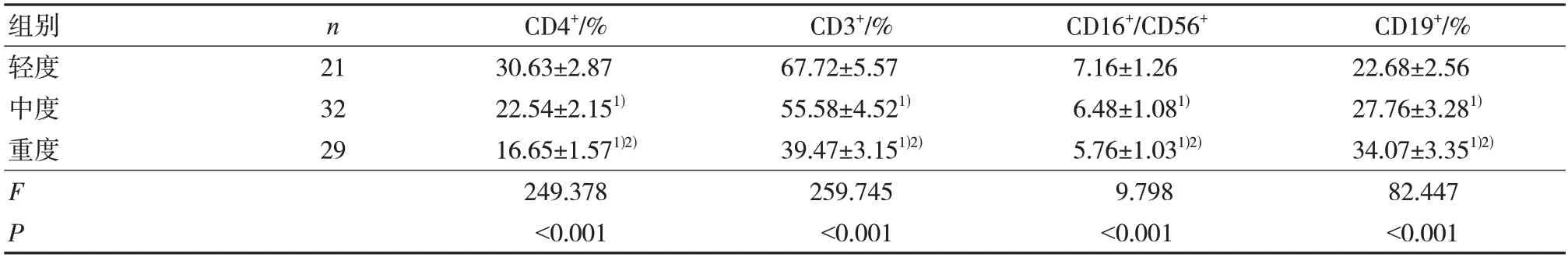
表3 不同病情严重程度患者各指标水平()
注:1)与轻度比较,P<0.05;2)与中度比较,P<0.05。
2.4 各指标与生化指标、病情严重程度相关性分析
CD4+、CD3+、CD16+/CD56+与白蛋白、补体C3、补体C4 呈正相关,而与尿素氮、病情严重程度呈负相关(P<0.05);CD19+与白蛋白、补体C3、补体C4 呈负相关,而与尿素氮、病情严重程度呈正相关(P<0.05)。见表4。
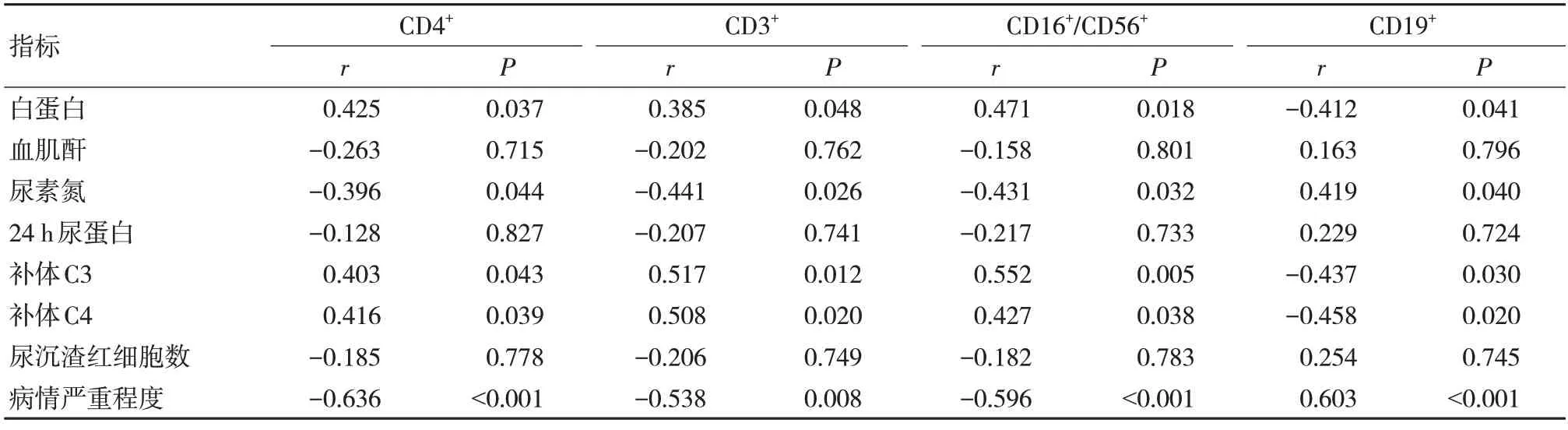
表4 各指标与生化指标、病情严重程度相关性分析
2.5 ROC 分析各指标对疾病转归的预测价值
以转归不良组17 为阳性样本,以转归良好组65 例为阴性样本,绘制ROC 曲线,结果显示,治疗1 个月、3 个月后各指标联合预测疾病转归的AUC 大于单项预测(P<0.05),且治疗3 个月后各指标联合预测疾病转归的AUC 大于治疗1 个月(P<0.05)。见表5。
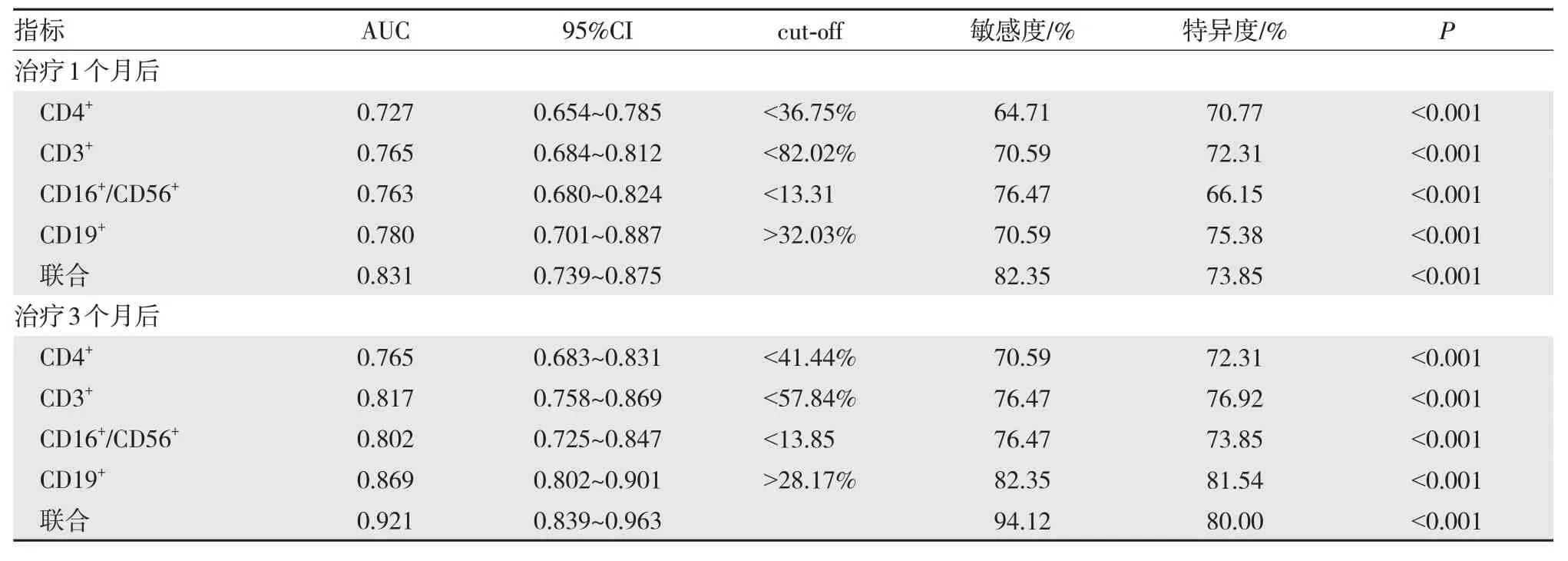
表5 ROC 分析各指标对疾病转归的预测价值
3 讨论
LN 发病机制与免疫复合物形成、炎性反应、遗传、免疫应答等有关,免疫细胞因子异常分泌可引起机体免疫功能紊乱,进而引发自身免疫系统疾病,其病情进展与疾病转归密切相关,因而寻找LN 发生发展相关分子标志物对疾病转归具有重要指导意义[8-9]。
CD3+与T 细胞受体结合,可传递T 细胞受体、抗原结合的信号,促进机体免疫抑制形成,可积极参与机体应对刺激、感染等过程;CD4+T 淋巴细胞可进一步分化为辅助性T 细胞1(Th1)、辅助性T 细胞2(Th2)、辅助性T 细胞17(Th17)、调节性T 细胞(Treg)亚群,不同亚群细胞因子可互相转化,维持机体免疫平衡[10-11]。抗原刺激下T 淋巴细胞激活,可生成大量淋巴因子,并可维持机体免疫内环境稳定,若T 淋巴细胞亚群平衡异常可介导免疫性疾病发生过程[12-13]。本研究结果显示,治疗后两组CD4+、CD3+、CD16+/CD56+高于治疗前,CD19+低于治疗前,治疗后转归良好组CD4+、CD3+、CD16+/CD56+高于转归不良组,CD19+低于转归不良组,且CD4+、CD3+、CD16+/CD56+随着病情严重程度增加而降低,CD19+随着病情严重程度增加而升高,提示T 淋巴细胞亚群失衡可能促进LN 病情进展,并可增加LN 疾病转归不良发生风险。其原因可能为CD4+、CD3+、CD16+/CD56+水平降低主要为诱导细胞数目减少,促使机体中参与免疫抑制作用的细胞减少,破坏机体免疫平衡,降低其免疫抑制作用,进而激活自身反应性T 细胞;CD19+增加后可减弱T 抑制细胞功能,促使机体产生相应抗体,进而造成体液、细胞免疫异常,最终促进LN 转归不良。
补体是一种具有酶活性的球蛋白,补体C3、补体C4 水平降低表明补体活化功能异常,其水平变化与LN 疾病活动度呈负相关,研究表明免疫复合物可激活补体,促使SLE 肾脏受累[14]。尿蛋白、尿沉渣红细胞数可反映肾脏病变程度[15]。本研究结果显示,转归不良组血清白蛋白、补体C3、补体C4 水平低于转归良好组,血肌酐、尿素氮、24 h 尿蛋白水平、尿沉渣红细胞数高于转归良好组,进一步研究发现CD4+、CD3+、CD16+/CD56+与白蛋白、补体C3、补体C4 呈正相关,与尿素氮、病情严重程度呈负相关,而CD19+与之相反,表明T 淋巴细胞亚群可能通过调节机体免疫反应、炎性反应,进而促进LN 转归不良。本研究中治疗后各指标联合预测疾病转归的AUC 大于单项预测,提示T 淋巴细胞亚群对LN 疾病转归具有一定预测价值。考虑其原因为T 淋巴细胞亚群可诱导Th1、Th2 等其他因子产生,引起LN 患者机体免疫调节功能异常,促进LN 病情进展,进一步影响疾病转归。
综上所述,CD4+、CD3+、CD16+/CD56+、CD19+联合预测可提高对LN 患者疾病转归的预测价值,可为判断LN 病情进展及治疗方案制定提供科学依据。

