基于Olink靶向蛋白质组学技术的高原习服和平原人血清差异表达蛋白研究*
潘镜余,谷天艳,陈 玲,马筱洁,史清海△
1.石河子大学医学院,新疆石河子 832000;2.新疆医科大学研究生院,新疆乌鲁木齐 830000;3.新疆军区总医院临床检验诊断中心,新疆乌鲁木齐 830000;4.新疆维吾尔自治区人民医院输血科,新疆乌鲁木齐 830000
高原地区以低压低氧、高寒及强紫外线为主要特征,其中对人类生命活动影响最为显著的主要是低氧因素[1]。人体暴露于高原低氧环境后,机体会从整体水平调动其内在机制发生一系列的代偿适应性变化以应对高原低氧环境,使机体内环境由不平衡到平衡,最终达到内、外环境的统一,这一过程称为高原习服[2]。机体对高原环境的习服是一个时间依赖的渐进过程,多数人可通过习服获得对高原环境良好的适应。高原习服的机制是高原缺氧阶段机体神经-体液调节系统及生理、生化代谢的适应性改变[3],以往的研究集中在组织和细胞层面低氧诱导因子激活的造血系统、脂类代谢、炎症反应等适应性代谢改变,而循环系统外周血中组织或细胞代谢过程中的各类终产物或中间产物的表达变化蕴含着丰富的代谢变化信息,其中痕量、微小蛋白分子由于易被血液中高丰度蛋白的掩盖或遮蔽一直以来都是相关研究的难点和瓶颈。近年来,蛋白质组学技术主要应用于识别新的生物标志物和(或)潜在的治疗靶点,以液相色谱-串联质谱(LC-MS/MS)[4]、蛋白芯片[5]、Olink蛋白质组学技术[6]为代表的高覆盖度的蛋白质定性与定量的分析技术为疾病诊断、药物研发和致病机制研究提供了多种选择。
Olink蛋白质组学技术是基于邻位延伸技术(PEA)的高通量靶向检测血液(或各种体液)中特定种类蛋白质的技术,其最大的优势在于灵敏度达到飞克(fg)级别,更易检测出低丰度表达蛋白,已广泛应用于多种疾病的基础和临床研究。为深入了解高原习服人群外周血中与细胞代谢过程特异性相关的小分子蛋白差异表达情况,探索高原习服机体组织和细胞代谢性相关缺氧适应性功能机制,本研究拟应用Olink靶向蛋白质组学技术,筛选高原习服人群与平原人群血清中细胞代谢相关的血清差异表达蛋白,分析其在细胞缺氧代谢调控作用中的功能,为探索高原适应性机制和促进高原习服提供参考依据和药物新靶点。
1 资料与方法
1.1一般资料 纳入2020年12月至2021年7月移居西藏阿里地区6~12个月的40例汉族青壮年男性作为高原习服组,均居住于平均海拔4 500 m的地区,身体适应高原,体检无异常(在陆军某部医院完成体检);另选取与高原习服组年龄等相匹配的40例新疆军区总医院体检中心的平原汉族男性作为平原对照组,均长期居住于海拔<1 000 m的地区,体检结果为健康。
1.2纳入及排除标准 依据新疆军区总医院医学伦理委员会的要求,获得研究对象知情同意。高原习服组研究对象的纳入标准:(1)由海拔1 000 m以下移居至平均海拔4 500 m地区的汉族青壮年男性,居住时间为6~12个月,已适应高原生活且无身体不适者;(2)此前均未到过高原地区,且无心、肺等基础疾病史;(3)除外真性红细胞增多症和其他继发性红细胞增多;(4)近期无外伤及手术病史,无发热、炎症及其他可能影响检测结果的情况(如身体状态欠佳,有饮酒、用药等情况)。平原对照组研究对象纳入标准:(1)常驻海拔<1 000 m,近6个月无长期海拔2 000 m以上旅居史的汉族青壮年男性;(2)无慢性疾病史,经过体检,肝、肾功能指标,以及心电图、胸片、腹部超声等检查指标均无异常;(3)近期无外伤及手术病史,无发热、炎症及其他可能影响检测结果的情况。
1.3仪器与试剂 分别采用上臂式电子血压计(大连欧姆龙HEM-7127J)和指夹式脉搏血氧仪(江苏鱼跃YX307),在静息状态下测量并记录研究对象血压、心率和指脉氧饱和度。由杭州联川生物技术有限公司提供血清Olink蛋白质组学检测服务,Olink 92种靶标代谢Panel试剂盒可检测靶标见表1。
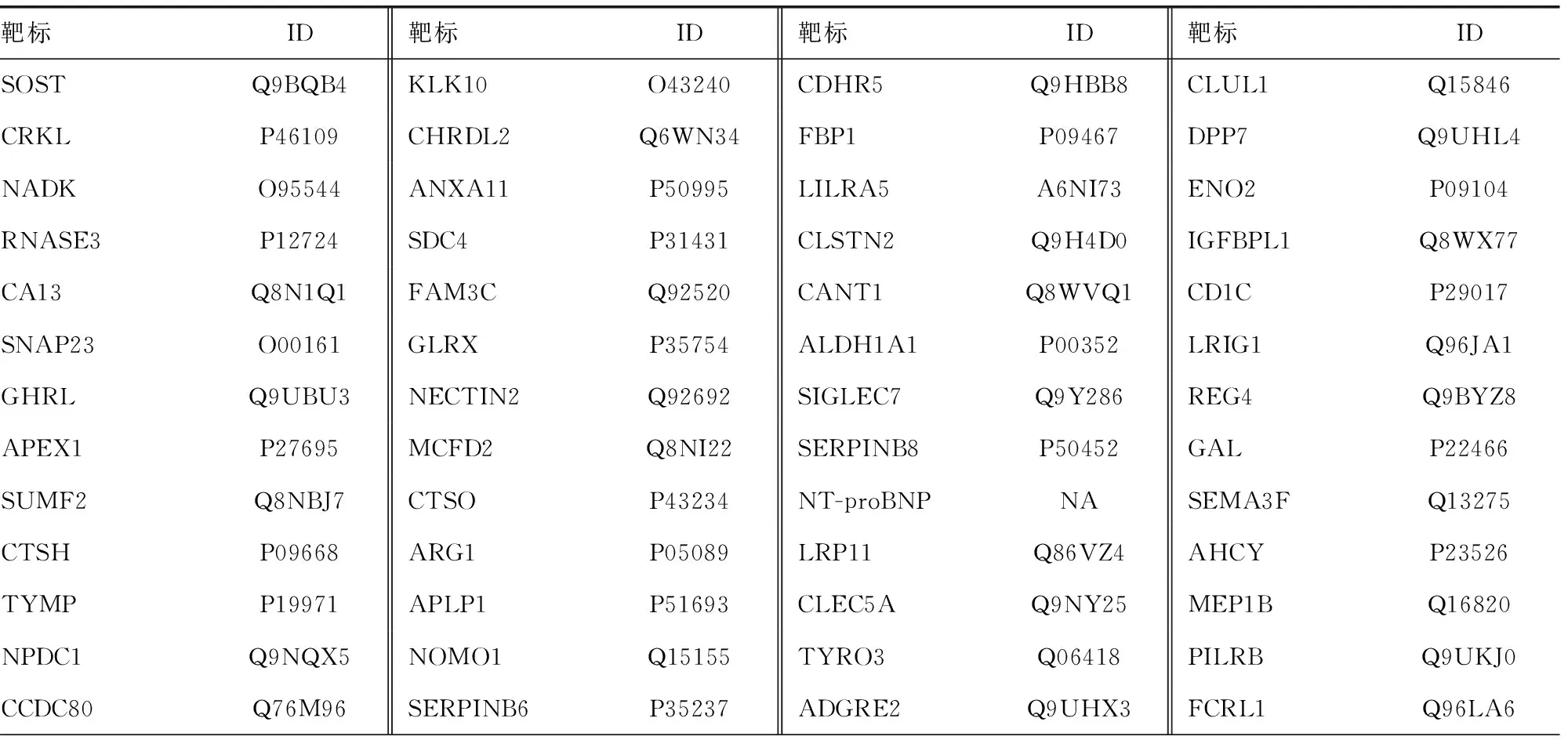
表1 Olink 92种靶标代谢Panel试剂盒靶标
1.4方法
1.4.1血液样本的采集 所有研究对象禁食12 h,于次日清晨黄帽分离胶采血管采肘静脉血5 mL,4 ℃、3 000 r/min离心10 min,取上层血清,于-80 ℃冰箱冻存用于蛋白质组学检测。
1.4.2血清差异表达蛋白检测 采用Olink靶向蛋白质组学技术——邻近延伸分析技术(瑞典Olink Proteomics公司)进行检测。基本原理是使用一对互补可杂交DNA寡核苷酸标记的抗体同时与一个靶标蛋白结合,待测的靶标蛋白使这对抗体接近,通过杂交反应使抗体上配对的DNA寡核苷酸形成双链DNA标签,采用微流控定量PCR(qPCR)对双链DNA标签进行相对定量检测和分析,扩增子数量与待测靶标蛋白的初始浓度呈正比。基本操作步骤包括加样、杂交孵育、延伸与扩增、芯片预处理及上机操作、数据分析。使用3个用于计算检测限(LOD)的阴性对照和3个含有92组抗体的板间对照(IPC)对所得循环阈值(Ct)进行质量控制和标准化,测定数值以标准化蛋白质表达值(NPX)的log2对数转换值表示,计算公式:靶标dCt=靶标Ct-阴性对照Ct-板间对照Ct;靶标ddCt=校正因子(试剂批次变量)-靶标dCt。使用Olink靶向蛋白质组学技术对高原习服组和平原对照组研究对象血清中代谢相关靶标蛋白表达水平进行检测,将获得的NPX进行聚类分析。
1.4.3生物信息学分析 对筛选的差异表达蛋白应用基因本体论(GO)数据库(http://www.geneontology.org/)按照其生物学功能及机体内参与的生理学反应过程进行GO分类和富集分析,绘制GO分析柱状图和气泡图。对差异表达蛋白应用京都基因和基因组百科全书(KEGG)数据库(http://www.kegg.jp/)中的信号通路提供代谢途径查询并进行富集,绘制KEGG分析柱状图和气泡图。

2 结 果
2.1基本资料和生理指标比较 本研究纳入的两组研究对象为非自身对照关系。为了排除性别和民族影响,故两组纳入者均为汉族青年男性人群。经统计分析,两组间年龄、身高、体重、收缩压差异无统计学意义(P>0.05));与平原对照组相比,高原习服组舒张压、心率较高,血氧饱和度较低,差异有统计学意义(P<0.05)。见表2。
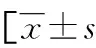
表2 两组基本资料及生理指标比较或M(P25,P75)]
2.2血清中代谢相关差异表达蛋白的分析结果 使用Olink靶向蛋白质组学技术对高原习服组和平原对照组研究对象血清中代谢相关92个靶标蛋白表达水平进行检测,将获得的NPX进行聚类分析,结果见图1。计算两组NPX均数的差值,筛选得到差异表达蛋白34个,其中上调16个,按照P值从小到大排序分别是:SUMF2、CTSH、TYMP、KLK10、SDC4、FAM3C、GLRX、MCFD2、CTSO、NOMO1、CDHR5、FBP1、LILRA5、CANT1、ALDH1A1、SIGLEC7(P<0.05);下调18个,分别是:SOST、CRKL、NADK、RNASE3、CA13、SNAP23、GHRL、APEX1、NPDC1、CCDC80、CHRDL2、ANXA11、NECTIN2、ARG1、APLP1、SERPINB6、CLSTN2、SERPINB8(P<0.05)。分别对上调和下调P值最小的排名前5位(TOP 5)显著差异表达蛋白进行分析,结果见图2。

注:X轴的每个坐标代表一个样本,Y轴的每个坐标代表一个靶标蛋白,右侧颜色条从蓝色到红色的渐变代表表达水平的高低,蓝色越深代表表达水平越低,红色越深代表表达水平越高。图1 高原习服组和平原对照组血清中代谢相关92个靶标蛋白表达水平热图

注:A~E为TOP 5上调表达蛋白,F~J为TOP 5下调表达蛋白;P值中E-06为×10-6,依次类推;NPX为标准化蛋白表达值。图2 高原习服组和平原对照组92个靶标蛋白中P值最小的前5位差异表达蛋白
2.3血清中代谢相关差异表达蛋白GO富集分析 Olink蛋白质组代谢panel共检测92种靶标蛋白,对两组比较显著上调的16种蛋白和下调的18种蛋白进行GO分类分析,结果表明:差异蛋白在细胞组分分类中主要富集在细胞外泌体;在生物学过程分类中主要富集在中性粒细胞脱颗粒、通过细胞质膜黏附分子黏附、免疫调节等生物学过程;在分子功能分类中主要富集在蛋白质结合、钙离子结合、金属离子结合等,见图3。
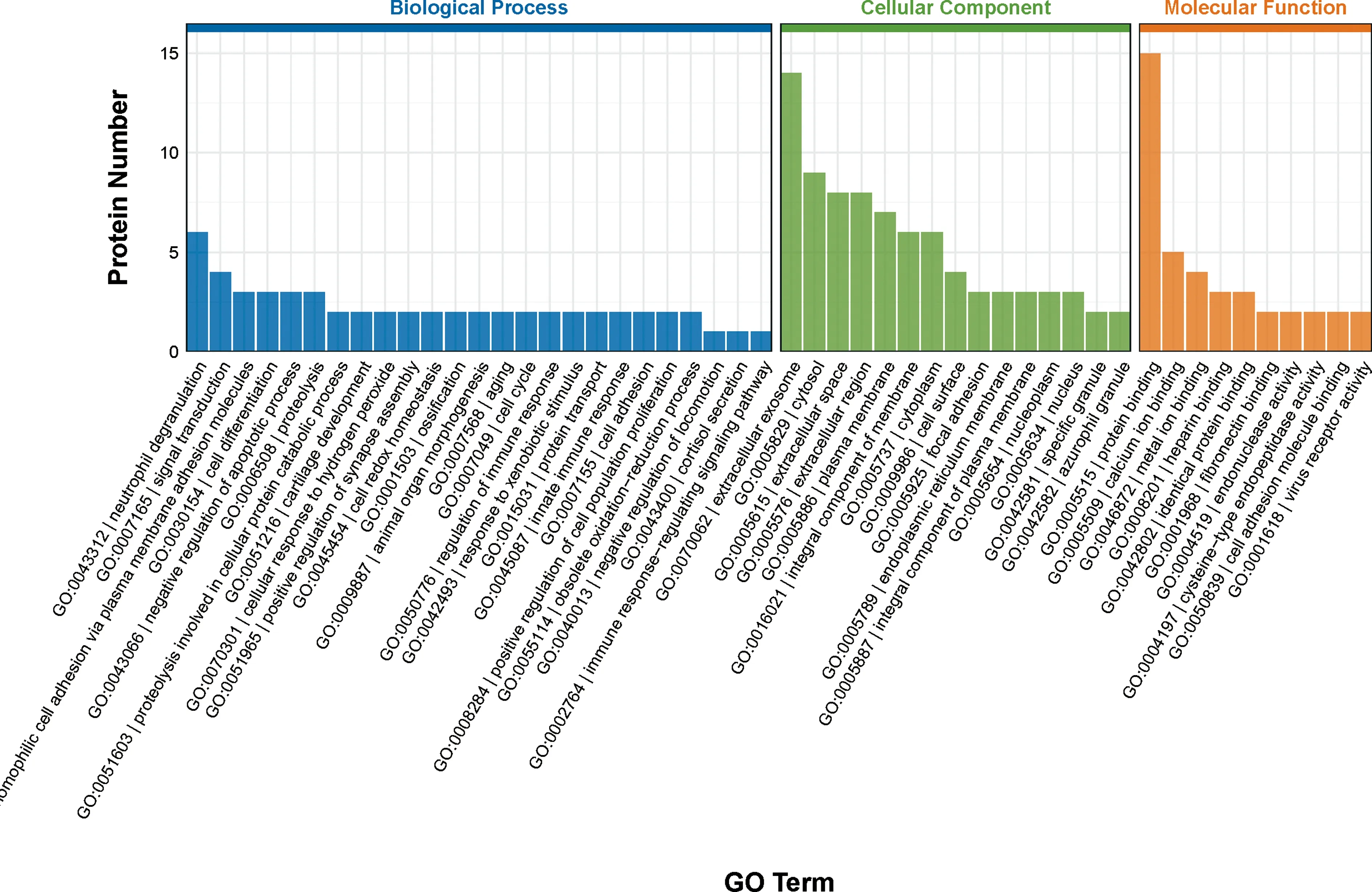
注:横坐标为差异表达蛋白在GO条目(GO Term)中的存在方式或意义,纵坐标为总蛋白数(Protein Number);Biological Process,生物过程;Cellular Component,细胞组分;Molecular Function,分子功能。图3 高原习服组和平原对照组血清中差异表达蛋白的GO富集分析
2.4血清中代谢相关差异表达蛋白KEGG富集分析 进一步对参与各类生物过程的差异表达蛋白在细胞过程、环境信息处理、遗传信息处理、人类疾病、新陈代谢、生物系统6个部分进行富集分析,发现差异表达蛋白分别在阿米巴病、嘧啶代谢、溶酶体、凋亡、胰岛素代谢、细胞黏附分子等通路富集,见图4。此外,还有一些差异表达蛋白是氮素代谢、精氨酸生物合成、烟酸盐和烟酰胺代谢、磷酸戊糖途径等通路中的关键蛋白。

注:纵坐标Rich Factor表示位于该KEGG的差异蛋白个数/位于该KEGG的总蛋白数(Protein Number),Rich Factor值越大,KEGG富集程度越高;点的大小代表蛋白数目,点的颜色代表富集分析的P值,即富集的显著性;该KEGG富集分析气泡图是根据富集的P值取前20位的信号通路进行绘图展示。图4 高原习服组和平原对照组血清中差异表达蛋白的KEGG富集分析
3 讨 论
高原缺氧会对机体造成一定损伤,但机体也可以通过一段时间的代偿性适应来维持体内内环境的平衡达到高原习服,如果不能有效适应和习服,则可能导致严重的肺水肿或脑水肿[7]。本研究纳入的移居海拔4 500 m、居住6~12个月的高原习服研究对象血氧饱和度降低、心率增快均符合移居高原人群基本生理特征。
机体组织细胞有氧呼吸以氧为电子传递链中的电子受体,产生ATP为细胞代谢提供能量。细胞缺氧将引发多种生理和病理生理改变,无论是急性高原反应、急慢性高原病还是高原习服,它们的中心调节蛋白都是缺氧诱导因子(HIF)蛋白家族[8],而HIF-1被认为是低氧代谢适应的主要驱动因素,在体内维持氧稳态,氧供受限时能调控数百个基因的表达,包括血管新生因子(VEGF)、促红细胞生成素(EPO)、一氧化氮合酶(NOS)等一系列与无氧呼吸和葡萄糖转运相关的酶等[9]。缺氧暴露后,代谢适应对正常组织功能至关重要,细胞氧浓度的维持能使其从有氧氧化到无氧糖酵解代谢过程间完成快速和可逆的代谢转换[10-11],而组织或细胞在缺氧适应性代谢过程中的多种产物将释放到外周血循环系统中,有些产物是通过循环系统转运到相应靶器官发挥调控作用,有些则可能是代谢中间产物或废物等依靠循环系统完成清除,这些产物分子的表达和水平变化蕴含着丰富的代谢变化信息。
LU等[12]使用iTRAQ蛋白质组学技术分析高原习服者血浆后发现,与三羧酸循环、核糖体、代谢途径、甘油酯代谢、抗坏血酸和盐酸盐代谢、丙酸代谢、蛋白酶体等相关的蛋白表达量减少;ZHANG等[13]利用iTRAQ 4-plex蛋白质组学技术研究了慢性高原病与非慢性高原病者之间的差异表达蛋白,富集分析表明主要在过氧化物酶体、氮代谢、碳代谢、代谢途径、嘌呤代谢和磷酸戊糖途径中积累;YANG等[14]利用Olink蛋白质组学技术在急进高原习服良好和习服不良者中筛选血清差异表达蛋白谱,发现其参与碳水化合物的代谢、葡萄糖/能量代谢的蛋白表达升高。由于血浆中白蛋白、免疫球蛋白等高丰度表达蛋白的遮蔽作用,其中一些痕量且微小的蛋白分子因丰度低难以被检测。本研究应用Olink蛋白质组学技术对高原习服人群和平原人群外周血血清中代谢相关的92个靶标蛋白表达水平进行检测,筛选得到差异表达蛋白谱共34个蛋白质,其中表达上调的蛋白16个,表达下调的蛋白18个。本研究通过KEGG富集分析发现,34个差异表达蛋白在阿米巴病、嘧啶代谢、溶酶体、凋亡、胰岛素代谢、细胞黏附分子等通路显著富集,还有一些差异表达蛋白是氮素代谢、精氨酸生物合成、烟酸盐和烟酰胺代谢、磷酸戊糖途径等通路中的关键蛋白。上述结果与前述研究报道的结果不完全一致[12-14],存在结果差异可能是与不同研究人群的高原习服状态、移居高原时长不同等因素有关。
本研究筛选获得的差异表达蛋白谱中,部分蛋白是与细胞缺氧代谢过程相关的蛋白。硬骨素(SOST)主要是由骨细胞分泌的一种蛋白[15],通过抑制成骨细胞中经典的Wnt信号转导负向调控骨形成[16]。缺氧时,HIF-1α能直接结合到SOST的启动子序列上,下调SOST的表达,增强了Wnt/β-catenin信号通路[17-18]。GENETOS等[19]研究也证实,1% O2细胞缺氧下调SOST转录和蛋白表达,上调Wnt信号通路和β-catenin激活。CRK样蛋白(CRKL)是适配蛋白家族的一员,具有黏附、增殖、迁移、存活等多种生物学功能[20]。ZHANG等[21]研究通过对缺氧/复氧(H/R)大鼠H9C2心肌细胞敲除CRKL基因后发现,其通过Bax和下调p-ERK1/2来抑制心肌细胞凋亡,提示CRKL调控缓解低氧诱导的心肌细胞损伤。血管舒张剂激活磷蛋白(VASP)是一种肌动蛋白,连接细胞骨架系统与信号转导通路,在细胞黏附、细胞骨架动力学等方面发挥关键作用[22]。LIU等[23]研究发现,在缺氧时HIF-1α能直接结合到VASP启动子的缺氧反应元件上,VASP还与CRKL的SH3N结构域直接相互作用进而介导其功能,并且VASP还能增强β-catenin的转录活性,都与低氧条件下调控骨形成有关。NAD激酶(NADK)能催化磷酸基团,使ATP转移到NAD上生成NADP,其在细胞代谢和抗氧化等多种生物功能中发挥着重要作用[24]。高原环境不仅低压低氧,还存在强紫外线强等氧化应激因素。GROSE等[25]研究发现,在紫外线照射条件下吡啶核苷酸还原水平下降,可激活NADK活性,还原型NADP(NADPH)则能缓解细胞氧化应激损伤。硫酸酯酶修饰因子2(SUMF2)是甲酰基甘氨酸生成酶家族的成员,可与白细胞介素13(IL-13)发生相互作用[26-27]。据此推测,SUMF2可能是高原良好习服后气道反应性降低的调控分子。胸苷磷酸化酶(TYMP)是一种血管生成因子,可促进组织血管生成并刺激多种内皮细胞的体外生长,且能抵抗缺氧诱导的凋亡。IKEDA等[28]研究证实,TYMP酶活性对其血管生成是不可或缺的,提示TYMP在细胞缺氧代谢过程中发挥积极作用。
综上所述,本研究通过Olink高敏靶向蛋白质组学技术,筛选出了高原习服人群与平原人群之间细胞代谢相关的血清差异表达蛋白谱,丰富补充了以往质谱或芯片技术较难捕获的较低丰度的血清差异表达蛋白谱,进一步分析了与细胞缺氧代谢相关的差异表达蛋白的生物学功能机制,但仍有较多蛋白鲜见与细胞缺氧代谢相关的文献报道。本研究尚存在一定的局限性,两组人群为非自身对照,饮食、工作强度等有差异,可能存在结果偏倚;其次,研究对象相对较少,缺乏多种方法的差异表达验证。因此,后续将完善实验设计、扩大样本量验证这些差异表达蛋白,研究这些蛋白在细胞缺氧代谢适应性功能机制中的作用,为探索高原适应性机制和促进高原习服提供理论依据和药物新靶点。

