N-氨乙基哌嗪与甘氨酸钠CO2吸收剂配方研究
汪丽,张欢,叶舣,赵兴雷
(1. 北京化工大学化学工程学院,北京市 朝阳区 100029;2. 北京低碳清洁能源研究院,北京市 昌平区 102211)
0 引言
随着社会经济的快速发展,人们对化石燃料的需求不断增加,导致温室气体急剧增加,CO2占温室气体总排放量的73%[1-2]。由于我国贫油、富煤、少气的资源禀赋,煤炭成为我国能源结构中的主要资源,并且也将是我国未来几十年中的主要能源来源[3-6]。燃煤电厂CO2排放量占我国CO2总排放量的40%左右[7],是我国最大的CO2排放源。环境和气候变化的压力是当前燃煤发电技术所面临的严峻挑战,如何有效地控制和减少燃煤电厂CO2排放量已成为世界各国关注的焦点。《“十二五”国家碳捕集、利用与封存科技发展专项规划》指出,碳捕集、利用与封存(carbon capture,utilization and storage,CCUS)技术是一项具有大规模CO2减排潜力的新兴技术,有望实现化石能源的低碳利用,被广泛认为是应对全球气候变化、控制温室气体排放的重要技术之一。CCUS技术是燃煤电厂未来大规模减排CO2的重要技术选择之一[8],整体上,CCUS技术在燃煤电厂应用的步骤是:从火力发电厂的烟道气中分离捕集CO2,将其压缩成液体或超临界状态,通过罐车、管道和船舶运输到适当地点,加以利用或储存,最终实现CO2的大幅度减排[9-14]。其中CO2捕集是CCUS的第一步,CO2捕集技术主要包括溶剂吸收法、物理吸附法、低温分离法和膜分离法[15-17]等,其中化学吸收法应用较为广泛。
化学吸收法是吸收富集CO2的最主要方法,其中,有机胺是工业上应用最广泛的化学吸收剂。常用的有机胺有单乙醇胺(MEA)、二乙醇胺(DEA)、N-甲基二乙醇胺(MDEA)、2-氨基-2-甲基丙醇(AMP)等[18-19]。MEA早在20世纪30年代就实现了工业化[20],其价格低廉,是有机胺吸收法中最常用的吸收剂。研究[21]发现,MEA 吸收CO2具有明显的缺陷,MEA 水溶液担载量较低,且CO2再生能耗高,再生后吸收效果减弱,更易降解,这3 个因素阻碍了MEA 的广泛应用。DEA 与MEA 类似[22],具有再生能耗高、腐蚀性强等缺陷。AMP 是空间位阻胺[23],吸收和再生性能较优,但与CO2反应速率慢,成本较高。工业上,溶剂吸收法的工艺流程已相对成熟并固定,为了解决有机胺溶剂吸收法的三大缺陷,其核心的技术在于吸收剂的配方。
有研究[24-25]表明,结构中含有多个氨基的有机胺具有较高的吸收容量。Choi 等[26]发现,N-氨乙基哌嗪(AEP)分子中含有一个伯氨基、一个仲氨基和一个叔氨基,化学热稳定性良好。CO2负载量和吸收速率均高于MEA,因此,它比MEA 吸收CO2的能力更强,且循环稳定性较好,其工业化潜力大,有望代替工业上常用的MEA。氨基酸盐(AMA)是一种新型CO2吸收剂,它的吸收速率与MEA溶液相当[27],与常用的有机胺相比,氨基酸盐在水溶液中可完全电离,溶于水后挥发性小,且溶液表面张力较大,同时具有抗氧化降解能力[28]。甘氨酸钠(SG)作为一种常见的氨基酸盐,价格较低,吸收CO2速率快,缺点是吸收量较低,再生性能差[29]。
本文结合AEP 和SG 在吸收速率、吸收量和再生能力等方面各自的优势,对AEP+SG 混合溶液吸收CO2的性能和再生效果进行了研究,初步考察AEP与SG的复合溶液对CO2的吸收效果,并研究其吸收和解吸性能。研究表明,加入助剂可提高其循环量,加快反应时间,结果可为开发新型吸收溶剂提供基础。
1 实验分析
1.1 实验试剂和装置
本文所用试剂为AEP、SG、二氧化碳、柠檬酸、草酸、癸二酸、硼酸、辛二酸。CO2吸收实验装置图如图1 所示,解吸实验装置图如图2所示。

图1 CO2吸收实验装置示意图Fig. 1 Schematic diagram of CO2 absorption experimental device
图2 CO2解吸实验装置示意图Fig. 2 Schematic diagram of CO2 desorption experimental device
1.2 实验原理
有机胺溶液吸收CO2反应原理为:胺在水溶液中离解,使得溶液呈碱性,易于和CO2这类酸性气体发生反应,从而达到脱除和回收CO2的目的[30],本质上是弱碱和弱酸反应生成水溶性盐的可逆过程。AEP 分子中具有伯胺、仲胺及叔胺的分子结构,SG分子中有伯胺结构。伯胺、仲胺与CO2的反应都可用两性离子的反应机理[31-32]来解释。
吸收反应是伯胺和仲胺易与CO2生成两性离子中间产物:
两性离子中间产物与溶液中胺分子、H2O 或OH-继续反应,进一步去质子化,以形成另一个稳定的离子:
而叔胺分子上无质子氢,无法形成两性离子,不能与CO2直接反应,仅起到催化CO2水解的作用,具体反应机理[33]如下:
所有这些反应都是可逆的,并且在再生过程中,通过向系统中添加热量可以激活逆反应,温度升高,反应逆向进行,CO2从富液中解吸出来。
1.3 一次吸收-解吸循环实验流程
吸收剂吸收实验条件如下:将配置好的150 mL 吸收剂放入烧杯中,放入40 ℃恒温磁力搅拌器中,待溶液内温度升至40 ℃时,通入CO2气体,控制进气流速为0.5 L/min,吸收剂转速为400 r/min。实验过程中每10 min取1 mL溶液滴定CO2体积,计算吸收CO2的浓度,当CO2浓度稳定时,实验结束。
解吸实验采用加热再生的方法,将装有CO2的溶液放入3口烧瓶中,将其放入95 ℃的恒温油浴锅中,利用电磁搅拌器进行搅拌,以保证溶液受热均匀,进行解吸实验。
1.4 多次吸收-解吸循环性能探究
采用一次吸收-解吸循环实验后的吸收剂,继续进行多次吸收-解吸循环实验,实验操作步骤与上述相同。在吸收剂捕集CO2实际应用中,烟道气中除CO2气体外,还有少量的SO2及O2等杂质气体,故在循环实验中吸收剂通入CO2气体时加入少量SO2及O2,以探究杂质气体对吸收剂的循环稳定性的影响。
1.5 再生能耗计算
高性能吸收剂应同时具有高吸收量、低再生能耗等优点。再生能耗是影响吸收剂实际应用中重要的指标之一,实验中吸收剂的再生能耗计算公式为
式中:Qrea为解吸反应热,表示吸收过程中CO2与吸收剂反应生成新化合物所释放的热量,解吸过程中CO2与吸收剂需要相同的能量破坏化学键,将CO2从溶液中释放;Qhea为升温潜热,表示CO2吸收剂富液加热至解吸温度时所吸收热量;Qeav为水汽化潜热,表示CO2解吸过程中由溶液蒸发所带走的热量,默认此部分中能耗由水蒸气蒸发所带走。
Qrea计算公式为
式中:GCO2为CO2产生量,mol;ΔHrea为单位CO2再生所需反应热,kJ/mol。
Qhea计算公式为
式中:M为吸收剂的摩尔质量,g/mol;Cp为吸收剂溶液的比热容,J/(kg⋅K);T2为解吸温度,K;T1为解吸前温度,K;ω为溶液中吸收剂的质量分数,%;为富液中CO2负载量,mol;为贫液中CO2负载量,mol。
Qeav计算公式为
式中:ΔmH2O为解吸实验中水损失质量,g;为水的汽化潜热,kJ/kg。
2 结果与讨论
2.1 吸收性能
配置溶液总胺度为40%,以AEP 为主要吸收剂,SG 为辅助吸收剂,质量分数为30%的MEA作为参考标准,探究不同比例AEP+SG 复配体系组成的混合溶液及纯组分AEP 对CO2吸收性能的影响。
图3为AEP+SG 复配溶液初次吸收量随时间变化曲线。可以看出,6种吸收剂对CO2吸收量大小关系为35%AEP+5%SG>30%AEP+10%SG>25%AEP+15%SG>20%AEP+20%SG>40%AEP>30%MEA。其中作为参考标准的30%MEA 的CO2吸收量为1.72 mol/L,AEP+SG 体系中配比为35%AEP+5%SG 的吸收剂吸收量最高,为3.75 mol/L,与30%MEA相比,CO2吸收量提高了118.02%,原因是AEP分子结构中包含一个伯胺基、一个仲胺基和一个叔胺基,由两性离子反应机理可知,—NH2基团的存在有利于溶液吸收CO2,AEP 分子中胺基数多于MEA 分子,故使得它与MEA 溶液相比更有利于吸收CO2,CO2的负载量更高。

图3 AEP+SG复配溶液吸收量随时间变化关系Fig. 3 Relationship between absorption capacity of AEP+SG complex solution and time
由图3 也可看出,在AEP+SG 复配体系吸收CO2时,随着混合溶液中AEP的浓度增大,CO2的负载量也随之增大,说明在吸收过程中,AEP 作主吸收剂占主导地位,SG辅助吸收CO2。纯组分40% AEP的CO2负载量低于AEP+SG的复配体系,这是由于AEP中拥有多个胺基基团,有助于吸收CO2。同时,随着AEP 的浓度增大,溶液的黏度也增加,导致包括CO2在内的离子扩散率降低,限制了AEP 与CO2的结合,因此纯组分40%AEP负载量较低。对于AEP+SG 的复配体系来说,加入SG不仅能提高混合溶液CO2负载量,而且可以降低复合溶液黏度、加快传质速率、缩短吸收反应时间,加入SG对混合溶液吸收CO2起到了相当的促进作用。
图4为复配体系吸收速率随时间变化曲线。从图4 可知,35%AEP+5%SG 吸收速率明显高于其他吸收剂,30%MEA 吸收速率最慢。分析其原因,一方面,复配溶液中AEP 作为主体吸收剂浓度升高,有利于吸收CO2,其分子中含有对位氨基六元环结构,这种特殊结构可以形成共振结构,相互影响电子分布,使含有该结构的胺类有机物具有更快的CO2吸收速率[34-35];另一方面,SG 是一种氨基酸盐,其分子中的—NH2基团吸收CO2会生成稳态的氨基甲酸盐,SG 分子中的—COO-在水中水解生成弱酸—COOH 和OH-,有助于CO2的吸收。在吸收的开始阶段,复配溶液碱性较强,SG 的水解被抑制,随着吸收反应的进行,溶液的碱性逐渐减弱,SG 的水解作用加强,促进其对CO2的吸收,提高了整体的反应速率。
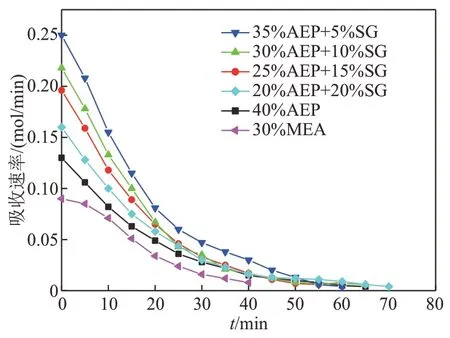
图4 AEP+SG复配溶液初次吸收速率随时间变化关系Fig. 4 Relationship between absorption rate of AEP+SG complex solution and time
综上,在AEP 与SG 体系中,以AEP 吸收为主,SG 吸收为辅,在相同实验条件下,35%AEP+5%SG 复配溶液吸收效果最佳,CO2吸附量最大。
2.2 解吸性能
一种性能优异的吸收剂,不仅要具有优良的吸收性能,同时也要具有良好的解吸性能。因此,通过考察不同吸收剂的解吸性能,可以全面了解该吸收剂在工业上的应用价值,AEP+SG 体系吸收CO2是基于化学吸收法,吸收过程的化学反应是可逆反应,可通过升温来进行CO2的解吸过程,本实验中解吸温度为95 ℃。
图5展示了总胺度为40%的AEP+SG 复配溶液及40%AEP、30%MEA 对应的解吸过程。在前5 min左右,溶液属于加热升温状态,随着溶液温度的快速升高,大量的CO2从溶液中解吸出来,溶液中CO2负载量逐渐降低。不同配比的饱和溶液所吸收的CO2不同,CO2的解吸量也就不同,解吸结束后CO2残留量大小关系为:30%MEA<40%AEP<30%AEP+10%SG<25%AEP+15%SG<5%SG+35%AEP<20%AEP+20%SG。

图5 AEP+SG复配溶液解吸量随时间变化关系Fig. 5 Relationship between desorption capacity of AEP+SG complex solution and time
如图6 所示,在解吸实验的开始阶段,不同吸收剂的CO2解吸速率均迅速上升至某一值后迅速下降。这是由于在解吸初期,随着温度的不断上升,饱和溶液吸收CO2生成的氨基甲酸酯和碳酸根离子激活了逆反应,大量的CO2从溶液中解吸出来,解吸速率增大。随着解吸实验的进行,溶液中CO2的浓度逐渐减小,CO2的解吸速率达到一峰值后也迅速下降。纯组分AEP 溶液及AEP+SG 的复配溶液的CO2解吸速率高于MEA 溶液,这说明AEP分子中含有的对位氨基六元环结构不仅可以提升其对CO2的吸收速率,还可以在加热的情况下促进其对CO2的解吸速率。
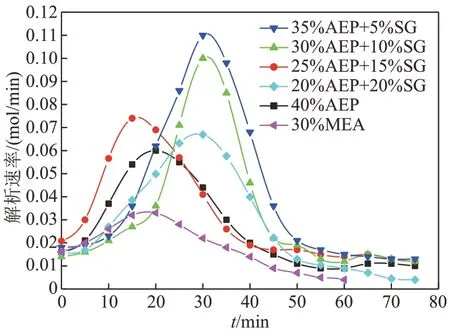
图6 AEP+SG复配溶液解吸速率随时间变化关系Fig. 6 Relationship between desorption rate of AEP+SG complex solution and time
图7为AEP+SG 复配溶液吸收/解吸对比图。由图7 可以看出,在AEP+SG 的体系中,配比为5% AEP+5% SG的溶液吸收量与解吸量均为最高,解吸率为76.53%,与30%MEA 相比提高了11.42%,其吸收-解吸循环量较其他配比较佳。但同时考虑到35%AEP+5%SG 复配溶液解吸量较低,需要进一步提高其再生量,优化其吸收-解吸循环性能。
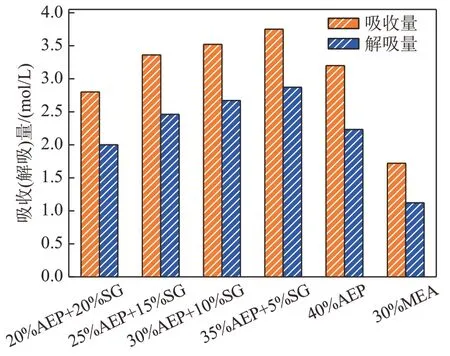
图7 AEP+SG复配溶液吸收/解吸对比图Fig. 7 Absorption/desorption comparison diagram of AEP+SG complex solution
2.3 35%AEP+1%SG加入助剂后吸收-解吸性能
Eimer 等人[36]提出一种提高吸收-解吸CO2速率的新方法,即通过改变吸收剂pH值的方式来优化吸收-解吸CO2过程,提高吸收-解吸循环量。基于此,本文通过改变溶液的pH 值来提高35%AEP+5%SG复配溶液的解吸量,实验方法为:在CO2富液解吸过程中加入少量pH值调节剂,其主要目的是打破原有的化学平衡体系,提高解吸速率。其实验原理为:吸收剂在吸收CO2反应过程中,生成较为稳定的碳酸氢根离子或氨基甲酸根离子,解吸过程则在较高温度条件下使这2 种离子发生逆向反应,从而使CO2从溶液中析出。当溶液的pH 值下降时,溶液中H+浓度增加,不利于吸收反应中碳酸氢根离子和氨基甲酸根离子的形成,故影响其吸收量;但在解吸反应中,加入的H+会中和溶液中一部分OH-离子,促使反应向有利于解吸CO2的方向进行。因此,一方面,添加的助剂可降低溶液的pH值提高溶液的解吸速率和解吸量;另一方面,助剂不能对溶液的吸收量产生较大影响。一些常规强酸虽然能电离出H+,调节溶液pH值,但是其对设备的腐蚀较为严重,基于安全性和经济性考虑都不宜采用,故尝试从弱酸中选择。本文选出辛二酸、草酸、癸二酸、柠檬酸、硼酸5 种弱酸进行探究,以35%AEP+5% SG 溶液吸收-解吸量为基准进行对比,分析加入5种弱酸后对吸收量/解吸量、解吸速率、解吸率及循环量的影响。
图8是35%AEP+5%SG 复配溶液加入不同助剂后解吸量随时间变化关系,加入助剂的质量分数均为1%。由图8 可知,35%AEP+5%SG+1%不同助剂复配溶液初始吸收量较未加助剂吸收量有所降低,但因酸加入量较少,对吸收过程影响较小。加入助剂对35%AEP+5%SG 再生时间影响较大,再生时间时长关系为:柠檬酸<硼酸<癸二酸<无助剂<草酸<辛二酸。无助剂添加的35%AEP+5%SG 复配溶液解吸需要90 min,35%AEP+5%SG+1%柠檬酸混合溶液解吸用时75 min。加入硼酸和癸二酸也可加快复配溶液的解吸进程,用时分别为82 min 和85 min。而加入草酸及辛二酸对复配溶液的解吸起到相反作用,反而延长解吸时间。
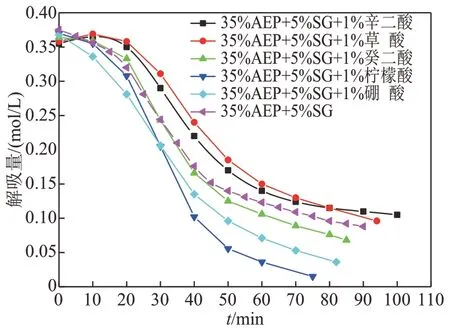
图8 35%AEP+5%SG复配溶液加入不同助剂解吸量随时间变化关系Fig. 8 Relationship between desorption capacity of 35%AEP+5%SG complex solution with different additives and time
图9展示了35%AEP+5%SG+1%不同助剂复配溶液中解吸速率随时间的变化关系。由图9 可知,在15~45 min 间,配比为35% AEP+5% SG+1% 柠檬酸的混合溶液解吸速率一直高于其他5组混合溶液,其混合溶液最大解吸速率比35%AEP+5% SG的最大解吸速率高1.5倍。由此可见,加入1%柠檬酸有助于提高35%AEP+5%SG 复配溶液的解吸速率。
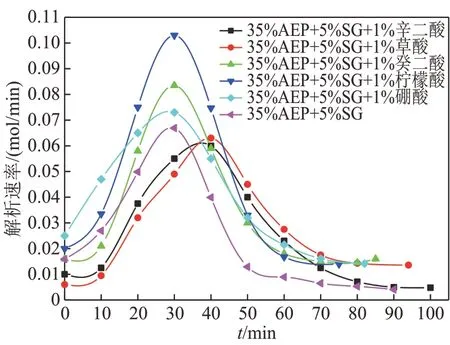
图9 35%AEP+5%SG复配溶液加入不同助剂解吸速率随时间变化关系Fig. 9 Relationship between desorption rate of 35%AEP+5%SG complex solution with different additives and time
图10是35%AEP+5%SG复配溶液加入不同助剂吸收-解吸量对比图。在相同的实验条件下,35%AEP+5%SG 复配溶液吸收量为3.75 mol/L,35%AEP+5%SG+1%柠檬酸复配溶液吸收量为3.70 mol/L,其吸收性能下降仅1.33%。而在解吸过程中,未加入柠檬酸的富液解吸量为2.87 mol/L,解吸率为76.53%,加入柠檬酸的混合溶液解吸量达到了3.55 mol/L,解吸率为96.58%,其解吸量提升了23.69%,解吸率提高了20.05%。故加入柠檬酸对于35%AEP+5%SG 复配溶液解吸有非常好的促进作用,其吸收-解吸循环性能大大提高。另外,向35%AEP+5%SG 复配溶液中加入1%硼酸溶液也可提高混合溶液吸收-解吸循环性能,解吸量仅次于柠檬酸,其解吸量较未加入助剂的复配溶液提升了15.68%,解吸率提高了17.91%。加入癸二酸也有助于CO2的解吸作用,但其促进效果很有限,其解吸量仅提高了3.14%,解吸率增加了9.34%。而加入辛二酸及草酸的35%AEP+5%SG 复配溶液吸收-解吸量降低,不利于CO2的解吸过程。
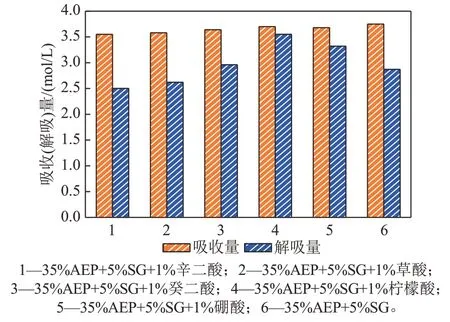
图10 35%AEP+5%SG复配溶液加入不同助剂吸收/解吸量对比图Fig. 10 Contrast diagram of absorption and desorption capacity of 35%AEP+5%SG complex solution with different additives
综上所述,向5%AEP+5%SG 吸收剂中加入1%柠檬酸,可有效增加CO2解吸量、加快解吸反应过程,同时也大幅度提升了CO2吸收-解吸循环性能,具有潜在的应用价值。
2.4 35%AEP+5%SG+1%柠檬酸循环再生性能
将5种酸加入35% AEP+5% SG溶液中,发现在吸收-解吸过程中,1%柠檬酸的加入可以有效促进CO2解吸速率、提高解吸率,选取35% AEP+5% SG+1%柠檬酸进行循环吸收-解吸实验,考察其在循环吸收、解吸过程中的吸收量、解吸量、循环稳定性。
图11为35% AEP+5% SG+1%柠檬酸复配溶液循环吸收/解吸对比图。由图11 可知,35%AEP+ 5%SG+1%柠檬酸复配溶液经过10 次循环后,吸收量缓慢下降,第1 次循环吸收量为3.7 mol/L,到第10次循环吸收量下降为3.60 mol/L,循环吸收量下降幅度仅为2.70%,循环吸收稳定性达97.30%,循环吸收性能较优。这10次循环解吸过程中,35% AEP+5%SG+1%柠檬酸复配溶液解吸量下降趋势较小,从第1 次循环解吸到第10次其循环解吸量下降了2.82%,循环解吸稳定性达97.18%。经过10 次循环吸收/解吸后,其第10次溶液解吸量依旧高于未加入1%柠檬酸溶液的解吸量,循环结束后溶液解吸性能依旧高于35%AEP+5%SG溶液,解吸性能提高了16.82%,这说明加入1%柠檬酸能有效地提高5% AEP+5%SG复配溶液循环解吸性能。
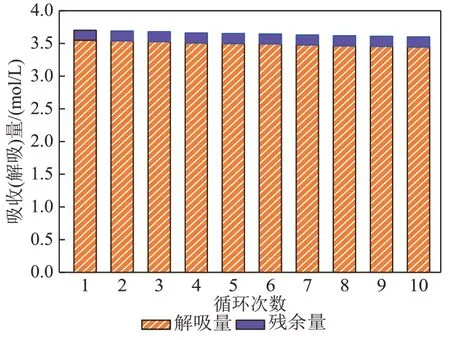
图11 35% AEP+5% SG+1%柠檬酸复配溶液循环吸收/解吸量对比图Fig. 11 Contrast diagram of cyclic absorption and desorption capacity of 35%AEP+5%SG+1% citric acid complex solution
综上,在10次吸收-解吸循环实验中,1%柠檬酸的加入对35% AEP+5%SG复配溶液吸收量产生的影响较小,但其大大提高了复配溶液的解吸量,加快了循环解吸反应过程,增大了溶液循环量。
在吸收剂捕集CO2过程中,一些其他酸性气体及氧气均会对吸收剂性能产生不利影响,因此需考虑在有杂质气体存在情况下,吸收剂的吸收/解吸循环稳定性。
图12为35% AEP+5%SG+1%柠檬酸复配吸收剂在不同气体环境下,10 次吸收/解吸循环对比。通入气体中只包含CO2,经过10 次循环,CO2吸收量由3.7 mol/L下降至3.6 mol/L,吸收量下降了2.82%,而CO2解吸率由96.05%增加至97.22%,这说明加入少量的柠檬酸虽对CO2吸收量带来较小的不利影响,但对解吸过程仍具有明显的促进作用,使得解吸量保持在较为平稳的状态。在CO2气体中增加少量的SO2及O2杂质气体,在10次循环过程中,CO2吸收剂的循环性能呈下降趋势,CO2吸收量由3.41 mol/L 下降至3.14 mol/L,降低了7.92%,CO2解吸率由98.24% 下降至94.27%,解吸率仍保持较高状态,这说明杂质气体的通入虽然对CO2吸收过程产生不利影响,但对解吸过程影响较小。这主要是由于SO2及O2的通入,使少量吸收剂氧化降解,从而导致CO2吸收量下降,同时杂质气体与溶液中主体吸收剂反应生成了难以分解的氨基甲酸盐,解吸率也随之下降。
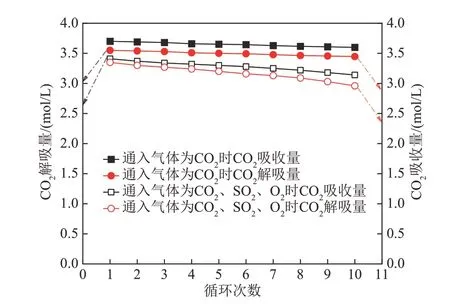
图12 35% AEP+5% SG+1%柠檬酸复配溶液不同气体环境下循环吸收/解吸对比图Fig. 12 Comparison diagram of cyclic absorption/desorption of 35%AEP+5%SG+1% citric acid complex solution in different gas environments
由此可见,在不同气体环境下,配比为35%AEP+5%SG+1%柠檬酸复配溶液均保持了较高的循环稳定性能,循环负载量大,CO2解吸速率高,具有良好的工业应用前景。
2.5 再生能耗
CO2再生能耗是评价吸收剂是否具有实际应用价值的重要指标之一,其主要由解吸过程反应热、升温显热、水汽化潜热所构成。由于吸收过程中醇胺与CO2反应热较高,伯胺、仲胺及叔胺吸收1 mol CO2反应热均超过50 kJ,传统CO2吸收剂MEA吸收1 mol CO2反应热达到了85.43 kJ。吸收过程中CO2与吸收剂反应化学键结合释放的化学能较高,而激活吸收逆反应释放CO2需要吸收相同热量打破该化学键。由于再生过程中还需要加热富液到再生温度,析出CO2过程中水汽化会带走体系中一部分热量,从而导致吸收剂再生过程高能耗。由于CO2解吸能耗成本占捕集过程成本的70%~80%,因此需选择CO2高负载量、高解吸量、低再生能耗的吸收剂来取代传统MEA 吸收剂。
再生能耗计算数据如表1 所示,可以看出,再生过程中加热富液到解吸温度过程能耗最高,其中30%MEA 解吸过程升温显热占总能耗的40.84%,35%AEP+5%SG+1%柠檬酸升温显热占总能耗的47.32%。同时,35%AEP+5%SG+1%柠檬酸单位再生能耗为136.75 kJ/mol,相比于30%MEA 单位能耗206.87 kJ/mol, 降低了33.90%,这也说明该复配吸收剂具有广阔的应用前景。
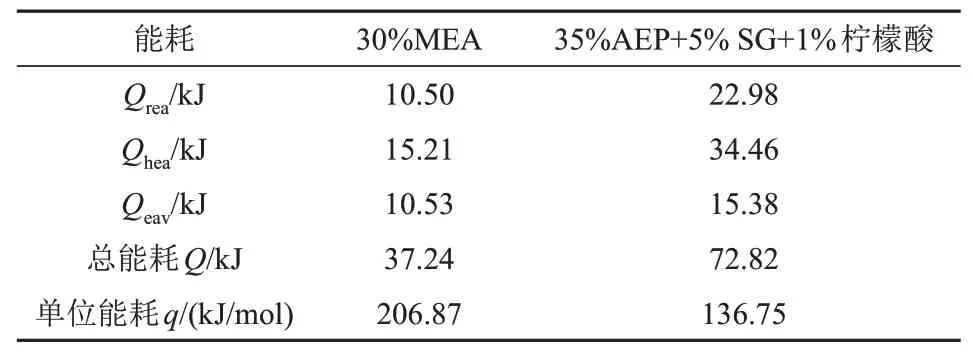
表1 再生能耗数据Fig. 1 Calculation data of regeneration energy consumption
3 结论
以30%MEA 溶液作为参考标准,总胺度为40% 的情况下,研究了35%AEP+5%SG、30%AEP+10%SG、 25%AEP+15%SG、 20%AEP+20%SG、40%AEP复配溶液对CO2的吸收和解吸性能,结论如下:
1)AEP+SG体系在吸收过程中,AEP作主吸收剂占主导地位,SG辅助吸收CO2,其中配比为35%AEP+5%SG 的吸收效果和解吸效果较其他配比较佳。但同时考虑到35%AEP+5%SG 复配溶液解吸量较低,通过向其复配溶液中加入pH调节剂提高再生量,优化吸收-解吸循环性能。
2)以35%AEP+5%SG 溶液吸收-解吸量为基准进行对比,加入1%柠檬酸可降低35%AEP+5%SG复配溶液的吸收量,下降幅度为1.33%,但能有效促进CO2解吸量,其解吸量增加了23.65%,同时缩短了解吸反应时间,加快了解吸反应过程。
3)35%AEP+5%SG+1%柠檬酸吸收纯CO2或CO2中掺杂少量的O2及SO2杂质气体条件下,其吸收-解吸循环稳定性均能达到90%以上,同时再生能耗为136.75 kJ/mol,与30%MEA 相比降低了33.90%。
综上,35%AEP+5%SG+1% 柠檬酸吸收剂CO2负载量大、解吸率高、循环稳定性较优、再生能耗低,是有望代替传统MEA吸收剂的一种新型高效CO2吸收剂,具有广阔的工业应用前景。

