补肾助孕方对超促排卵小鼠着床窗口子宫内膜免疫因素的影响
郝延芝,焦元清,刘章铭,马惠荣,4,杜惠兰,4,马玉聪,4,宋翠淼,4
(河北中医药大学 1. 中西医结合学院中西医妇产科学教研室; 2. 第一附属医院宣传部; 3. 基础医学院生理学教研室; 4. 河北省中西医结合生殖疾病协同创新中心,石家庄 050200)
超促排卵是体外受精-胚胎移植 (in vitrofertilization-embryo transfer,IVF-ET) 的重要组成部分。尽管可获取更多的卵母细胞,但超促排卵可能对子宫内膜容受性产生负面影响,是制约IVF-ET成功的关键[1]。免疫反应是子宫容受性的重要中介,免疫细胞[主要是子宫自然杀伤 (uterine natural killer,uNK)细胞]对于子宫内膜容受性、胚胎发育和植入至关重要[2]。胎盘蛋白14 (placenta protein 14,PP14) 被认为是子宫内膜容受性的重要标志物,参与母胎界面复杂的免疫调节过程[3]。如何改善超促排卵对子宫内膜容受性的负面影响、提高IVF-ET植入成功率是目前的研究热点。中医认为,肾藏精,主生殖,肾在胞宫蓄经、育胎中具有重要的调节作用。本课题组前期研究[4-5]发现,补肾法可提高不孕症患者IVFET临床妊娠率,改善超促排卵小鼠胚胎着床。为了更好地治疗不孕症,提高IVF-ET植入成功率,明确补肾法在超促排卵中对子宫内膜的作用至关重要。本研究以补肾助孕方为补肾法的代表方,通过建立超促排卵小鼠模型,从着床窗口 (window of implantation,WOI) 子宫内膜组织形态、uNK细胞、PP14及血清雌二醇 (estradiol,E2)、孕酮 (progesterone,P) 和外周血CD4+T、CD8+T细胞方面,探讨补肾助孕方改善胚胎着床的免疫机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:雌性昆明小鼠80只 (清洁级),8周龄,体质量 (25±5) g;成年雄性昆明小鼠45只 (清洁级),体质量 (30±5) g。由河北省实验动物中心提供,生产许可证号:SCXK (冀) 2013-1-003。本研究已通过河北中医药大学伦理委员会审核 (DWLL2016031)。
1.1.2 药物:补肾助孕方[5](熟地黄20 g,当归10 g,山药15 g,山萸肉12 g,淫羊藿10 g,枸杞子12 g,黄芪15 g,紫石英先煎15 g,菟丝子12 g,白芍9 g,丹参10 g,香附6 g等) 购自石家庄乐仁堂药房,常规水煎、离心。小鼠灌胃药物剂量参照《药理学实验》中人与动物间按体表面积折算的等效用量,配置成1.5 g生药/mL药液,灭菌后于4 ℃储存备用。醋酸阿拉瑞林(GnRH-a,25 μg/支,批号444954) 购自上海吉尔生化有限公司,人绝经期促性腺激素 (human menopausal gonadotropin,HMG,75 IU,批号150802) 及人绒毛膜促性腺激素 (human chorionic gonadotropin,hCG,2 000 IU,批号150810) 购自丽珠集团丽珠制药厂。
1.1.3 试剂和仪器:E2(天津市协和医药科技集团有限公司,批号S10950204);P (天津市协和医药科技集团有限公司,批号S10950202);VECTASTAIN ABC KIT (美国VECTOR LABORATORIES公司,批号PK-4001);DAB (德国Sigma-Aldrich公司,批号D5905);苏木素染液 (北京中杉金桥生物技术有限公司,批号ZLI-9610);anti-PP14 (英国EterLif公司,批号EL915048)、anti-mouse CD4 FITC、anti-mouse CD8a PE、anti-mouse CD49 (integrin alpha2) (美国eBioscience公司,批号4292227、01036-1636、4277527);RM2135石蜡切片机 (德国莱卡公司);Gallios流式细胞仪 (美国贝克曼公司)。
1.2 方法
1.2.1 分组与给药:80只雌性小鼠适应性饲养,于每天上午9:00阴道脱落细胞涂片,连续10 d,选取60只周期规律的小鼠按随机数字表分为正常组、模型组 (GnRH-a+hMG+hCG) 和补肾组 (GnRH-a+hMG+hCG+补肾助孕方),每组20只。模型组、补肾组小鼠在动情后期腹腔注射GnRH-a 40 μg/100 g,1次/d,连续9 d。用药5 d后阴道脱落细胞涂片出现周期紊乱,提示垂体抑制,第9天注射HMG 40 IU/100 g,48 h后注射hCG 100 IU/100 g,制备超促排卵模型[5-6]。补肾组小鼠注射GnRH-a/HMG同时给予补肾助孕方药液1.5 mL/100 g (2.4 g生药/100 g) 灌胃,正常组、模型组小鼠以等体积蒸馏水灌胃,1次/d,连续11 d至注射hCG日[5]。于注射hCG日16:00,正常组 (动情期)、模型组和补肾组小鼠按照雌雄2∶1比例分别合笼饲养,次日晨雌鼠见阴栓即为孕第1天。预实验给予4.8 g生药/100 g灌胃,小鼠瘦弱,子宫苍白细小,无胚胎着床。
1.2.2 标本获取及检测方法:孕第4天 (小鼠胚胎着床窗口)[7]取小鼠子宫观察,每组选取10只小鼠断头取血,用于E2、P、CD4+T、CD8+T细胞测定,无菌摘取子宫,用4%多聚甲醛固定左侧子宫,行HE染色和免疫组织化学检测;刮取右侧子宫内膜,行流式细胞术检测。孕第8天断头取血处死各组其余10只小鼠,观察两侧子宫胚胎发育和着床情况,阴栓率 (%) =每组见栓小鼠数/每组小鼠总数×100,妊娠率 (%) =每组妊娠小鼠数/每组小鼠总数×100,平均胚胎着床数=每组胚胎着床总数/每组小鼠总数。
1.2.3 小鼠子宫组织形态观察:HE染色后,应用高分辨度彩色病理图文分析系统 (HMIAS-2000) 测量子宫内膜厚度。
1.2.4 小鼠子宫内膜CD49b+uNK细胞检测:制备子宫内膜细胞悬液,调整细胞浓度为107/mL,取0.1 mL分别加入荧光标记的小鼠抗CD49b+单克隆抗体,振荡混匀,室温避光放置30 min,离心并用PBS洗涤后,用流式细胞仪分析子宫内膜CD49b+百分率。
1.2.5 小鼠外周血CD4+T、CD8+T细胞检测:收集外周血白细胞,离心并用PBS洗涤2次。100 μL重悬细胞,加入anti-mouse CD4 FITC和anti-mouse CD8a PE抗体,避光孵育30 min,离心,PBS洗涤1次,流式细胞仪分析外周血CD4+T、CD8+T细胞百分率。
1.2.6 小鼠血清E2、P水平的检测:采用γ放射免疫分析法。
1.2.7 小鼠子宫内膜PP14表达检测:每组随机选取4只小鼠子宫,制石蜡切片,常规脱蜡至水,95 ℃柠檬酸缓冲液抗原修复,3% H2O2消除内源性过氧化物酶,3%牛血清白蛋白室温封闭,加入PP14抗体(1∶200稀释),4 ℃过夜。洗涤后滴加生物素标记二抗,室温反应40 min,充分洗涤后加ABC试剂,室温反应30 min,洗后DAB显色,冲洗,苏木精复染,盐酸乙醇分化。每只小鼠选1张切片 (10个视野) 计数阳性着色细胞,应用病理图文分析系统分析PP14表达的平均光密度值。
1.3 统计学分析
采用SPSS 26.0软件进行统计处理。计量资料用表示,满足正态分布且方差齐者组间比较采用LSD检验;计数资料用百分数表示,组间比较采用χ2检验。P< 0.05为差异有统计学意义。
2 结果
2.1 各组小鼠孕第4、8天胚胎发育和着床情况
孕第4天时,各组小鼠子宫未见胚胎着床。孕第8天,与正常组比较,模型组小鼠子宫较细且苍白,胚胎发育缓慢,妊娠率和平均胚胎着床数降低 (P<0.05)。与模型组比较,补肾组小鼠子宫充血明显,胚胎发育较好,在子宫两侧不均匀分布,妊娠率和平均胚胎着床数增加 (P< 0.05)。各组小鼠阴栓率无统计学差异 (P> 0.05)。见图1。
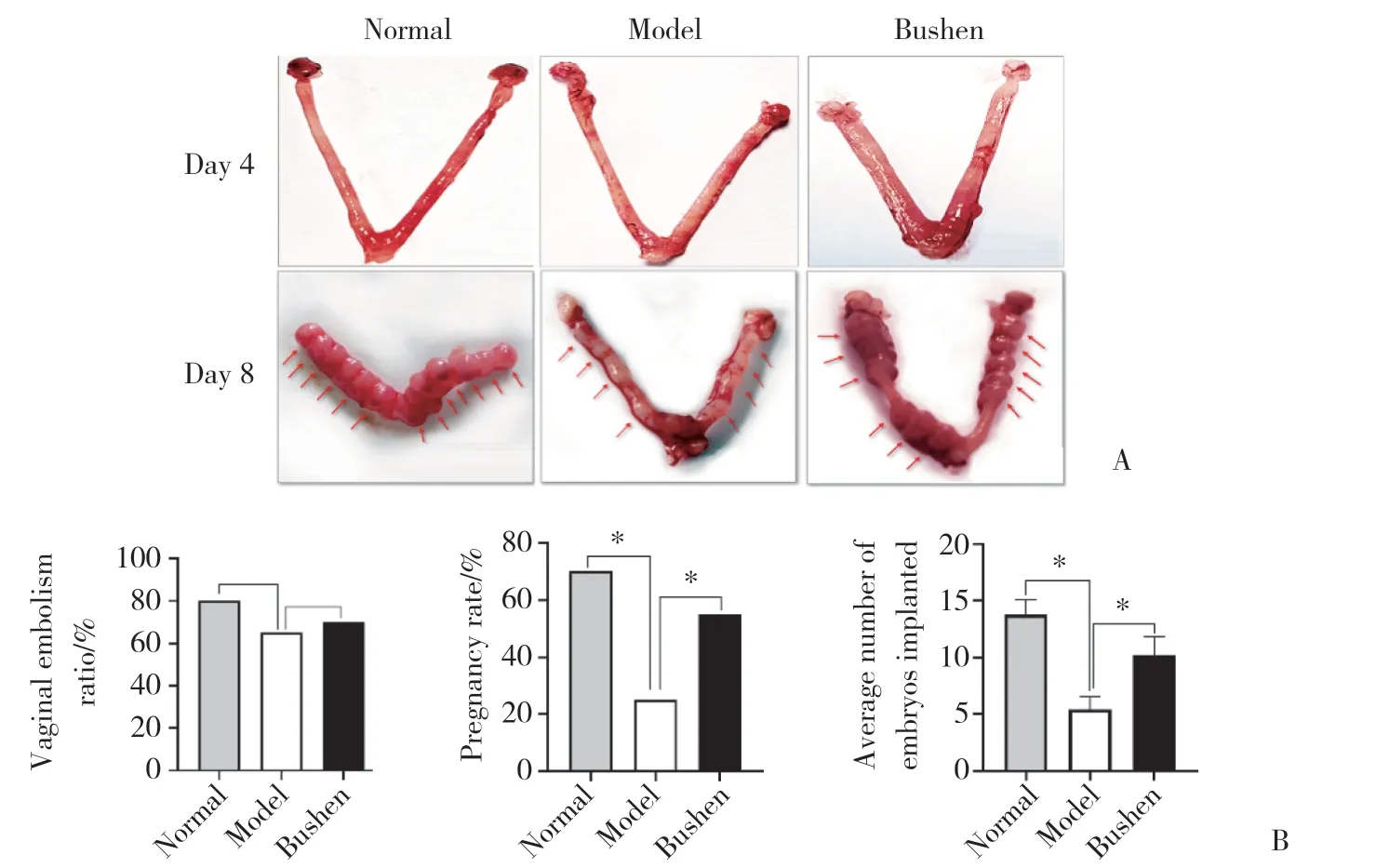
图1 各组小鼠孕第4天和第8天胚胎发育和着床情况Fig.1 Observation of embryo development and implantation on the 4th day and 8th day of pregnancy
2.2 各组小鼠WOI子宫内膜组织结构
与正常组比较,模型组小鼠子宫内膜发育延迟变薄,腺体数量减少 (P< 0.05)。与模型组比较,补肾组小鼠子宫内膜腺体增粗、弯曲呈乳头状,且数量增加,内膜增厚,血管增生,接近分泌期变化 (P<0.05),子宫内膜组织结构改善。见图2。

图2 各组小鼠WOI子宫内膜组织形态Fig.2 Morphology of WOI endometrial tissue of mice in each group
2.3 各组小鼠WOI外周血T细胞及子宫内膜uNK细胞水平
流式细胞术结果显示,与正常组比较,模型组小鼠外周血CD8+T细胞和子宫内膜CD49b+uNK细胞水平降低 (P< 0.05)。与模型组比较,补肾组小鼠外周血CD8+T细胞和子宫内膜CD49b+uNK细胞水平升高 (P< 0.05)。各组小鼠外周血CD4+T细胞水平无统计学差异 (P> 0.05)。见图3。

图3 各组小鼠WOI外周血T细胞及子宫内膜uNK细胞水平Fig.3 The levels of WOI peripheral blood T cells and endometrial uNK cells of mice in each group
2.4 各组小鼠WOI血清E2、P水平
与正常组E2[ (34.42±2.189) pg/mL]和P [ (53.82±4.625) ng/mL]水平比较,模型组小鼠血清E2[ (23.05±1.254) pg/mL]、P [ (22.95±1.723) ng/mL]水平均降低 (均P< 0.05);与模型组比较,补肾组小鼠血清E2[ (31.74±1.340) pg/mL]、P [ (33.23±1.828) ng/mL]水平均升高 (均P< 0.05)。
2.5 各组小鼠WOI子宫内膜PP14表达情况
与正常组比较,模型组小鼠子宫内膜上皮和基质细胞PP14表达降低 (P< 0.05);与模型组比较,补肾组小鼠子宫内膜上皮和基质细胞PP14表达升高(P< 0.05)。见图4。

图4 各组小鼠WOI子宫内膜PP14表达Fig.4 Expression of PP14 in WOI endometrium of mice in each group
3 讨论
目前,中医药疗法已应用于辅助生殖技术治疗不孕症的各环节。中医认为肾藏精,主生殖。精满则子宫易于摄精,血足则子宫易于容物,皆有子之道也。子宫内膜WOI所处的经前期精血充盛,阴平阳秘,则可摄精种子育胎,受孕后精血下聚以养胎。补肾法的代表方补肾助孕方由归肾丸合五子衍宗丸加减化裁而成。方中熟地黄滋补肝肾,填精益髓,滋养调控胞宫为君药。菟丝子、山药、紫石英,阳中求阴,温养肾气;山萸肉、枸杞子等滋补肾精、调养冲任;当归、白芍养血和血,3组共为臣药。香附疏肝理气而为佐使。诸药合用,共奏滋肾阴、助肾阳、填精血、调冲任,调节子宫内环境使之易于容物,以助胚胎顺利着床的作用。
IVF-ET治疗中,WOI子宫内膜缺陷是导致妊娠失败的主要原因。在某些情况下,这种子宫内膜缺陷被认为是由治疗过程中超促排卵本身造成的[1],而超促排卵是IVF-ET中极为关键的一步。本研究根据临床IVF-ET过程中超促排卵方法制作超促排卵小鼠模型,采用GnRHa进行垂体降调节,促黄体生成素 (luteinizing hormone,LH)、E2下降,通过注射外源性HMG调控多个卵泡同时被募集发育,hCG扳机诱发排卵,以获得更多数量的卵子。结果显示,超促排卵后,小鼠胚胎发育缓慢,WOI子宫内膜基质和腺体发育延迟变薄,腺体数量减少,血清E2、P水平降低;经补肾助孕方治疗后,胚胎得以较好地发育,但在子宫内分布不均,血清E2、P水平升高,在E2作用的基础之上,P使子宫内膜增厚,腺体数量增加弯曲,血管丰富,接近分泌期变化。表明补肾助孕方具有促进超促排卵小鼠胚胎发育和着床,改善子宫内膜组织结构的作用。子宫内膜腺体产生并分泌一系列组织营养物质,包括氨基酸、葡萄糖和生长因子,参与滋养外胚层活化、侵袭和植入胚胎的营养和存活[8-9]。现代药理学研究表明,补肾助孕方中的当归、丹参可活血化瘀[10-11],可增加子宫内膜的血供;菟丝子、黄芪、枸杞子有类雌激素样作用[12-13],能促进子宫内膜增厚,腺体和血管增生。可见,补肾助孕方通过改善WOI子宫内膜结构及腺体产生的营养物质和丰富的血液供应,为胚胎着床提供适宜的环境和物质基础,有助于胚胎的生长发育和植入。
胚胎在植入过程中不被母体排斥,主要依赖于母体免疫激活和胚胎抗原耐受之间的平衡[14]。WOI期间适当的免疫反应在子宫内膜容受性中起着重要作用[15]。免疫细胞,尤其uNK细胞,是获得和维持母胎界面免疫耐受性至关重要的组成部分。小鼠来源的uNK细胞表面特异性表达CD49b+[16]。研究[17]表明,胚胎通过多种通路介导调控uNK细胞分泌细胞因子,从而维持免疫耐受。uNK细胞可通过产生胚胎发育所必需的促生长因子直接刺激胎儿生长[18]。小鼠外周血T细胞主要分为辅助性CD4+T细胞和抑制性CD8+T细胞2个亚群。PP14被认为是重要的子宫内膜容受性标志物,是参与免疫耐受的重要分子之一,WOI子宫内膜PP14表达显著增加[3]。PP14可减弱母胎界面uNK细胞毒性,影响T细胞和B细胞对抗原受体的敏感性和对胎儿的排斥,以维持母胎界面的免疫稳态[19-20]。
本研究结果显示,PP14主要在子宫内膜上皮细胞和基质细胞中表达。超促排卵后,小鼠WOI子宫内膜uNK细胞和PP14表达减少,外周血CD8+T细胞减少,胚胎发育缓慢,与ZHANG等[21]的研究结果相似。经补肾助孕方治疗后,子宫内膜uNK细胞和PP14的表达明显增加,外周血CD8+T细胞获得一定程度恢复,胚胎得到较好的发育。现代药理学研究[22-23]表明,补肾助孕方中的熟地黄、黄芪具有补血和免疫调节的作用。因此,补肾助孕方一方面可能通过调节子宫内膜uNK细胞分泌促生长因子促进胚胎发育,另一方面可能通过调节子宫内膜uNK、PP14的表达及外周血CD8+T细胞,维持母胎界面免疫耐受,恢复免疫稳态和子宫内膜容受性,保护胚胎不被母体排斥,最终促进胚胎着床,从而提高了超促排卵小鼠的妊娠率和平均胚胎着床数。本研究为补肾法治疗不孕症提高辅助生殖技术的妊娠率提供了实验依据,丰富了“肾主生殖”的理论内涵。

