郑州市宠物猫源病原菌毒力基因检测及其耐药性分析
韩荣嘉,彭祖焜,刘建华,苑 丽,梁梦菊,潘玉善,贺丹丹,吴 华
河南农业大学动物医学院,河南郑州 450046)
近年来世界各地动物源致病菌耐药现象十分严重,有关宠物源病原菌的耐药性报道亦越来越多。致病性耐药菌株的出现不仅增加了猫临床病原菌感染的治疗难度,而且极易导致宠物与宠物主之间多重耐药菌的横向传播,造成新的公共卫生安全问题。了解本地区猫源病原菌毒力基因的携带情况及其对常用抗生素及抗菌药的耐药情况对于制定合理的临床抗菌治疗方案,减缓人医、兽医致病性耐药菌株的横向传播具有重要意义。
研究表明,对宠物健康造成主要威胁的是致病性强且耐多种药物的病原菌,主要有耐甲氧西林金黄色葡萄球菌(MRSA)和中间型葡萄球菌(MRSP),产超广谱β-内酰胺酶(ESBL)大肠杆菌、其他肠道菌群,比如产碳青霉烯酶的大肠杆菌、肺炎克雷伯菌、铜绿假单胞菌、粪肠球菌[1]和沙门氏菌[2]。陈霞等[3]发现从北京市伴侣动物中分离的肠球菌多重耐药情况严重,郭菲等[4]研究发现乌鲁木齐市宠物源大肠杆菌和沙门氏菌对所检抗生素的耐药率在90%以上,可见宠物源病原菌的耐药现象非常普遍。笔者在2021年7—8月收集宠物猫源拭子,对其进行分离鉴定、致病性及耐药性、耐药表型分析,旨在了解宠物临床病原菌的致病性、耐药性,以防止致病性菌株感染人类以及多重耐药菌株的横向传播。
1 材料与方法
1.1 材料
1.1.1样品来源。试验样品于2021年7—8月在河南农业大学教学动物医院和派德宠物医院采集,采集住院猫鼻拭子、咽拭子和肛拭子共62份。
1.1.2主要试剂、药品及仪器。主要试剂:TaqMix酶、BM2000 DNA Marker、50×TAE、1× TE缓冲液、琼脂糖、荧光染料溴化乙锭;麦康凯琼脂、LB琼脂、Baird-Parker培养基、肠球菌琼脂、BHI琼脂、SS琼脂、MH(B)肉汤、LB肉汤。主要药品:头孢噻呋(ceftiofur,CEF)、头孢喹肟(cefquinoxime,CFQ)、多西环素(doxycycline,DOX)、替加环素(tigecycline,TGC)、氟苯尼考(florfenicol,FFC)、庆大霉素(gentamicin,GEN)、阿米卡星(amikacin,AMK)、泰乐菌素(tylosin,TYL)、阿奇霉素(azithromycin,AZM)、替米考星(tilmicosin,TIL)、恩诺沙星(enrofloxacin,ENR)、氧氟沙星(ofloxacin,OFX)、黏菌素(colistin,COL)。以上试剂均购自天驰生物公司;药品一部分购自天驰生物公司,一部分来自笔者所在实验室。主要仪器:超净工作台(型号SW-CJ-2FD,购自苏州安泰技术有限公司)、恒温生化培养箱(型号ZQTY-70V,购自赛默飞世尔科技有限公司)、电子分析天平(型号AB204-N,购自北京锐志汉兴科技有限公司)、紫外/可见分光光度计(型号UV1800PC,购自上海元析仪器有限公司)、离心机(型号5418YQ313640,购自德国Eppendorf公司)、PCR仪(型号ETC811,苏州东盛兴业科学仪器有限公司)、全自动凝胶成像分析系统(型号Genius3,英国Syngene公司)。
1.2 方法
1.2.1宠物猫源病原菌的分离、纯化与鉴定。无菌拭子样本通过肉汤培养,菌液分别划线接种于麦康凯琼脂培养基、SS琼脂培养基、肠球菌琼脂培养基和Baird-Parker培养基上,过夜培养后挑取单菌落分离纯化3代以上,直至培养基上呈现单一菌落时再进行革兰氏染色镜检及16S rRNA鉴定。
1.2.2毒力基因PCR检测。根据参考文献[5-8]选择不同菌株目的毒力基因及引物序列(表1~4),引物由擎科生物公司合成。

表1 大肠杆菌毒力基因 PCR 引物序列

表2 肠球菌毒力基因PCR引物序列

表3 葡萄球菌毒力基因 PCR 引物序列
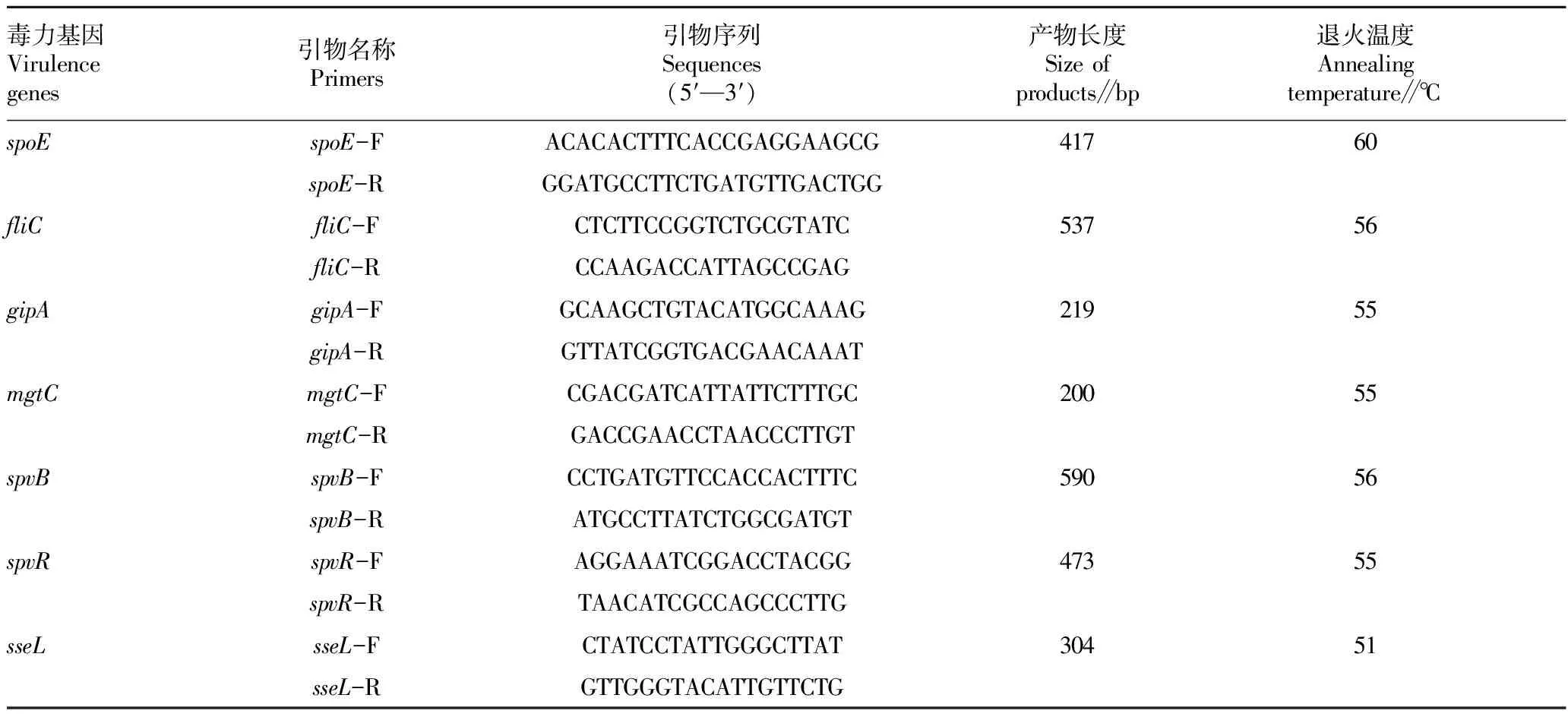
表4 沙门氏菌毒力基因PCR引物序列
1.2.3药物敏感性试验。依据美国临床和实验室标准协会(CLSI)推荐的微量肉汤稀释法测定13种抗生素或抗菌药的最低抑菌浓度(minimal inhibitory concentration,MIC);依据CLSI[9]、VET01S[10]推荐标准进行药物敏感性、耐药性结果判定,头孢喹肟(CFQ)耐药折点参考文献[11]。
1.2.4黏菌素耐药基因检测。质粒介导的黏菌素耐药基因mcr-1是引起黏菌素耐药的主要原因之一[12]。该试验中3株沙门氏菌均对黏菌素耐药。为探究其耐药性是否因mcr-1所致,故对其进行mcr-1检测。依据笔者所在实验室设计的黏菌素耐药基因mcr-1核苷酸序列合成引物,引物序列F为5′-CGGTCAGTCCGTTTGTTC-3′ ,R为5′-CTTGGTCGGTCTGTAGGG-3′,扩增产物长度为320 bp。PCR反应体系、扩增程序和产物凝胶电泳、测序同“1.2.2”。
2 结果与分析
2.1 病原菌分离鉴定结果病料样本经分离、纯化、革兰氏染色镜检,疑似有大肠杆菌、肠球菌、葡萄球菌、沙门氏菌4种细菌。经16S rRNA 通用引物扩增、凝胶电泳检测,产物送交擎科生物公司测序,测序结果进行Blast比对(http:∥www.ncbi.nlm.nih.gov),鉴定菌株与对应标准菌株的16S rRNA序列同源性均大于99%。从62份猫拭子样品中分离获得大肠杆菌16株,分离率为76.19%(16/21);获得沙门氏菌3株,分离率为14.29%(3/21);获得肠球菌14株,分离率为66.67%(14/21);获得葡萄球菌8株,分离率为38.10%(8/21)。
2.2 毒力基因检测结果
2.2.1大肠杆菌毒力基因检测。16株大肠杆菌全部检测到目的毒力基因,主要集中在5种毒力基因OmpA、fyuA、iucD、iss和hlyF,16株(100%)携带OmpA基因,12株(75.00%)携带fyuA基因,1株(6.25%)携带iucD、iss和hlyF基因,所有菌株均未检测到irp2、astA和papC基因。大肠杆菌毒力基因PCR扩增结果如图1所示。
2.2.2肠球菌毒力基因检测。14株肠球菌经PCR扩增、产物测序比对,结果发现11株检测到毒力基因,主要集中在4种毒力基因efaA、gelE、cylA和esp。其中,11株(78.57%)携带efaA基因,9株(64.29%)携带gelE基因,3株(21.43%)携带cylA和esp基因;所有菌株均未检测到ace和AS基因,3株肠球菌未检测到任何一种目的毒力基因。肠球菌毒力基因PCR扩增结果如图2所示。

注:a.肠球菌efaA毒力基因PCR扩增结果;b.肠球菌gelE毒力基因PCR扩增结果;c.肠球菌cylA毒力基因PCR扩增结果;d.肠球菌esp毒力基因PCR扩增结果;1~14.PCR产物;15.阴性对照;M.BM2000 DNA Marker。Note:a.PCR amplification results of efaA virulence gene of Enterococcus; b.PCR amplification results of gelE virulence gene of Enterococcus; c.PCR amplification results of cylA virulence gene of Enterococcus; d.PCR amplification results of esp virulence gene of Enterococcus;1-14,PCR products;15,negative control;M.BM2000 DNA Marker.图2 肠球菌毒力基因PCR扩增结果Fig.2 PCR amplification results of virulence genes of Enterococcus
2.2.3葡萄球菌毒力基因检测。8株葡萄球菌经PCR扩增、凝胶电泳分析,均未检测到筛选的目的毒力基因。
2.2.4沙门氏菌毒力基因检测。3株沙门氏菌经PCR扩增、产物测序,结果显示2株沙门氏菌检测到毒力基因,携带fliC、gipA和mgtC基因,而未检测到spoE、spvB、spvR和sseL基因;另1株沙门氏菌未检测到目的毒力基因。沙门氏菌毒力基因PCR扩增结果如图3所示。

注:a.沙门氏菌fliC毒力基因PCR扩增结果;b.沙门氏菌gipA毒力基因PCR扩增结果;c.沙门氏菌mgtC毒力基因PCR扩增结果;1~3,PCR产物;4,阴性对照;M.BM2000 DNA Marker。Note:a.PCR amplification results of fliC virulence genes of Salmonella isolates;b.PCR amplification results of gipA virulence genes of Salmonella;c.PCR amplification results of mgtC virulence genes of Salmonella;1-3,PCR products; 4,negative control; M.BM2000 DNA Marker.图3 沙门氏菌毒力基因PCR扩增结果Fig.3 PCR amplification results of virulence genes of Salmonella
2.3 药物敏感性试验结果与耐药性分析大肠杆菌、肠球菌、葡萄球菌对13种抗生素及抗菌药的药物敏感性试验结果见表5。由表5可知,大肠杆菌对CEF、CFQ、DOX和FFC的耐药率较高,其对CEF、CFQ和DOX的耐药率均为43.75%(7/16),对FFC的耐药率为62.50%(10/16),对GEN、AMK、ENR、OFX的耐药率分别为31.25%(5/16)、18.75%(3/16)、6.25%(1/16)和6.25%(1/16),而对TGC、AZM和COL敏感。14株肠球菌对CEF、TIL的耐药率较高,耐药率分别为92.86%(13/14)和57.14%(8/14),对DOX、TGC、FFC、GEN、ENR、OFX的耐药率分别为35.71%(5/14)、28.57%(4/14)、7.14%(1/14)、21.40%(3/14)、28.57%(4/14)和14.29%(2/14)。8株葡萄球菌对CEF、CFQ、DOX、GEN和AMK的耐药率较高,耐药率分别为87.50%(7/8)、100%(8/8)、87.50%(7/8)、100%(8/8)和100%(8/8),而对其他抗菌药物的耐药率介于12.50%~62.50%。
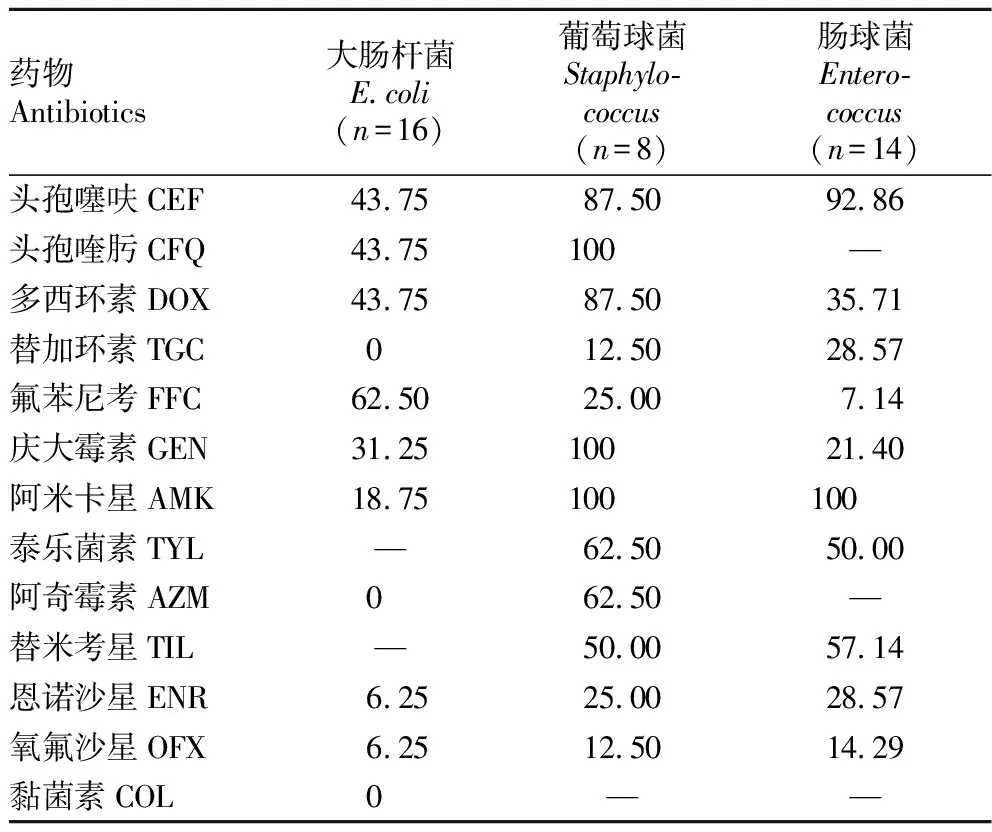
表5 大肠杆菌、肠球菌和葡萄球菌对13种抗菌药物的耐药率
3株沙门氏菌对11种抗生素及抗菌药的药物敏感性试验结果见表6。对于β-内酰胺抗生素CEF,2株沙门氏菌表现敏感、1株沙门氏菌表现耐药;对于CFQ,2株沙门氏菌耐药,1株沙门氏菌表现敏感。CFQ作为动物专用β-内酰胺类抗生素,被批准用于临床的时间不长,在宠物临床出现耐药性属于该地区首次报告,其耐药机制与原因值得进一步研究。对于四环素类抗生素DOX,3株宠物猫源沙门氏菌均表现耐药,这与食品源动物临床上DOX的耐药性报告结果[13-14]类似。这是由于兽医临床长期使用DOX作为广谱抗生素用于抗感染治疗所致。对于新型四环素类药物TGC,2株沙门氏菌表现敏感,另1株表现耐药。宿主猫并未使用TGC治疗,这可能是由于TGC耐药机制水平传播所致,其具体原因有待深入探讨与研究。3株沙门氏菌对于兽医专用酰胺醇类抗生素FFC的耐药性,2株耐药、1株中介,且2株沙门氏菌呈高水平耐药(MIC值≥256 μg/mL,高于折点MIC值16倍),这与FFC长期应用于兽医临床有关。对于氨基糖苷类抗生素AMK,1株沙门氏菌敏感、1株沙门氏菌耐药、1株沙门氏菌中介;对于GEN, 3株沙门氏菌均表现耐药。对于宠物猫源沙门氏菌,GEN主要用于检测高水平耐药,不用于临床抗菌活性评价[9]。该研究中GEN对3株猫源沙门氏菌的MIC值均大于等于64 μg/mL,表现出对氨基糖苷类抗生素的高水平耐药性(MIC>32 μg/mL)。对于大环内酰类抗生素AZM,2株沙门氏菌敏感、1株沙门氏菌耐药;对氟喹诺酮类ENR、OFX均表现为2株中介、1株耐药。对于多肽类抗生素COL,3株沙门氏菌全部表现耐药(MIC≥32 μg/mL)。

表6 沙门氏菌药敏试验结果
2.4 黏菌素mcr-1耐药基因检测结果对3株沙门氏菌的耐药基因检测结果如图4所示。2株沙门氏菌S18和S21含有mcr-1耐药基因;另外1株沙门氏菌S45对COL耐药,但未检测到mcr-1基因,怀疑有其他耐药机制导致其对COL耐药,其耐药机制需要深入研究。

注:1~3.PCR产物;4.阳性对照;5.阴性对照;M.BM2000 DNA Marker。Note:1-3.PCR products;4.Positive control;5.Negative control;M.BM2000 DNA Marker.图4 沙门氏菌mcr-1基因PCR扩增结果Fig.4 PCR amplification results of mcr-1 genes of Salmonella
3 讨论
3.1 菌株分离与鉴定Li等[15]研究表明,大肠杆菌属、葡萄球菌属、链球菌属、假单孢菌属和肠球菌属均是猫体内易分离得到的主要病原菌。该试验选择性地分离了大肠杆菌、葡萄球菌、肠球菌、沙门氏菌,大肠杆菌和肠球菌的分离率均较高,高于佟盼盼等[16](66.3%)和郭泽宇等[17](35.5%)的报道。该研究中葡萄球菌的检出率(38.10%)与Li等[15]的检出率(30%)相差不大。4种猫源病原菌中沙门氏菌的检出率最低(14.29%),可能受所采集宠物猫的健康状况、样本数量以及地区不同的影响。但是,该试验中沙门氏菌的检出率明显高于其他地区检测结果,如Wei等[18]报道猫源沙门菌的检出率为1.77%;Aeh等[19]调查发现289份猫粪便样品中沙门氏菌的检出率仅1.9%。Elnageh等[20]调查发现利比亚猫源沙门氏菌的分离率为23%(24/103),其中大多数为健康猫。以上结果表明全世界范围内不同地区的报道有所差异,也反映了沙门氏菌在伴侣动物猫群体中的高定殖状态。
肺炎克雷伯菌也属于人、兽易共同感染的主要病原菌,极易造成宠物主人感染且通过宠物犬、猫等横向传播。该试验尝试分离猫源肺炎克雷伯菌,但因宠物猫应激比较强,试验采集的咽拭子和鼻拭子样品数量较少,而肺炎克雷伯菌多存在于呼吸道及黏膜上,因此未成功分离到肺炎克雷伯菌。
3.2 毒力基因携带情况大肠杆菌主要致病性毒力基因有负责编码稳定细胞外膜结构的外膜蛋白毒力基因OmpA、血清蛋白编码毒力基因iss、影响外膜囊泡活性的毒力基因hlyF[5]、编码铁耶尔森菌素摄取受体的毒力基因fyuA、负责需氧杆菌铁载体合成的毒力基因iucD、参与铁载体耶尔森菌素生物合成的毒力基因irp2等[21]。该研究中所有大肠杆菌均检测到OmpA基因;fyuA基因的检出率也较高(75.00%),高于成都地区犬源大肠杆菌的检出率(17.31%)[22]。该研究中仅少数大肠杆菌菌株携带iucD以及iss、hlyF基因。彭严严等[5]报道安徽滁州地区9株鹅源致病性大肠杆菌OmpA、iss、hlyF、iucD基因阳性率分别为100%、100%、100%和88.9%,其中OmpA的检出率与该试验结果相同,iss、hlyF、iucD的检出率要远高于该试验结果(6.25%),说明iss、hlyF、iucD的检出率与致病性有着很强的关联性。Dec等[23]研究结果显示宠物源爬行动物大肠杆菌astA的检出率为3.13%(1/32),与该试验astA的检出结果(0)相近,这可能与物种差异有关。张海龙等[24]对河北部分地区致病性大肠杆菌中也未检出黏附素毒力基因papC,与该试验结果相一致。
该研究中葡萄球菌毒力基因选择生物膜形成相关毒力基因icaA、icaD和clfA,杀白细胞素编码基因lukS,耐热核酸酶Nuc以及剥脱毒素expB,但均未检出。De Almeida等[27]从患乳房炎奶牛中分离的金黄色葡萄球菌中也未检出icaA和icaD,这2种基因的检出可能与地区差异有关。施永超[8]从患脓皮症犬分离的葡萄球菌中检出expB的阳性率为38.8%,国外有研究人员[21]认为expB在狗的皮肤感染性疾病中扮演着重要角色。该研究中猫未患过皮肤感染性疾病。lukS在伪中间葡萄球菌中有94%的高检出率[8],与clfA、Nuc一样,这是因为葡萄球菌菌种是影响这3种毒力基因检出率的重要原因。另外,样本的分离数量、是否来自患病猫也可能是毒力基因检出率为0的原因。关于是否存在其他毒力基因则有待进一步深入研究,才能进行致病性判定。
沙门氏菌毒力相关基因主要分布在毒力岛与毒力质粒上,其对菌体的致病性具有决定性作用,毒力基因通过编码蛋白侵袭宿主产生致病性。该研究中沙门氏菌S18和S21检出fliC、gipA和mgtC毒力基因,而其他毒力岛基因和毒力质粒基因未检测到,这可能与宿主自身、遗传和环境因素有关。杨文文等[6]报道山东地区25株鸡源致病性沙门氏菌的fliC、gipA基因阳性率分别为36%和32%。任士飞等[28]研究发现鸭源沙门氏菌中mgtC毒力基因的携带率为100%。以上研究结果表明fliC、gipA和mgtC是沙门氏菌中较为流行的毒力基因。曹恬雪等[29]报道毒力质粒基因只存在于特定血清型的沙门氏菌中,比如肠炎沙门氏菌。然而,血清型是致病性的主要影响因素,毒力岛、菌毛和毒素等也是沙门氏菌致病性的关键[30]。
3.3 耐药性分析该研究中宠物猫源病原菌对被检13种抗生素或抗菌药存在不同程度的耐药性及多重耐药性。多药耐药集中在4~8耐,耐药谱型多样化。16株大肠杆菌对β-内酰胺类抗生素CEF、CFQ,四环素类DOX及FFC、GEN、AMK的耐药率为18.75%~62.50%,猫源大肠杆菌对庆大霉素的耐药率(31.25%)低于 Rzewuska等[31]报道的犬猫源大肠杆菌耐药率(68.1%)。Saputra等[32]研究发现澳大利亚猫源大肠杆菌对头孢类抗生素类药物的耐药率低于10%,该研究中大肠杆菌对头孢类药物的耐药率较高(43.75%),这与该类药物在河南郑州地区宠物临床上长期应用有关。近年来已有报道发现犬源大肠杆菌对ENR的耐药率达到55.9%[33],该研究中OFX和ENR的耐药率较低(均为6.25%),表明该地区猫源大肠杆菌对此类药物出现耐药性,但耐药性并未普遍发生,临床抗感染治疗时仍可推荐使用。值得注意的是,该研究未发现猫源大肠杆菌对TGC、AZM和COL具有耐药性,可推荐使用AZM,但TGC作为抗感染及抗多重耐药菌的新型抗生素,应尽量避免选用此类药物而优先选用耐药率较低的其他常规抗生素或抗菌药;因为COL具有较强的肾毒性,虽然其对猫源病原菌具有较强的敏感性,但不建议体内用作抗感染治疗药物,可作为外用或局部使用抗感染药物。
该研究中14株肠球菌也表现出不同程度的耐药性,CEF的耐药率达到92.86%,这与肠球菌对β-内酰胺类药物的固有耐药性有关[34]。我国18个省份猪源肠球菌已对TGC产生耐药性[35],该研究中猫源肠球菌对TGC已经表现出较高的耐药性,分析认为这是人医临床的横向传播所致。该研究中肠球菌对ENR的耐药率(28.57%)高于宋超慧等[36]报道的耐药率(12.5%),该研究中肠球菌对FFC的耐药率(7.14%)与银川地区犬源肠球菌的耐药率(8%)[37]相差不大,因此临床治疗因肠球菌引起的感染性疾病可考虑选用FFC。
该研究中8株宠物猫源葡萄球菌对被检13种抗菌药物的耐药情况严重,其对CEF的耐药率为87.50%,高于轩慧勇等[38]报道的宠物犬源葡萄球菌耐药率;该研究中葡萄球菌对FFC(25.00%)和ENR(25.00%)的耐药率明显低于轩慧勇等[38]报道结果(82.9%、64%),表明该耐药性具有地区差异性,疑似与该地区猫临床用药习惯有关。该研究中葡萄球菌对TYL的耐药率(62.50%)高于明杨等[39]报道结果(43.75%)。该试验分离的葡萄球菌多来自健康猫,且近期未使用抗生素用于抗感染治疗,可能是宠物猫和主人与其他动物和环境接触从而导致耐药菌的横向传播所致。
该研究中3株沙门氏菌的耐药性和多重耐药性也较为明显,分别达到7耐、4耐和8耐。对抗革兰氏阴性菌“最后一道防线”的COL也出现耐药性,且检测到mcr-1耐药基因,而COL因为具有较强的肾毒性而较少在宠物临床上应用,其耐药性可能是由于食品源动物横向传播所致。TGC因为高剂量下具有肾毒性而不能在人医临床应用,但因其广谱抑菌特性在多重耐药菌株感染治疗中发挥着重要作用[40]。该研究中沙门氏菌S45不仅对COL耐药,而且对TGC耐药,这是该地区宠物猫临床上首次报道,其耐药原因及传播机制值得进一步研究。
4 结论
该研究对猫源4种主要病原菌的分离鉴定、毒力基因检测及药物敏感性试验结果丰富了郑州地区猫源主要病原菌的流行病学资料和耐药性分析报告,获得的临床菌株除葡萄球菌外均不同程度携带多种毒力基因,耐药性突出且存在多重耐药现象,其对四环素类新型药物TGC和多粘菌素类COL的耐药机制疑是水平传播所致,值得引起警惕。

