格列齐特片(Ⅱ)溶出曲线考察与有关物质测定*
刘延娟,杨国宁,蔡 伟,赵蕊蕊,李鹏战
(山东省菏泽市食品药品检验检测研究院,山东菏泽 274000)
格列齐特属磺酰脲类降糖药,可选择性地作用于胰岛β 细胞,促进胰岛素分泌,并提高进食葡萄糖后的胰岛素释放,适用于单用饮食控制疗效欠佳的轻、中度2 型糖尿病的治疗。有研究发现,格列齐特可通过抑制哺乳动物雷帕霉素靶蛋白(mTOR)信号通路对高糖诱导的足细胞损伤起防护作用[1],辅助治疗高脂血症并2型糖尿病疗效较好[2-4],较其他口服降糖药有更好的控糖作用,临床应用广泛。本研究中收集了国内8 家企业生产并在山东省内流通的58 批格列齐特片(Ⅱ),考察其性状、鉴别、检查及含量测定项目,并对样品进行了溶出曲线分析和杂质分析,为生产企业进一步提升药品内在质量和药品监管提供参考[5-6]。现报道如下。
1 仪器与试药
1.1 仪器
Agilent1260 型高效液相色谱仪(美国Agilent 公司);XS105 型电子分析天平(瑞士Mettler Toledo 公司,精度为0.01 mg);RC12AD 型自动溶出试验仪(天津市天大天发科技有限公司);SYSTEM 860DL 型自动溶出仪(美国Logan公司)。
1.2 试药
格列齐特对照品(批号为100269 - 202107,含量≥99.7%),格列齐特杂质Ⅰ对照品(批号为101191- 201602,含量99.8%),对甲苯磺酰胺对照品(批号为100131 - 202205,含量99.8%),杂质B 对照品(批号为101447 - 201901),均购自中国食品药品检定研究院;对甲苯磺酰脲对照品(山东润森化工有限公司,批号为BH2111005,含量99.5%);格列齐特片(Ⅱ)样品58 批次,规格均为每片80 mg,样品信息见表1。分别抽取自生产企业(12批、20.69%)、经营企业(38批、65.52%)和医疗机构(8批、13.79%)。

表1 样品信息(n=58)Tab.1 Information of samples(n=58)
2 方法与结果
2.1 溶出曲线考察
方法:根据药物溶出曲线测定和相似性比较技术指导原则方法,考察格列齐特的溶出情况,在适宜的时间点取样,按紫外-可见分光光度法,在226 nm 波长处测定吸光度。绘制溶出曲线;通过相似因子(f2)法[7]进行溶出曲线比较。
溶液制备:采用溶出试验仪,以pH 8.6 磷酸盐缓冲液作溶出介质,在15,30,45,60,90,120,150,180,210,240 min 时自动取样,每次取10 mL,滤过,取续滤液,作为供试品溶液。取格列齐特对照品20 mg,精密称定,置250 mL 容量瓶中,加溶出介质适量,置温水浴中使溶解,放冷,加溶出介质定容,摇匀,即得对照品溶液。
结果分析:以H 企业(为原研药技术转移企业)样品为参比制剂,比较各企业样品溶出情况,结果见表2和图1。结果C企业样品和参比制剂最相似,其次是E企业,其余各企业样品和参比制剂比较,f2均大于50。
2.2 有关物质考察
2.2.1 格列齐特杂质B 含量测定
色谱条件:色谱柱为Agilent Eclipse XDB - C8柱(250 mm × 4.6 mm,5 μm);流动相为乙腈- 水- 三乙胺- 三氟醋酸(40∶60∶0.1∶0.1,V/V/V/ V);流速为1.0 mL/min;检测波长为235 nm;柱温为30 ℃;进样量为20 μL。
溶液制备:取格列齐特杂质B 对照品适量,精密称定,用25%二甲基亚砜乙腈溶液溶解并制成每1 mL 含16 μg 的溶液;精密量取1 mL,置50 mL 容量瓶中,加25%二甲基亚砜乙腈溶液定容,摇匀,作为对照品溶液。取样品细粉(约相当于格列齐特0.4 g)适量,精密称定,置10 mL 容量瓶中,加25%二甲基亚砜乙腈溶液溶解并定容,摇匀,5 000 r/min 离心10 min,取上清液,滤过,取续滤液,即得供试品溶液。
方法学考察:按相关要求进行方法学考察,供试品溶液色谱中,在与对照品溶液相同保留时间处有相应色谱峰,详见图2;精密度、稳定性、重复性试验的RSD均小于2.0%,表明仪器精密度良好,供试品溶液在室温放置12 h内基本稳定,方法重复性良好。

1. 杂质BA. 对照品溶液 B. 供试品溶液图2 杂质B的高效液相色谱图1.Impurity BA.Reference solution B.Test solutionFig.2 HPLC chromatograms of impurity B
样品含量测定:取样品适量,按拟订方法制备供试品溶液,按拟订色谱条件进样测定,记录峰面积并计算含量。结果表明,各生产企业样品均有杂质B检出,其中G 企业样品杂质B 的含量较其他企业高。部分样品含量测定结果见表3。

表3 不同企业部分样品杂质B含量测定结果(%,n=3)Tab.3 Results of content determination of impurity B in partial samples from different manufacturing enterprises(%,n=3)
2.2.2 杂质谱档案建立
通过分析合成工艺与可能的降解途径,采用高效液相色谱(HPLC)法,取各批样品及经过破坏性试验(酸、碱、高温和光照降解)的样品适量,按2.2.1项下方法制备供试品溶液,再按2.2.1 项下色谱条件进样测定,记录峰面积。杂质来源分析见表4(其中,+表示含有杂质,+ + 表示杂质增加显著;盐酸、氢氧化钠浓度均为1 mol/L),格列齐特片(Ⅱ)杂质谱见图3。格列齐特片(Ⅱ)主要存在6 种杂质。通过HPLC 法对照品定位,确认其中4种成分。结果见表5。
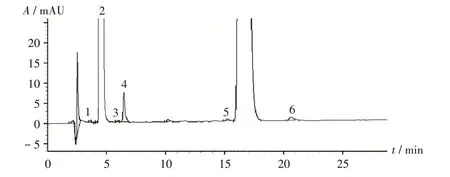
图3 格列齐特片(Ⅱ)杂质的高效液相色谱图Fig.3 HPLC chromatograms of impurities in Gliclazide Tablets(Ⅱ)

表4 杂质来源分析Tab.4 Analysis of impurity sources

表5 格列齐特片(Ⅱ)杂质信息Tab.5 Information of impurities in Gliclazide Tablets(Ⅱ)
样品杂质检测:54批样品检出对甲苯磺酰脲,58批样品检出对甲苯磺酰胺,42 批样品在相对保留时间0.39处有杂质检出,55批样品检出杂质Ⅰ,50批样品在相对保留时间1.26 处有杂质检出,检出率分别为93.10%,100%,72.41%,94.83%,86.21%。
3 讨论
58 批样品的单个杂质检出含量在0.010%~0.086%之间,杂质总量在0.032%~0.22%之间,样品含量在97.6%~103.4%之间,均符合2020 年版《中国药典(二部)》规定。
本研究结果显示,山东省内生产流通的格列齐特片(Ⅱ)体外溶出情况与参比制剂比较相似性良好,部分企业样品在特定时间点溶出有所差异,主要是因为处方工艺差异造成的,建议相关企业改善生产工艺,进一步提高药品有效性。通过对各企业样品的杂质分析,发现部分企业样品杂质含量与第十版欧洲药典中对格列齐特原料药中杂质B的限定要求比较,接近或超出原料药限度(0.000 2%)。
山东省内市场上流通的格列齐特片(Ⅱ)质量较好。现行检验标准基本能全面反映本药品质量。从探索性研究发现,部分企业杂质含量偏高,仍存在质量风险。从用药安全考虑,建议检验标准增加有关物质杂质B的定量检查及其他杂质的限量控制,从生产源头进一步控制和提高药品质量。

