吡非尼酮改善自发性高血压大鼠心肌及主动脉纤维化
李娜 杭伟健 舒鸿洋 章子璇 程佳 陈娟 周宁
据统计,高血压在我国拥有高达2.45亿的患病人群,是导致各种心脑血管事件的最主要危险因素[1]。心血管纤维化是高血压心血管损伤的关键病理改变。心脏纤维化以细胞外基质如胶原等过度沉积为主要特征,引起心脏收缩和舒张功能障碍,最终导致心力衰竭[2-3]。以纤维化为主要标志的血管重构,是高血压导致多种器官并发症的关键病理改变[4],与细胞外基质重组和炎症等多种因素有关[5]。改善心肌和血管纤维化是缓解高血压并发症的关键。
目前,吡非尼酮主要用于治疗特发性肺纤维化[6],可改善放射性肺炎[7]、肺动脉高压[8]等导致的肺纤维化。此外,吡非尼酮可缓解肝[9]、肾[10]、心脏[11]等多种器官纤维化并改善器官功能。临床研究显示,在射血分数保留的心力衰竭患者中使用吡非尼酮52周后,心肌纤维化程度较对照组患者明显减轻[11]。我们前期研究显示,吡非尼酮可通过抑制TGF-β/Smad3通路缓解由压力超负荷诱导的小鼠心肌纤维化[12]。高血压刺激导致心肌及大动脉外膜胶原蛋白大量沉积,反过来会加重血压升高和末梢器官损伤[13]。因此,找到抑制胶原产生的治疗方法可能缓解高血压引起的器官损伤,对高血压慢病防治具有重要意义。而吡非尼酮是否可以通过抗纤维化作用从而缓解高血压导致的血管胶原生成和改善器官灌注尚不明确。本研究通过体内监测大鼠心脏功能和体外病理染色等方法,揭示了吡非尼酮缓解自发性高血压大鼠(spontaneous hypertension rats,SHR)心肌及胸主动脉外膜纤维化,并改善血管弹性,为治疗高血压导致的心血管纤维化提供了临床新思路。
1 材料与方法
1.1 实验动物
SPF级Wistar-Kyoto大鼠(Wistar-Kyoto rats,WKY)10只和SHR 12只购自北京维通利华实验动物技术有限公司,体重220~250 g,适应性喂养1周:饮食饮水自由,昼夜交替光照,温度维持在25℃左右,相对湿度50%~70%。根据简单随机方法分为4组:(1)WKY+溶剂组(n=5),溶剂为5% DMSO+40% PEG300+5% Tween-80+50%生理盐水;(2)WKY+吡非尼酮组(n=5),吡非尼酮剂量为200 mg·kg-1·d-1,溶于上述混合溶剂中;(3)SHR+溶剂组(n=6);(4)SHR+吡非尼酮组(n=6),予以灌胃,持续8周。所有动物养护和实验研究均严格遵守国家卫生研究院《实验动物护理和使用指南》,本实验经华中科技大学动物伦理委员会批准,伦理批准号:[2019]伦审字(S2126)号。
1.2 主要试剂
吡非尼酮(北京康蒂尼药业股份有限公司,胶囊剂,100 mg/粒,国药准字H20133376);BCA蛋白测定试剂盒(上海碧云天生物技术有限公司);聚偏氟乙烯(PVDF)膜(北京索莱生物科技有限公司);兔抗人纤维蛋白原(A11678)、兔抗人甘油醛-3-磷酸脱氢酶(GAPDH)抗体(A19056)均购自ABclonal抗体公司;兔抗人波形蛋白(GB11192)购自武汉塞维尔生物科技有限公司;酶标亲和纯山羊抗兔IgG(H+L)(ABclonal,中国武汉),Immobilon Western HRP底物(ABclonal,中国武汉)。
1.3 尾动脉血压测定
每周1次监测大鼠尾动脉血压,连续8周。大鼠正常清醒状态,大小鼠智能无创血压计(型号:BP-2010A,北京软隆生物技术有限公司)开启预热约20 min,进行压力信号定标。根据大鼠体重将其装入固定盒内,尾部通过加压套插入至接近尾根部,此时鼠尾应已穿过脉搏传感器插入尾部加热器中的加热管内,使鼠尾刚好处于脉搏传感器的“脉搏信号传感片”上方,并调节鼠尾压迫片使传感片紧贴鼠尾下方的尾动脉,待大鼠脉搏稳定后进行血压测量。设置完毕后按下开始键,无需任何其他操作,在屏幕上即可直观地观察血压变化,并能存储、编辑、打印数据。可同时测量3只。测量5~7次后取平均值。
1.4 心脏超声
8周后,对大鼠行超声心动图检测心功能。用异氟烷气体麻醉大鼠,置于37℃恒温超声检测台上。大鼠四肢被固定在肢体铅电极上,并用低剂量乙醚持续麻醉。心率控制在300~400 bpm。在去除胸壁上的毛后,对大鼠进行常规消毒。在心脏上方胸壁涂耦合剂,用超声探头检测心脏长轴、短轴和四腔心脏切面的形态学变化。记录左室舒张期和收缩期后壁厚度(left ventricular posterior wall diastole,LVPWd;left ventricular posterior wall systole,LVPWs)、左室舒张期和收缩期前壁厚度(left ventricular anterior wall diastole,LVAWd;left ventricular anterior wall systole,LVAWs)、舒张期和收缩期左室内径(left ventricular internal dimension diastole,LVIDd;left ventricular internal dimension systole,LVIDs)、左室质量(LV mass)、射血分数(ejection fraction,EF)、缩短分数(fractional shortening,FS)等形态学和功能学指标。
1.5 组织病理学染色
用10%水合氯醛麻醉大鼠,剪断颈总动脉放血并处死大鼠后收集心脏、胸主动脉标本。切取4 μm厚度组织行多聚甲醛固定后包埋切片。病理学染色包括苏木素-伊红(HE)染色、马松三色(Masson)染色、弹力纤维(Verhoeff’s Van Gieson,EVG)染色和免疫组化染色等。
1.6 Western Blot
从左室心肌提取总心室蛋白。将组织在添加了完整蛋白酶抑制剂Cocktail、磷酸化蛋白酶抑制剂的冷RIPA裂解缓冲液中匀浆。使用BCA蛋白测定试剂盒测定蛋白浓度。蛋白质样品通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,然后通过电印迹技术转移到聚偏氟乙烯(PVDF)膜。用5%脱脂牛奶封闭1 h后,在4℃与一抗(1∶1 000)孵育过夜,然后与酶标亲和纯山羊抗兔IgG(H+L)(1∶10 000)孵育。1 h后,使用Immobilon Western HRP底物检测条带,并使用Image J程序进行灰度值分析和定量。
1.7 统计学方法

2 结果
2.1 吡非尼酮抑制SHR心肌纤维化
如图1所示,SHR的收缩压、舒张压和平均动脉压均较WKY显著升高(均为P<0.01)。吡非尼酮对WKY和SHR的血压均无明显影响。
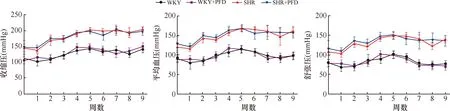
图1 大鼠血压监测
如图2A、B所示,与WKY+溶剂组相比,SHR+溶剂组心肌血管周围和间质胶原含量分别增加了131.3%和126.9%(均为P<0.01);与SHR+溶剂组相比,SHR+吡非尼酮组心肌血管周围和间质胶原含量分别下降了41.1%和44.9%(均为P<0.01)。如图2C、D所示,与WKY+溶剂组相比,在SHR+溶剂组心肌组织中,纤维蛋白原和波形蛋白表达含量分别增加了112.0%和241.0%(均为P<0.01);与SHR+溶剂组相比,在SHR+吡非尼酮组心肌组织中,上述蛋白的表达含量分别下降了43.3%和42.2%(均为P<0.01)。

A、B:Masson染色观察大鼠心肌血管周围和心肌间质的纤维化水平及统计结果(n=5);C、D:Western blot检测大鼠心肌组织纤维蛋白原和波形蛋白的表达水平及统计结果。与WKY组相比,aP<0.01;与SHR组相比,bP<0.01图2 吡非尼酮改善SHR心脏血管周围和心肌间质纤维化
2.2 吡非尼酮不影响SHR心功能和心肌肥厚
如图3A、B所示,与WKY+溶剂组相比,SHR+溶剂组的心率、EF、FS、每搏输出量、心排血量等心功能指标无显著变化,LV mass、LVAWd和LVPWd等形态学指标数值分别增加了24.2%、19.5%和10.0%(均为P<0.05),提示高血压导致大鼠发生了代偿性心肌肥厚。如图3C、D所示,与WKY+溶剂组相比,SHR+溶剂组的心重/体重比值、心重/胫骨长比值分别增加了19.9%和28.0%,心肌细胞横截面积显著增加了58.3%,表明高血压引起大鼠心肌肥厚和心肌细胞肥大。吡非尼酮对WKY和SHR的EF、FS均无显著影响。在SHR中,吡非尼酮干预前后LV mass、LVAWd、LVPWd、心重/体重比值、心重/胫骨长比值均无显著改变,提示吡非尼酮对大鼠心功能无明显影响,对SHR心肌肥厚无明显改善效应。

A、B:超声心动图观察大鼠心腔结构和各心功能指标统计结果;C:大鼠心脏和HE染色显示的心肌细胞横截面;D:心重/体重(HW/BW)、心重/胫骨长(HW/TL)和心肌细胞横截面积(CSA)统计结果(n=5)。与WKY组相比,aP<0.05,bP<0.01图3 吡非尼酮不影响大鼠心功能和心肌肥厚
2.3 吡非尼酮减轻SHR主动脉纤维化
如图4A、B所示,与WKY+溶剂组相比,SHR+溶剂组胸主动脉厚度增加约10.3%,主要以血管平滑肌层增厚为主;与SHR+溶剂组相比,SHR+吡非尼酮组中层平滑肌和血管总厚度无明显变化。如图4C、D所示,Masson染色检测血管胶原表达含量,SHR+溶剂组胸主动脉胶原含量较WKY+溶剂组增加了约26.9%(P<0.05);SHR+吡非尼酮组胸主动脉胶原含量较SHR+溶剂组减少了29.3%(P<0.01)。如图4E、F所示,免疫组化染色显示SHR+溶剂组胸主动脉纤维蛋白原较WKY+溶剂组增加了32.4%(P<0.01),SHR+吡非尼酮组较SHR+溶剂组下降了约26.5%(P<0.01)。

A、B:HE染色观察大鼠胸主动脉形态和血管外膜厚度和统计结果;C、D:Masson染色观察大鼠胸主动脉血管外膜胶原形成含量和统计结果;E、F:免疫组化染色观察大鼠胸主动脉外膜纤维蛋白原表达含量和统计结果。与WKY组相比,aP<0.05,bP<0.01;与SHR组相比,cP<0.01图4 吡非尼酮抑制SHR胸主动脉外膜纤维化
2.4 吡非尼酮改善SHR胸主动脉弹性
如图5所示,EVG染色结果显示,与WKY+溶剂组相比,SHR+溶剂组血管弹力纤维含量减少了37.9%;与SHR+溶剂组相比,SHR+吡非尼酮组胸主动脉弹力纤维含量增加了61.0%(均为P<0.01)。

EVG染色观察大鼠胸主动脉弹力纤维含量和统计结果。与WKY组相比,aP<0.01;与SHR组相比,bP<0.01图5 吡非尼酮可缓解SHR胸主动脉弹性下降
3 讨论
高血压引起的心脏重构及血管硬化是高血压相关心血管并发症的重要病理机制[14]。针对心脏重构的抗高血压药物主要是肾素-血管紧张素-醛固酮系统抑制剂及β肾上腺素能受体阻滞剂,但对于心肌纤维化的治疗效果十分有限。因此,即便在足量联合应用上述药物的情况下,高血压导致的心脑血管疾病残余风险仍然较高。针对心血管纤维化的特异性治疗,将有助于进一步降低高血压的心血管并发症风险。本研究在SHR中,证实了吡非尼酮的改善心脏及主动脉纤维化,并增强主动脉弹性的作用。这些发现,一方面为高血压的靶器官损害,即心脏和大血管的重构提供了临床诊治新思路;另一方面由于改善了血管弹性,使其未来可能成为辅助降低血压的候选药物,从而大大拓宽吡非尼酮这类药物的临床适应证。
心脏纤维化是促进心脏病理性重构、加速心力衰竭发展的关键因素[2]。缺血性心肌病、高血压性心脏病等均伴随心脏纤维化发生[15]。缓解心肌纤维化是延缓高血压相关心血管损伤的关键。初步研究表明,吡非尼酮在抗心肌纤维化中具有潜在治疗作用[16]。吡非尼酮对射血分数保留的心力衰竭患者的心脏舒张功能具有一定保护作用[11]。此外,我们前期研究显示,吡非尼酮可以延缓压力超负荷导致的心肌纤维化及心力衰竭的发展[12]。
本研究中,吡非尼酮显著缓解SHR导致的大鼠心肌纤维化。这提示除特发性肺纤维化外,吡非尼酮可缓解包括心脏在内的多器官纤维化[8-10]。同时,本研究意味着在未来的治疗中,“金三角”即血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体拮抗剂和β受体阻滞剂3类药物联用抗纤维化药物吡非尼酮可进一步降低高血压导致的心脏重构风险,可能改善患者的远期预后。
长期高血压引起血管壁和管腔压力升高,将导致系统血管重构、血栓形成及动脉粥样硬化等病理改变,从而损伤心、脑、肾等靶器官[17-18]。高血压导致的血管重构主要包括血管壁增厚、管腔变小及血管弹性下降等改变[4]。高血压引起的大动脉重构主要以内膜-中膜厚度增加为特点,并且外膜重构会限制主动脉壁内层弹性能量的储存[19]。而血管弹性与Ⅰ、Ⅲ和Ⅴ型胶原纤维密切相关。本研究显示,吡非尼酮对血管厚度无显著影响,但可缓解高血压导致的血管外膜纤维化,可能是缓解高血压导致的血管硬化并改善血管弹性的主要原因。同时,吡非尼酮抑制胸主动脉弹力纤维的断裂,改善血管弹性,这将为高血压并发症的防治提供新的依据。但是,本研究对吡非尼酮发挥改善血管弹性的机制尚未阐明,仍在进一步探索中。
综上,我们的研究证实,吡非尼酮缓解了慢性高血压的心肌和主动脉纤维化,并且通过抑制主动脉纤维化改善了主动脉弹性。
利益冲突:无

