许氏平鲉致病菌P5W的分离鉴定及致病力分析
陈钰臻,王腾腾,韩慧宗*,崔广鑫,王斐,张明亮,姜海滨*
(1.上海海洋大学 水产科学国家级实验教学示范中心,上海 201306;2.山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室,山东 烟台 264006;3.上海海洋大学 水产动物遗传育种中心上海市协同创新中心,上海 201306)
引 言
许氏平鲉(Sebastesschlegelii)又称“黑鲪”, 俗称“黑头”、“黑石鲈”, 隶属鲉形目(Scorpaeniformes)、鲉科(Scorpaenidae)、平鲉属(Sebastes), 主要分布于太平洋的西北部以及我国的黄、渤海海域, 其肉质鲜美、营养丰富、适温范围广、适应性强, 具有较高的经济价值, 是我国北方沿海地区深水网箱养殖的重要经济鱼种。近年来, 随着许氏平鲉养殖规模的扩大、区域性养殖密度的增大、养殖管理水平以及病害防控技术手段的限制, 养殖病害时有发生, 病害种类越来越多[1-6], 其中细菌性疾病最为常见。已报道的许氏平鲉致病菌有轮虫弧菌(Vibriorotiferianus)[1]、鳗利斯顿氏菌(Listonellaanguillarum)[2]、哈维氏弧菌(Vibrioharveyi)[7-8]、副溶血弧菌(Vibrioparahaemolyticus)[9]、鳗弧菌(Vibrioanguillarum)[10]、鱼肠道弧菌(Vibrioichthyoenteri)[11]等, 细菌性疾病的发生给养殖者造成较大的经济损失, 制约了许氏平鲉养殖产业的健康发展。
哈维氏弧菌是水产养殖动物的主要致病弧菌之一, 开展哈维氏弧菌的病原鉴定、理化特性及致病力分析、组织病理学观察等方面的研究对于该类疾病的防控具有指导意义。本研究从山东烟台某养殖厂患病许氏平鲉病灶处分离纯化出一株特征明显的优势菌P5W, 通过人工感染实验、16S rDNA序列比对及系统发育分析、组织病理学观察、胞外产物酶活性及溶血性分析、理化特性及药敏实验等研究, 明确了病原菌的种类、致病力及药敏反应, 为防控该疾病提供科学依据和参考。
1 材料与方法
1.1 实验材料
病原菌分离所用患病许氏平鲉取自山东烟台某养殖厂; 人工感染鱼为健康许氏平鲉, 购自烟台泰华海洋科技有限公司, 体重(65.02±16.52) g; 实验用培养基购自青岛海博生物技术有限公司; 抗菌药敏纸片购自杭州滨和微生物制剂有限公司。
1.2 病原菌的分离纯化
取患病的濒死许氏平鲉并观察其患病症状, 在无菌条件下, 取濒死鱼体的肝脏、脾脏及肾脏等组织,研磨稀释后分别划线接种于2216E及TCBS固体培养基上, 置于28℃恒温培养24 h后观察菌落的形态特征, 挑选优势菌并重复平板划线分离出单菌落, 挑取单菌落28℃扩繁后用30%甘油生理盐水保存于-80℃冰箱中。
1.3 人工感染实验
将分离纯化的优势菌接种于2216E液体培养基中, 28℃培养24 h后离心收集菌体, 使用无菌PBS缓冲液清洗菌体, 梯度稀释分别制成3×108、3×107、3×106、3×105和3×104CFU/mL的菌悬液。取健康许氏平鲉108尾暂养于试验桶内, 一周后用于人工感染试验。实验共分成6组: 5个实验组和1个对照组, 每组18尾, 分3个平行。实验组分别腹腔注射0.2 mL不同浓度的菌液, 对照组注射等量的无菌PBS缓冲液。实验期间连续充气, 每日换水2/3, 水温(21±1)℃, 连续观察并记录每组鱼体发病症状和死亡情况,采用改进的寇氏法[12]计算半数致死量LD50。取感染患病的濒死许氏平鲉再次进行病原分离与鉴定。
1.4 病原菌16S rDNA基因序列测定和系统发育树构建
挑取优势菌单菌落于无菌水中, 99℃水浴20 min, 取上清作为PCR反应模板[13-14]。病原菌16S rDNA基因序列测定的引物为27F:5'-AGAGTTTGATCCTGGCCTGGCTCAG-3', 1492R:5'-TACGGCTACCTTGTTACGACTT-3'。反应体系为50 μL, 其中包括: 正、反向引物(10mmol/L)各2 μL, 2 μL DNA模板,0.4 μL Taq酶,5μL 10×PCR Buffer (Mg2+),4 μL dNTPs,34.6 μL ddH2O。序列扩增反应条件为: 94℃ 5min; 94℃ 30 s, 55℃ 30 s, 72℃ 2 min, 30个循环; 72℃ 10 min。将PCR产物送至生物工程(上海)股份有限公司青岛测序实验室进行测序。测序结果采用BLAST软件与GenBank核酸数据库中所收集的相关种属的16S rDNA序列进行同源性分析, 利用MEGA 5.0采用邻位相连法构建系统发育树。
1.5 组织病理学观察
分别取健康与患病许氏平鲉的肝、脾、肾和肌肉组织, 切成适当大小的组织块后用Davidson’s固定液固定, 24 h后经75%的乙醇溶液数次冲洗后保存于75%的乙醇溶液中。固定好的组织经脱水、浸蜡、包埋、切片、脱蜡、洗脱后, 苏木精-伊红染色, 中性树脂封片后置于显微镜下采集照片, 并观察分析。
1.6 胞外产物酶活性及溶血性分析
参照文献[15-16]胞外产物溶血性及酶活性分析中的方法, 将菌株分别接种到蛋白酶、脂肪酶、卵磷脂酶、淀粉酶、尿素酶、明胶酶、溶血素鉴定培养基中, 28℃培养24 h后观察菌落周围是否产生明显的显色圈。其中、卵磷脂酶鉴定培养基(含10%蛋黄液)、脂肪酶鉴定培养基(含1%吐温80)、尿素酶鉴定培养基(含2%的尿素, 含酚红指示剂)和溶血素鉴定培养基(含7%绵羊脱纤维血)可分别直接观察到是否出现透明环、白色沉淀带、红色环带和溶血圈; 蛋白酶鉴定培养基(含10%脱脂奶)和明胶酶鉴定培养基(含1%明胶)经滴加氯化汞溶液后观察是否出现透明环; 淀粉酶鉴定培养基(含1%淀粉)通过碘试剂染色法着色后观察是否出现透明环。
1.7 理化因子对P5W生长的影响
通过设定不同梯度的理化因子探究温度、pH、NaCl含量(w/v%)对菌株生长的影响。取100 μL培养至对数期的菌悬液接种于LB液体培养基中, 分别置于4℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃和45℃下培养24 h后测定菌液600 nm的光密度; 取100 μL培养至对数期的菌悬液接种于pH分别为1~11(pH梯度为1)的LB液体培养基, 30℃培养24 h后测定菌液600 nm的光密度; 取100 μL培养至对数期的菌悬液接种于NaCl含量分别为0~11(NaCl含量梯度为1)普通液体培养基, 30℃培养24 h后测定菌液600 nm的光密度。以上各实验组均设置3个平行。用SPSS软件包单因素方差分析法(one-way ANOVA)中的Duncan多重比较检验法进行数据分析,再利用Origin8.0软件作图。
1.8 药物敏感性实验
采用纸片扩散法对菌株进行药物敏感性测试。取50 μL培养至对数期的菌悬液均匀涂布于MH琼脂培养基(含2% NaCl)上, 用无菌镊子将药敏纸片贴于培养基表面, 35℃培养18 h后, 测量抑菌圈直径, 根据杭州滨和微生物制剂有限公司提供的纸片法药敏试验抑菌环直径判断标准, 判断P5W对抗菌药物的敏感性。
2 结果与分析
2.1 病原菌的分离纯化及形态观察
患病许氏平鲉游动缓慢、摄食下降, 躯体表面出现溃烂充血, 鳍部伴有创伤溃疡(图1)。从患病许氏平鲉病灶处分离纯化得到形态特征一致的绝对优势菌, 命名为P5W, 在2216E培养基上呈灰白色, 圆形, 表面光滑湿润(图2A); 在TCBS培养基上呈黄色, 边缘规则, 中央隆起(图2B)。

图1 自然发病许氏平鲉的临床症状
图2 菌株P5W的菌落图
2.2 人工感染实验结果
菌株P5W感染许氏平鲉幼鱼实验持续7 d, 3×108CFU/mL和3×107CFU/mL组均在第1天出现死亡, 3×108CFU/mL组在第2天全部死亡, 3×106CFU/mL和3×105CFU/mL组均第2天出现死亡, 实验累计死亡率分别为33%和11%, 人工感染后实验组许氏平鲉活力下降, 贴桶壁缓慢游动, 部分白便, 躯体表面出现溃烂充血, 与自然发病症状一致; 对照组许氏平鲉实验期间无死亡, 活力正常, 未出现异状。从感染的患病许氏平鲉病灶处再次分离优势菌, 其菌落形态与菌株P5W一致, 16S rDNA测序结果也与菌株P5W完全一致, 表明感染患病的许氏平鲉病原菌与养殖厂患病许氏平鲉的病原菌相同, 且均具有较强的致病力。根据菌株P5W对许氏平鲉人工感染实验结果, 采用改进的寇氏法, 计算出菌株P5W对许氏平鲉的LD50为5.7×106CFU/mL(表1)。
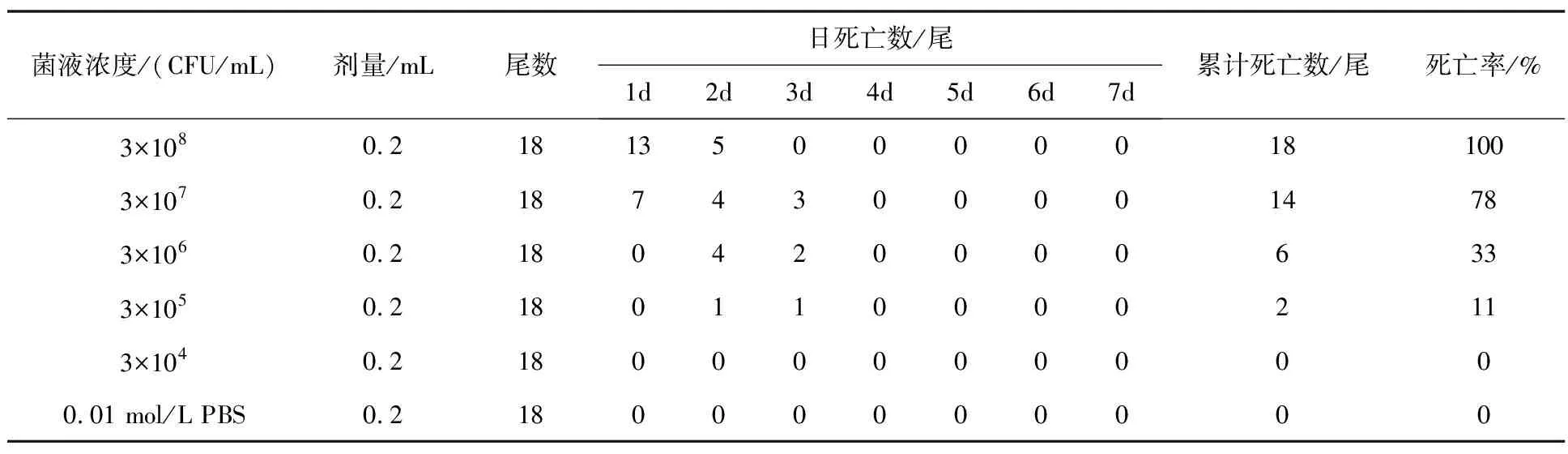
表1 菌株P5W对许氏平鲉人工感染实验结果
2.3 病原菌16S rDNA基因序列测定和系统发育树构建
对菌株P5W进行PCR扩增,获得1451bp大小的片段, 将测序结果在NCBI数据库进行Blast比对分析, 结果显示, 其与哈维氏弧菌SF-1(MT071256.1)的相似度为99.45%, 用MEGA 5.0软件采用邻位相连法构建系统发育树(图3), 发现菌株P5W与哈维氏弧菌聚为一支, 可鉴定菌株P5W为哈维氏弧菌。

图3 菌株P5W基于16S rDNA基因序列的系统发育树
2.4 组织病理学观察结果
患病许氏平鲉组织病理学观察可见肝脏、脾脏、肾脏、肌肉组织出现不同程度的病变。健康许氏平鲉肝脏细胞完整、排列紧密(图4A), 患病鱼肝脏细胞间界限模糊, 肝细胞呈明显空泡化, 肝细胞萎缩, 细胞核变大, 胞内物质颜色加深(图4B); 健康许氏平鲉脾脏细胞排列规则紧密(图4C), 患病鱼脾脏组织细胞发生离散,出现较多空隙, 含铁血黄素沉积 (图4D); 健康许氏平鲉肾单位结构清晰, 肾小球、肾小管结构完整, 细胞规则整齐(图4E), 患病鱼肾小管管腔变窄, 部分上皮细胞脱落、坏死, 肾小球萎缩, 肾间质中出现较多空泡(图4F); 健康许氏平鲉肌节分明、排列紧密(图4G), 患病鱼肌纤维结构松散, 出现断裂、坏死现象(图4H)。
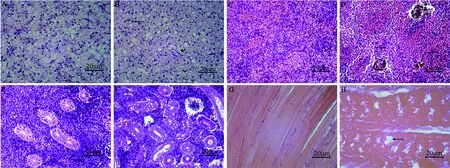
图4 许氏平鲉组织病理学观察
2.5 胞外产物的酶活性及溶血性
胞外产物的酶活性及溶血性结果如表2所示,蛋白酶、卵磷脂酶、明胶酶活性检测菌落周围出现透明区环; 脂肪酶活性检测菌落周围出现白色沉淀带;淀粉酶活性检测菌落周围培养基变透明; 尿素酶活性检测菌落周围呈红色。溶血素活性检测发现菌落周围出现透明的溶血圈; 综上, 菌株P5W胞外产物具有蛋白酶、脂肪酶、卵磷脂酶、淀粉酶、尿素酶及明胶酶活性, 对绵羊血有溶血性。

表2 胞外产物酶活性及溶血性检测结果
2.6 不同理化因子对P5W生长的影响
不同温度、pH、NaCl含量(w/v%)对菌株P5W生长的影响如图5所示。菌株P5W在温度为15~35℃条件下均能生长, 温度为25℃时生长最好, 温度为40℃时少量生长, 当温度过低(T≤10℃)或温度过高(T=45℃)时生长不明显; 菌株P5W在pH为5~10均能生长, 其中pH为7时生长最好, 当pH过低(pH≤4)或pH过高(pH≥11)时P5W菌株生长缓慢, 甚至不生长; 菌株P5W在NaCl含量为1~8时均能生长, NaCl含量为2~4时生长较好, NaCl含量为0或9~11时基本不生长。
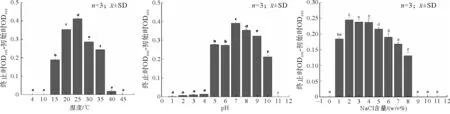
图5 不同温度、pH、NaCl含量下P5W的生长情况
2.7 药敏实验结果
菌株P5W对35种抗菌药物的敏感性实验结果: 菌株P5W对13种药物尤为敏感, 对10种药物中度敏感; 对12种药物耐药(表3)。敏感性药物包括头孢噻肟、头孢曲松、头孢吡肟、头孢他啶、头孢西叮、氧氟沙星、诺氟沙星、左氟沙星、氯霉素、四环素、米诺环素、复方新诺明、呋喃妥因; 耐药性药物包括氨苄西林、苯唑西林、青霉素G、哌拉西林、链霉素等。
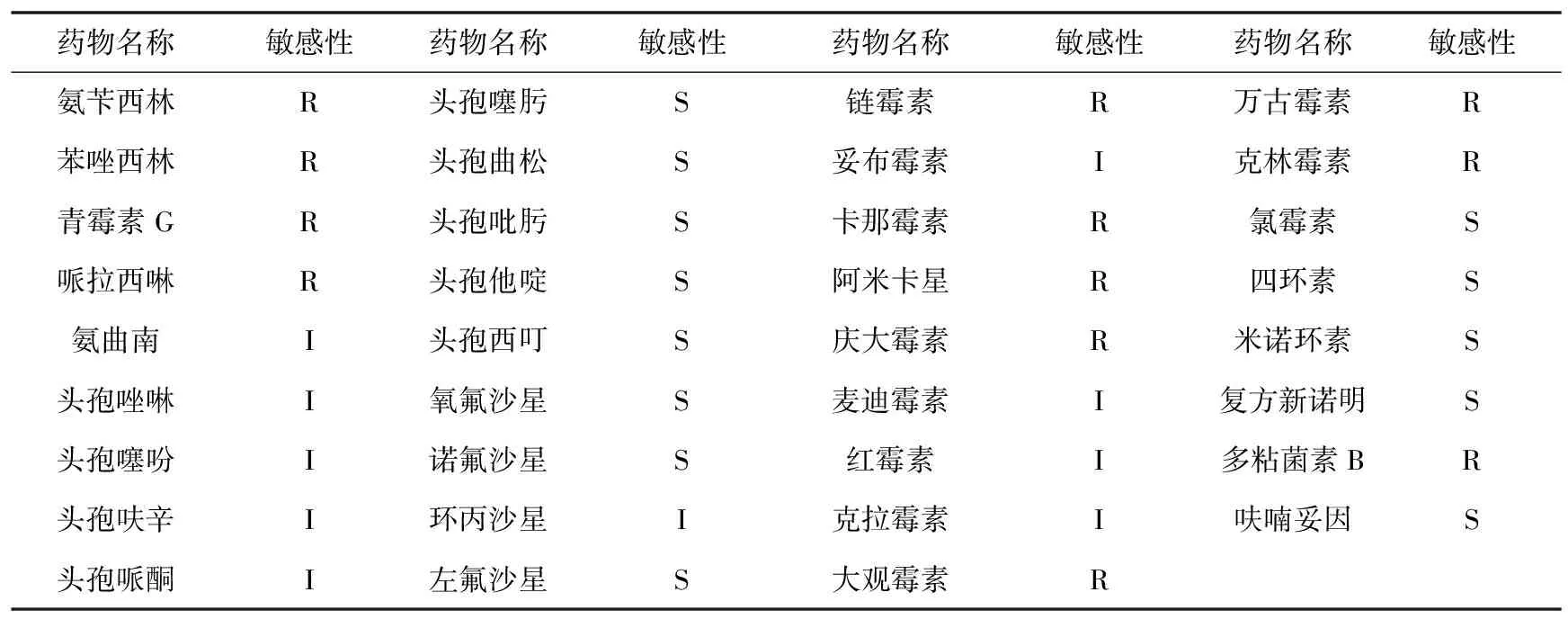
表3 菌株P5W的药敏实验结果
3 讨论
哈维氏弧菌为革兰氏阴性菌, 属弧菌目(Vibrionales)、弧菌科(Vibrionaceae)、弧菌属(Vibrio), 广泛分布于海洋环境中[17]。哈维氏弧菌是导致水产养殖动物爆发弧菌病的重要病原菌, 能引起大黄鱼(Larimichthyscrocea)[18]、半滑舌鳎(Cynoglossussemilaevis)[19]、牙鲆(Bastardhalibut)[13]、美洲黑石斑鱼(Centropristisstriata)[20]、凡纳滨对虾(Litopenaeusvannamei)[21]、金头鲷(Sparusaurata)[22]等患病甚至死亡。本研究从患病许氏平鲉体内分离得到一株优势菌P5W, 经16S rDNA序列比对与系统发育进化树的分析。 结合形态特征观察, 鉴定菌株P5W为哈维氏弧菌; 人工感染实验证实菌株P5W对许氏平鲉具有较强的致病力, 其LD50为5.7×106CFU/mL。
哈维氏弧菌可引起不同鱼类的组织和器官发生不同程度的病变。感染哈维氏弧菌的患病大黄鱼肾小管上皮细胞出现空泡并溶解, 部分上皮细胞脱落、坏死; 肝细胞实质结构遭到明显破坏, 呈现空泡化, 最终形成局灶性坏死[18]。感染哈维氏弧菌的患病牙鲆肠、肝脏、脾脏和肾脏均有不同程度的损伤, 表现为组织泛白, 细胞呈现空泡变性、破裂变形, 血红细胞浸润及溶解[13]。本研究显示, 哈维氏弧菌侵染许氏平鲉鱼体后, 其肝、脾、肾及肌肉出现不同程度的病变与坏死, 患病鱼肝细胞呈明显空泡化, 肝细胞萎缩且胞内物质颜色加深, 脾脏组织细胞离散, 含铁血黄素沉积, 肾小管部分上皮细胞脱落、坏死, 肾小球萎缩, 肌纤维结构出现断裂、坏死现象。哈维氏弧菌侵染鱼体后会导致机体肝脏、脾脏、肾脏、肌肉、肠道等组织发生病变或坏死, 影响宿主相关组织器官正常功能的维持和发挥, 从而引发宿主发病甚至死亡。
致病菌的胞外产物协同作用破坏宿主组织并为致病菌提供足够营养, 是决定其致病性的重要因素, 包括胞外蛋白酶、溶血素、细胞毒素等[23]。溶血素能使血细胞溶解, 导致机体出血, 胞外酶可以分解蛋白质、脂质等物质, 溶解鱼体各种细胞, 破坏鱼体相关组织, 最终导致宿主患病甚至死亡[24-26]。本研究结果显示, 哈维氏弧菌P5W的胞外产物对绵羊血有溶血性, 具有蛋白酶、脂肪酶、卵磷脂酶、淀粉酶、尿素酶及明胶酶活性。沈桂明等[15]指出珍珠龙胆石斑鱼[Epinephelusfuscoguttatus(♀) ×Epinepheluslanceolatus(♂)]的致病菌株哈维氏弧菌ML0株具有酯酶、明胶酶、淀粉酶、酪蛋白酶活性, 无脲酶活性, 无溶血性; 王斌等[27]发现红鳍东方鲀(Takifugubimaculatus)的致病菌株哈氏弧菌H-06091具有淀粉酶和酪蛋白酶活性, 不具有卵磷脂酶、脂肪酶和明胶酶活性, 无溶血活性; 陈政强等[28]的研究表明半滑舌鳎的致病菌株哈维氏弧菌A3具有淀粉酶、尿素酶、脂肪酶、蛋白酶和卵磷脂酶活性, 不具有明胶酶活性,有溶血活性。上述研究表明哈维氏弧菌的胞外产物具有多种酶活性, 这可能是其引发宿主各组织器官病变或坏死、导致其发病或死亡的原因; 但不同哈维氏弧菌菌株胞外产物的酶活性以及溶血性会略有差异, 其致病机理可能有所差异。
哈维氏弧菌是一种条件致病菌, 当养殖海水温度、pH、盐度、流速、氨氮含量等环境因子出现较大波动时, 养殖鱼类受这些不良环境胁迫后机体免疫力下降, 再暴露一定浓度的哈维氏弧菌, 从而引发弧菌感染; 鱼体皮肤粘液层受到破坏或投喂含有哈维氏弧菌的饲料也易引发鱼体感染, 导致鱼体患病或死亡[29-31]。因此,养殖生产中可通过调控水环境、增强机体免疫力、严控饲喂管理等手段实现海水鱼弧菌类疾病的防控。温度、pH值、NaCl含量等水环境因子是影响哈维氏弧菌生长和致病性的重要因素,通过调控养殖水环境达到抑制哈维氏弧菌活性从而减少弧菌疾病发生是弧菌类病害防控的重点。本研究表明哈维氏弧菌P5W的适宜生长条件为温度15~35℃, pH值5~10, NaCl含量1~8, 最适生长条件为温度25℃, pH值7, NaCl含量2~4。因此,养殖日常管理中要注重维持水环境的稳定,降低病原水平,减少养殖鱼类机体的应激反应, 避免其因受环境胁迫而降低免疫力。当病害发生时,可通过降低水温、降低密度、停止投喂、严格隔离等手段控制病情。
水产药物的使用可以降低病原水平, 开展病原药敏实验、明确病原耐药性对养殖生产科学有效精准用药具有指导作用。本研究中药敏实验结果显示, 哈维氏弧菌P5W对不同类抗菌药物的敏感性不同。其中, P5W对头孢噻肟、头孢曲松、四环素及复方新诺明等药物尤为敏感, 对头孢呋辛、头孢哌酮、环丙沙星、红霉素和庆大霉素等药物中度敏感或不敏感。孟鹏等[7]从患病许氏平鲉体表分离的哈维氏弧菌HV0811对庆大霉素、红霉素、先锋必素、丙氟哌酸、头孢呋肟及复方新诺明等高度敏感, 这与P5W的药物敏感性不同, 表明同一宿主的同种病原菌可能由于菌株的不同表现出不同的耐药性。研究结果为许氏平鲉哈维氏弧菌疾病的防控提供了指导。水产药物的使用可能引发水环境污染、病原菌耐药性增加等问题, 因此抗生素类药物的使用并不是最佳的水产病害防控方案。发展生态养殖模式[32]、培育优质抗病苗种[33-34]、开发病原疫苗[35-36]、使用微生态制剂[37-38]、加强科学精细化饲养[39]等措施是未来建立水产绿色养殖病害防控体系的主要方向。本研究证实了哈维氏弧菌P5W对许氏平鲉具有强致病力, 能够破坏机体组织结构, 可以作为材料用于开展许氏平鲉抗病苗种的选育和哈维氏弧菌疫苗的开发, 促进许氏平鲉病害防控体系的建立和养殖产业的健康发展。

