新型冠状病毒变异株研究进展
杨献光,张东伟,胡冰
(河南师范大学 生命科学学院,河南 新乡 453007)
SARS-CoV-2是第三种导致人类严重急性呼吸系统疾病的冠状病毒,仅次于2003年的SARS-CoV和2012年的MERS-CoV[1].与SARS-CoV和MERS-CoV相比,由SARS-CoV-2引起的COVID-19对全球医疗系统造成严重破坏,并夺去数百万人的生命.截至2022年9月27日,新型冠状病毒迅速传播到200多个国家,确诊病例数超6.1亿,超过650万人死亡[2].
SARS-CoV-2基因组约30 kb,编码4种结构蛋白,分别为刺突(Spike,S)蛋白、包膜(Envelope,E)蛋白、膜(Membrane,M)蛋白和核衣壳(Nucleocapsid,N)蛋白,6种辅助蛋白开放阅读框(ORF3a、ORF6、ORF7a、ORF7b、ORF8和ORF10)以及16种非结构蛋白(Non-Structural Proteins,NSP)(NSP1~NSP16)[3].SARS-CoV-2的S蛋白被弗林(Furin)蛋白酶裂解为S1亚基和S2亚基,S1亚基由N末端结构域(N-Terminal Domain,NTD)和受体结合域(Receptor-Binding Domain,RBD)组成,主要负责与宿主细胞血管紧张素转换酶2(Angiotensin Converting Enzyme 2,ACE2)受体结合.SARS-CoV-2的S蛋白和开放阅读框中发生的氨基酸位点的替换、缺失和插入导致了许多病毒变异株,这些变异株的一些生物学特性可能发生了改变,比如病毒的传播力、致病力及免疫原性[4].在新冠肺炎大流行期间,SARS-CoV-2的变异株层出不穷,并在世界各地传播,对目前的疫苗以及治疗方法产生巨大影响[5].面对这一情况,世界卫生组织(World Health Organization,WHO)将满足以下条件的变异株划分为“关切变异株”(Variants of Concern,VOC):(1)流行病学的传播力增加或有害变化;(2)毒力增加或临床疾病表现变化;(3)公共卫生和社会措施或诊断、疫苗、治疗方法的有效性降低.VOC变异株有Alpha,Beta,Gamma,Delta,以及正在全球大流行的Omicron.本文基于国际最新研究进展,对这些变异株的流行特征和生物学特性以及S蛋白关键氨基酸突变特征进行综述.
1 VOC变异株
1.1 Alpha(α,B.1.1.7)
Alpha变异株(别名:B.1.1.7;VOC 202012/01;20I/501Y.V1)最初在英国报道,并很快传播到世界各地.Alpha变异株在S蛋白中有一系列突变,分别为:Δ69-70、Δ144、N501Y、A570D、D614G、P681H、T716I、S982A和D1118H(表1).与原始病毒株相比,Alpha变异株的传播力增加了40%~70%,这意味着即使疾病严重程度没有发生变化,病毒仍旧会导致更高的发病率和更多的住院人数[6].DAVIES等[7]评估了英国220多万SARS-CoV-2确诊病例和17 452例相关的死亡病例,观察到感染Alpha变异株患者的死亡风险比感染其他变异株高出61%,表明Alpha变异株不仅传播能力更强,对人类健康的威胁也更严重.

表1 SARS-CoV-2 密切关注株
基于S蛋白的NVX-CoV2373疫苗(Novavax公司)免疫者血清对Alpha变异株的假病毒的中和活性略有降低,该疫苗对Alpha变异株的保护率也从针对原始SARS-CoV-2病毒株的95.6%下降到85.6%;接种了以腺病毒载体为基础的牛津/阿斯利康疫苗免疫者血清对Alpha变异株活病毒的中和活性下降了57%~89%,该疫苗对Alpha变异株的有效率为61.7%[8];辉瑞mRNA疫苗免疫者血清对Alpha变异株的假病毒中和活性下降了41.2%,对活病毒中和活性下降了41.2%~71.5%,该疫苗对预防Alpha变异株感染的有效性为89.5%,对预防重症或死亡病例的有效性为97.4%[9].英国牛津大学的一项研究表明,恢复者血清对Alpha变异株活病毒的中和活性下降65.6%,对假病毒的中和活性降低38.7%,而感染Alpha变异株的恢复者血清对野生型毒株的中和活性几乎无变化[9].目前使用的单克隆抗体Imdevimab、Casirivimab、REGN10989和Bamlanivimab都保持着对Alpha变异株的中和能力[10],这些结果证明,目前的疫苗和治疗手段对Alpha变异株的有效性并没有明显改变.
1.2 Beta(β,B.1.351)
Beta变异株(别名:VOC 202012/02;20H/501Y.V2)属于B.1.351谱系,在S蛋白中有10个突变位点,分别为D80A、D215G、Δ241-243、K417N、E484K、N501Y、D614G和A701V,其中RBD中的2个突变位点N501Y和D614G同样出现在SARS-CoV-2 Alpha变异株中,而K417N在SARS-CoV-2 Alpha变异株中不存在[11].SARS-CoV-2 Beta变异株于2020年10月在南非出现,研究显示,Beta变异株的传播能力比野生型病毒高50%,感染Beta变异株的样本中病毒载量更高,所以Beta变异株很快就传播到世界各地[12].
研究显示牛津/阿斯利康疫苗免疫者血清对Beta变异株活病毒的中和活性降低了76%~97%,对预防轻至中度症状的保护力仅为10.4%;辉瑞mRNA疫苗对Beta变异株的作用同样有所降低,疫苗免疫者血清对Beta变异株的假病毒中和活性下降了87.3%,对活病毒中和活性下降了87.0%~90.4%,该疫苗对Beta变异株感染的有效性为75.0%,对重症或死亡病例的有效性为97.4%[9].南非的一项研究显示,当90%以上的新冠肺炎病例由Beta变异株引起时,NVX-CoV2373疫苗的有效性为60%[13].英国牛津大学的一项研究表明,感染野生型毒株的恢复者血清对Beta变异株活病毒的中和活性下降了92.5%,而感染Alpha变异株的恢复者血清对Beta变异株活病毒的中和活性下降了77.3%[13].单克隆抗体Imdevimab和Casirivimab对Beta变异株失去了部分中和能力,这2种抗体的混合物(REGN-COV2)有效地抑制Beta变异株S蛋白介导的进入,抗体REGN10989和Bamlanivimab完全失去了对Beta变异株的中和能力[10].
1.3 Gamma(γ,P.1)
Gamma变异株(别名:P.1;20J/501Y.V3)是B.1.1.28谱系的一个分支,首次在巴西发现,并很快成为巴西的优势变异株[14].Gamma变异株在S蛋白中有12个突变,分别为L18F、T20N、P26S、D138Y、R190S、K417T、E484K、N501Y、D614G、H655Y、T1027和V1176F.计算建模表明,Gamma变异株的传播能力是野生型病毒的1.7~2.4倍.除此之外,有研究表明,随着越来越多的年轻人因该病毒出现晚期疾病并死亡,Gamma变异株可能导致疾病更加严重,比较Gamma变异株出现之前和流行期间的病死率发现,Gamma流行期间整体的死亡率比Gamma变异株流行之前有所增加,其中20~39岁个体的死亡率增加最多,是之前的2.7倍[15].
疫苗免疫者血清对Gamma变异株的中和活性都有不同程度的降低,其中辉瑞mRNA疫苗免疫者血清对Gamma变异株的活病毒中和活性降低56.6%~61.6%,对假病毒中和活性下降80.0%;牛津/阿斯利康疫苗免疫者血清对Gamma变异株活病毒的中和活性下降了65.6%[9,13].法国一项对mRNA疫苗(辉瑞mRNA和mRNA-1273)有效性的研究显示,接种2剂mRNA疫苗之后,预防Gamma变异株感染的有效性估计为77%.此外,中国科兴疫苗(接种2剂)针对Gamma变异株的预防住院的有效率为55.0%,预防死亡率为61.2%,而牛津/阿斯利康疫苗预防住院的有效率为87.6%,预防死亡率为93.6%[16].研究发现感染原始病毒株的康复者血清对Gamma变异株的假病毒中和活性降低了79.2%,而感染Alpha变异株的恢复者血清对Gamma变异株的活病毒中和活性降低了44.5%,对野生型活病毒的中和活性几乎无变化[10].单克隆抗体Imdevimab可以有效阻碍Gamma变异株S蛋白驱动的进入,Casirivimab对Gamma变异株失去部分中和能力,2种抗体的混合物(REGN-COV2)能有效地抑制Gamma变异株S蛋白介导的进入,抗体REGN10989和Bamlanivimab完全失去对Gmama变异株的中和能力[10].
1.4 Delta(δ,B.1.617.2)
Delta(B.1.617.2)变异株属于B.1.617的子分支,该分支还含有2个分支,分别为B.1.617.1(Kappa)和B.1.617.3,这些分支含有不同的变异株,其中Delta变异株的S蛋白出现10个氨基酸突变(T19R、G142D、Δ156-157、R158G、L452R、E484Q、T478K、D614G、P681R,D950N).研究显示Delta变异株的传染性不仅比高传染性的Alpha变异株高出约60%,感染Delta变异株患者的病毒载量比感染野生型病毒株高约1 000倍,表明感染早期存在更快的病毒复制和更高的传染性[17].加拿大的一项回顾性研究显示,感染VOC变异株(B1.1.17,B.1.351和P.1)比非VOC病毒株的住院风险高52%,重症监护室(Intensive Care Unit,ICU)入住率高89%,死亡风险高51%;感染Delta变异株比非VOC病毒株的住院风险高108%,ICU入住风险高235%,死亡风险高133%[18].
疫苗免疫者血清和恢复者血清对Delta变异株的中和活性降低,其中辉瑞mRNA疫苗免疫者血清对Delta变异株活病毒的中和活性降低56.6%~82.8%,对假病毒的中和活性降低71.5%,接种加强针的疫苗免疫者血清对Delta变异株活病毒的中和活性降低23.1%~78.8%;而接种Moderna公司的mRNA-1273疫苗的免疫者血清对Delta变异株活病毒的中和活性降低67.8%~90.0%,接种加强针的免疫者血清对Delta变异株活病毒的中和活性降低75%;康复者血清对Delta变异株活病毒的中和活性下降50%~80%[19].研究显示接种2剂辉瑞疫苗对预防Delta变异株感染的有效性为51.9%,对预防Delta变异株导致的重症或死亡的有效性为93.4%;接种2剂Moderna公司的mRNA-1273疫苗对预防Delta变异株感染的有效性为73.1%,对预防Delta变异株导致的重症或死亡的有效性为96.1%[19].以上结果表明,虽然现有疫苗对预防Delta变异株感染的有效性略有降低,但仍然能很好地预防重症以及死亡.目前的几种单克隆抗体Etesevimab,Casirivimab,Imdevimab,Tixagevimab,Regdanvimab,Cilgavimab,Adintrevimab和Sotrovimab都对Delta变异株有良好的中和能力,只有Bamlanivimab失去对Delta变异株的中和能力[20].
1.5 Omicron(ο,B.1.1.529)
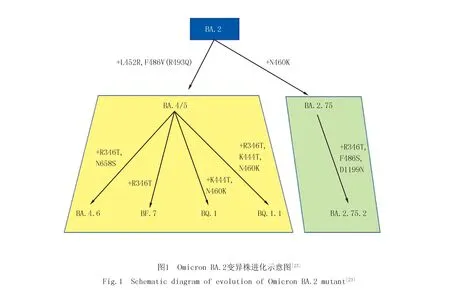
2021年11月24日,南非向WHO报告了一个新的变异株Omicron(B.1.1.529),随后WHO将Omicron划分为VOC.在此之后,Omicron 变异株在短短几周内迅速传播到近150个国家,并推动了全球COVID-19确诊病例的第4次高峰,Omicron变异株已经取代了以前占主导地位的Delta 变异株,在世界上拥有最大的流行度.Omicron变异株包括BA.1、BA.2、BA.3、BA.4和BA.5亚型,其中BA.1和BA.2是全球发现的最普遍的亚型[21].文中提到的Omicron变异株是指BA.1,除非另有说明.由于BA.2亚型变异株的传播能力和免疫逃逸能力比BA.1变异株更强,感染过BA.1亚型变异株的个体仍能再次被BA.2亚型变异株感染[22].BA.2变异株在进化过程中产生了新的亚型(例如BA.4,BA.5,BA.2.75),这些病毒亚型在S蛋白上积累了新的突变,并表现出更强的免疫逃逸能力,感染这些变异株的患者数量进一步增加,并逐渐占据优势地位(图1).
Omicron变异株的S蛋白除D614G突变外还包括NTD中的8个突变(A67V、Δ69-70、T95I、G142D、Δ141-143、Δ211、L212I和Ins214EPE),RBD中的15个突变(G339D、S371L、S373P、S375F、K417N、N440K、G446S、S477N、T478K、E484A、Q493R、G496S、Q498R、N501Y和Y505H),T547K突变,3个靠近Furin裂解位点的突变(H655Y、N679K和P681H)以及S2区域的6个突变(N764K、D796Y、N856K、Q954H、N969和L981F)[20].Delta变异株的基本传播数(Basic reproduction number,R0)在3.20和8.36之间,Omicron变异株的传播能力约是Delta变异株的3.2倍,倍增时间约为3 d.相较于其他变异株(Alpha、Beta和Delta),Omicron变异株在小鼠上呼吸道和下呼吸道的复制显著降低,感染Omicron变异株引起的疾病严重程度下降,肺部的病理情况也有所改善,体质量减轻最少,死亡率也下降很多[24],在临床上也观察到类似的情况.对南非豪登省早期病例的研究表明,Omicron变异株流行时,住院病人的死亡率约为4.5%,明显低于Beta或Delta变异株流行时住院病人的死亡率,并且Omicron变异株大流行时,重症降低了73%,与在南非西开普省的研究结果相似,住院和死亡的风险分别降低约28%和59%.英国的一项研究表明,感染Omicron变异株住院的风险约是感染Delta变异株的1/3,在法国和挪威的研究也得到类似的结果[25].此外,自发现Omicron变异株以来,观察到感染Omicron变异株的无症状感染者比之前更多,这可能表明该突变株的症状较轻[26].先前的感染和疫苗接种提高了群体免疫水平,此外,在感染Omicron变异株的患者中,年轻患者的比例更高,这些都可能会导致Omicron变异株的致病性被低估[19].
疫苗对SARS-CoV-2相关的严重疾病和死亡具有极高的保护水平,然而,疫苗诱导的中和抗体对Omicron变异株的敏感性明显降低,保护效力也大大下降.mRNA-1273疫苗免疫者血清对Omicron变异株假病毒的中和活性降低97.5%,对活病毒的中和活性降低97.6%;辉瑞疫苗免疫者血清对Omicron变异株假病毒的中和活性降低97.3%,对活病毒的中和活性降低95.7%;牛津/阿斯利康疫苗免疫者血清对Omicron假病毒的中和活性降低95.3%[27].南非的一项研究显示,Omicron变异株出现之后,辉瑞疫苗对预防住院的有效性从93%下降到70%,此外,只有约1/3康复者血清对Omicron变异株具有中和作用.研究人员对接种2剂辉瑞疫苗和康复的儿童和青少年(2~17岁)体内的中和抗体进行评估,结果显示,只有38.2%的疫苗接种者和26.7%的康复者体内的中和抗体滴度达到或高于检测阈值,针对Omicron变异株的中和抗体滴度大大低于针对原始病毒株产生的中和抗体[28].以上结果证明:相较于之前的变异株,疫苗接种者和康复者更容易被Omicron变异株再次感染.
研究显示,接种过牛津/阿斯利康疫苗的人群中,13/21的免疫者血清中可检测到对Omicron变异株的中和活性,而辉瑞疫苗接种组只有5/20.此外,接种第3剂mRNA疫苗可以产生较强的抗体中和反应,改善疫苗诱导的抗体对Omicron变异株中和活性下降的问题.接种加强针之后,疫苗免疫者血清对Omicron变异株的中和活性比之前高23倍,与接种2剂疫苗的免疫者血清对原始病毒的中和活性相当[29].101位科兴疫苗免疫者在接种加强针之前,其血清对Omicron变异株无中和作用,接种mRNA疫苗加强针之后,80%的参与者血清对Omicron变异株有部分的中和作用.虽然接种加强针的免疫者血清对Omicron变异株的中和活性与原始病毒株相比有所降低,但都表现出针对Omicron变异株的中和能力[19,27].其中,接种辉瑞疫苗加强针后,疫苗免疫者针对BA.1变异株的平均抗体滴度显著增加,从低于20增加到1 066;针对BA.2变异株的平均滴度从低于20增加到776.接种mRNA-1273疫苗加强针的结果与接种辉瑞疫苗加强针类似.文献使用人源化的仓鼠,模拟人感染病毒后的病理过程,结果显示BA.2、BA.4和BA.5变异株在支气管和肺泡都不会引起肺部病理损伤,感染这些变异株的仓鼠100%存活.此外,研究显示BA.2、BA.4和BA.5变异株在鼻和肺中复制显著低于Delta变异株,尤其是BA.4几乎不会在肺中复制,证明BA.5变异株的毒力比Delta变异株弱[30].QU等[26]的研究显示接种疫苗加强针的免疫者血清对BA.4.6、BF.7、BQ.1、BQ.1.1、(BA.4,BA.5)、BA.2.75.2、BA.2.75变异株的中和活性与含D614G突变的变异株相比显著下降.此外,感染BA.1变异株的免疫者血清对BA.4.6、BF.7、BQ.1、BQ.1.1、(BA.4,BA.5)、BA.2.75.2、BA.2.75变异株的中和活性分别显著降低,证明BA.1变异株免疫者仍有再次感染的风险.
总之,虽然Omicron变异株降低了疫苗的保护效率,但是接种加强针仍可以降低重症的住院率与死亡率,针对新的变异株开发新的疫苗加强针,可以进一步提高疫苗的保护率.6种单克隆抗体Bamlanivimab、Etesevimab、Casirivimab、Imdevimab、Tixagevimab和Regdanvimab失去对Omicron变异株的中和作用,Cilgavimab 和Adintrevimab对Omicron变异株的中和作用显著降低(约95%),只有Sotrovimab保持着良好的中和能力[20].
2 SARS-CoV-2变异株S蛋白关键氨基酸突变的生物学特性
2.1 RBD区域氨基酸突变
2.1.1K417N/T突变
K417N/T出现在Beta,Delta,Omicron,Gamma等变异株中,研究人员用假病毒模型证明,该突变轻微地降低了RBD与ACE2的结合亲和力(表2).此外,有研究显示疫苗诱导的单克隆抗体中有5/17对携带K417N突变的假病毒活性比野生型假病毒活性降低90%; 6/17对携带K417N或K417N-N501Y突变的假病毒的中和活性降低75%[31].

表2 SARS-CoV-2的S蛋白重要突变生物学特性
2.1.2L452R突变
L452R突变位于RBD区域,出现于Delta,Kappa(B.1.617.1)和Epsilon(B.1.427/9)等变异株中,该突变增加RBD-ACE2复合物的稳定性,还导致免疫逃逸,这两个因素可能增加病毒的传播能力、感染性与致病率.对SARS-CoV-2 S蛋白的分析表明,L452残基不直接接触ACE2受体,而是和F490、L492等残基在S蛋白的RBD表面形成疏水结构,L452R突变使疏水结构破坏,并与ACE2受体直接接触,导致RBD-ACE2复合物的稳定性增强.美国加利福尼亚大学的一项研究显示,携带L452R突变的假病毒进入稳定表达ACE2和跨膜丝氨酸蛋白酶(TMPRSS2)的293T细胞的效率比携带D614G突变的假病毒高6.7~22.5倍,携带L452R突变的假病毒进入稳定表达ACE2的人气管类器官的效率比携带D614G突变的假病毒高5.8~14.7倍[32].此外,研究人员发现携带L452R突变的假病毒降低恢复者血浆的中和活性,并且对单克隆抗体X593和P2B-2F6具有显著的抗性,具有L452R-E484Q双重突变的B.1.167变异株与宿主细胞受体ACE2具有更强的结合亲和力,并具有逃避体液免疫的能力[33].
2.1.3E484K突变
E484K突变位于RBM中,存在于Beta,Gamma,Eta(B.1.525),Iota(B.1.526),Theta(P.3)和Zeta(P.2)变异株中.研究表明,E484K突变不仅降低恢复者血清和mRNA疫苗免疫者血清对病毒的中和活力,还导致多个单克隆抗体完全失去治疗作用(如REGN10989、REGN10934、2-15、LY-CoV555、C121),E484K突变与K417N突变结合显著降低单克隆抗体REGN10933的中和活性[34].
2.1.4T478K突变
与B.1.617.1和B.1.617.3相比,Delta变异株缺少E484Q突变,在S蛋白中具有独特的T478K突变,对S蛋白结构进行计算机分子动力学研究预测,T478K突变会增加RBD与细胞表面ACE2的结合亲和力[35].Delta变异株含有的T478K突变与基因组中其他突变的组合似乎提供更大的适应性优势,截至2021年6月12日,B.1.617.1和B.1.617.3变异株在全球的流行率小于0.5%,而Delta变异株的流行率为2.0%.
2.1.5N501Y突变
N501Y突变出现于Alpha、Beta、Gamma和Omicron等变异株中,该突变通过增强RBD与ACE2的结合亲和力和紧密度来增加感染性.GU等[36]开发了一种小鼠模型(MASCp6)来评估SARS-CoV-2的传染性和毒力,观察到N501Y突变增加了RBD与ACE2受体的亲和力,有利于病毒进入,从而导致毒力增强.研究人员通过结构模型证明N501Y-RBD与ACE2的结合紧密度是野生病毒株的10倍,有趣的是,N501Y-RBD与ACE2的结合亲和力远高于K417N/T-E484K-N501Y-RBD.N501Y突变对疫苗免疫者血清和恢复者血清的中和活性基本无影响,显著降低部分单克隆抗体的中和作用[37].
2.1.6D614G突变
D614G突变存在于所有VOC中,研究显示,D614G突变增加RBD与ACE2的结合亲和力,具有D614G突变的病毒基因表达比野生型病毒高0.5~2.0倍,感染D614G变异株的临床样本具有高滴度的SARS-CoV-2 RNA.在病毒感染的早期阶段,具有D614G突变的病毒在仓鼠之间表现出明显更快的液滴传播,这也解释了首次出现D614G变异株之后,该变异株在几个月内成为全球主要流行株[38].以上研究结果证明,该突变导致病毒与ACE2受体的亲和力增强,也增加病毒的复制与传播能力.除此之外,研究结果表明D614G突变并不影响临床结果以及恢复期患者以及疫苗诱导的抗体活性[5].
2.2 其他区域氨基酸突变
2.2.1HV69-70del(Δ69-70)突变
HV69-70del存在于Alpha和Omicron变异株中,通常在某些可增加S蛋白与ACE2受体结合亲和力或导致免疫逃逸的突变后出现,例如N501Y,N439K,Y453F.通过假病毒模型发现,HV69-70del通过增加S1/S2切割和提高细胞与细胞膜融合的速率来增加变异株的感染性,并不影响康复者血清的中和作用.此外,体外实验表明D796H突变产生免疫逃逸但降低感染性,当D796H和HV69-70del同时出现在SARS-CoV-2变异株时,HV69-70del可以补偿由D796H突变引起的感染性降低[39].
2.2.2P681H/R突变
弗林蛋白酶切割位点位于SARS-CoV-2刺突蛋白的S1和S2亚基之间,其中包含氨基酸位点:681~685,该区域的切割是病毒进入人类宿主细胞的关键.P681H存在于Alpha、Omicron和Theta变异株中,P681R存在于Delta和Kappa变异株中.研究显示,P681H和P681R可能会增加弗林蛋白酶对S1/S2的切割,并增强病毒与宿主细胞膜的融合[40].
2.3 Omicron变异株的关键氨基酸突变
G446S与S477N突变可能降低某些单克隆抗体和恢复期血浆的中和作用,Q493R和Y505H突变可能会增强病毒与ACE2的结合亲和力并增加其感染性, H655Y和N679K突变可能有利于病毒进入宿主细胞,增强病毒的传染性和致病性,提高了其免疫逃逸能力.N460K和F486S突变增强细胞间的融合以及增加S1/S2切割来增强感染性,并似乎与恢复期血浆的中和作用降低有关[26,41-42].
3 结论与展望
病毒进化是一个持续的过程,SARS-CoV-2变异株给世界各地的医疗工作者和科学家带来了新的挑战.VOC变异株不仅可以部分或完全逃避免疫反应,损害基于单克隆抗体和恢复期血浆的治疗效果,严重影响疫苗的有效性,还会造成感染过病毒的个体再次感染.可以通过以下措施来对抗新冠疫情的大流行以及降低SARS-CoV-2变异株造成的危害:(1)在全球范围内快速大规模接种疫苗,以减少SARS-CoV-2的感染,在某些无法大规模接种疫苗的地区可以采取严格的公共卫生措施和有效的策略来阻止或减少病毒传播(例如戴口罩、勤洗手以及保持社交距离).(2)对新出现的变异株进行监测和识别,确定疫苗和中和抗体对新的变异株的有效性.高效的检测系统可以快速检测、隔离和应对新的变异株,避免不受控制的传播.(3)监测已经接种疫苗或以前感染过的个体的突破性感染,评估新的变异株潜在的免疫逃避.(4)接种加强针来增加中和抗体滴度,提高疫苗的保护力.
综上所述,伴随着新冠病毒的进化趋势,疫苗的研发工作也应随之改变:(1)开发混合疫苗,最大程度覆盖新冠病毒更新的突变株;(2)开发针对横跨冠状病毒保守抗体表位和T细胞表位的泛冠状病毒疫苗,以预防新的突变株出现;(3)开发诱导呼吸道黏膜免疫的黏膜免疫疫苗.

