灯盏花素对大鼠糖尿病视网膜水肿PKCβ 及VEGF 蛋白表达的影响
胡卓瑜,王 萱,胡 齐,刘 静,黄栊瑢,付美林,刘志敏,陈向东*
1.湖南中医药大学,湖南 长沙410208;2.湖南中医药大学第一附属医院,湖南 长沙410007;3.中医药防治眼耳鼻喉疾病湖南省重点实验室,湖南 长沙410208
糖尿病黄斑水肿(diabetic macular edema, DME)是高血糖环境下黄斑区血-视网膜屏障(blood-retinal barrier, BRB)受损所导致的。 黄斑区生成的水肿液压迫神经元,从而引起糖尿病患者视力丧失[1-2]。而视网膜水肿是由于液体聚集在视网膜组织间隙中,在液体的压力下,神经细胞变性、坏死,加重组织缺血缺氧,损伤糖尿病患者的视功能。 报道显示,糖尿病视网膜病变患者并发黄斑水肿的概率为2.7%~11%,其发病主要受糖尿病病程、血压以及糖化血红蛋白指数的影响[3]。 现阶段,欧洲视网膜专家协会指出DME 的治疗主要以激光光凝治疗、抗血管内皮生长因子(vascular endothelial growth factor, VEGF)药物治疗、激素治疗和手术治疗为主。其中,抗VEGF 药物的注射是目前的一线治疗方式,在提高视力、减轻黄斑水肿方面有效[4],但其价格昂贵、周期长、需反复注射,并且会带来肾功能异常、血栓性微血管病变的风险,使得黄斑水肿患者在寻求治疗过程中望而却步[5-6]。
糖尿病视网膜水肿的病理过程可概括为长期的糖代谢紊乱下视网膜缺血、缺氧,糖基化终末产物(advanced glycosylation end product, AGE)与糖基化终末产物受体(receptor for advanced glycation end products, RAGE)结合发挥生物效应,同时高糖环境促使二酰甘油(diacylglycerol, DAG)水平的增高,激活蛋白激酶C(protein kinases C, PKC)[7]。 其中,蛋白激酶Cβ(PKCβ)的活化被证实是糖尿病微血管病变的关键蛋白[8]。 同时,PKC 通路能改变一氧化氮生物利用度、调控血管内皮生长因子(vascular endothelial growth factor, VEGF)表达,影响血管张力和通透性,导致内皮细胞损伤[9]。另一方面,VEGF 通过增加紧密连接蛋白的磷酸化促进内皮细胞繁衍增殖,造成BRB 损伤,大大增加了血管的通透性,加快了大分子物质渗漏进入视网膜组织间,使积液聚集于视网膜内核层与外丛状层间,最终导致视网膜组织细胞间水肿[10]。
近年来,中医药在治疗糖尿病视网膜水肿中颇有成就,具有改善视网膜微循环、减轻毛细血管通透性、减少微血管瘤数量的作用,可下调VEGF 表达以保护BRB[11]。 前期研究发现,运用活血化瘀类中药可改善糖尿病视网膜病变患者眼底微循环,抑制炎症反应,以保持BRB 的完整性和稳定性,抑制新生血管的生长[12]。 具有活血化瘀功能的中药灯盏花属于菊科飞蓬属的生草本植物,首载于《滇南本草》:“灯盏花……左瘫右痪,风湿疼痛……”[13]主要应用于跌打损伤,具有活血止痛的作用。 现代药理学发现,灯盏花素是从灯盏花中提取出的黄酮类有效成分,可以增加血流量,改善微循环,扩张血管,降低血液黏度,并在治疗糖尿病心肌病、糖尿病肾病、视网膜病变等方面卓有成效[14]。 本研究通过建立链脲霉素(streptozotocin, STZ)联合高糖高脂饮食诱导SD 大鼠糖尿病模型,并结合光学相干断层成像术(optical coherence tomography, OCT)以及HE 染色检测视网膜水肿程度,对灯盏花素减轻糖尿病视网膜水肿、潜在靶点蛋白及BRB 的保护作用进行系统研究,为进一步临床实验提供依据。
1 材料
1.1 动物
SPF 级雄性SD 大鼠36 只,鼠龄8~10 周,体质量(180±20) g,由湖南中医药大学SPF 级动物中心提供。 动物分笼饲养于湖南中医药研究院动物中心实验室,饲养温度24~26 ℃,湿度50%~70%。 进行为期1 周的适应性喂养,然后将SD 大鼠随机分成正常组和造模组。 本研究实验动物及条件符合国家科学技术委员会的《实验动物管理条例》相关规定,由湖南省中医药研究院动物实验福利伦理审查委员会批准(伦理审批号:2020-0061)。
1.2 主要试剂
羟苯磺酸钙(商品名:安多明,贵州天安药业股份有限公司,批号H20010481);STZ、Tris(美国Sigma公司,批号:08E221108、V900483);灯盏花素(广州彼迪药业有限公司,批号:Z44023596);柠檬酸、柠檬酸钠(上海展云化工有限公司,批号:20201105、20210119)。HE 染色液、PBS(7.2~7.6)、枸橼酸盐缓冲液(Wellbio,批号:05A210219、11A210301、01A210302);RIPA 裂解液(中国上海碧云天生物技术有限公司,批号:P0013B);APS、吐温-20(国药集团上海有限公司,批号:10002618、30189328);SDS(中国大连美伦生物技术有限公司,批号:MB2479);TEMED(中国上海阿拉丁生化科技股份有限公司货号,批号:T105497);VEGF 抗体、PKCβ 抗体、β-actin 抗体、occludin 抗体、HRP 山羊抗鼠IgG、HRP 山羊抗兔IgG(美国蛋白技术集团公司,批号:19003-1-AP、12919-1-AP、66009-1-Ig、27260-1-AP、SA00001-1、SA00001-2);Claudin-5 抗体(赛默飞世尔科技有限公司,批号:35-3500)。
1.3 主要仪器
光学相干断层扫描仪(德国海德堡公司,型号:Spec-CAM-05529-S2000);台式冷冻离心机(中国湖南湘仪实验仪器开发有限公司,型号:H1650R);全自动酶标洗板机、多功能酶标分析仪(深圳市汇松科技发展有限公司,型号:PW-812、MB-530);电热恒温培养箱(北京市永光明医疗仪器有限公司,型号:DHP-500);电泳仪、转膜仪、电泳槽(中国北京六一生物科技有限公司,型号:DYY-6C、DYCZ-40D、DYCZ-24DN);旋涡混合器、摇床(海门市其林贝尔仪器制造有限公司,型号:GL-88B、TS-1)。
2 方法
2.1 糖尿病大鼠模型的制备
36 只SD 雄性大鼠自由饮水饮食,适应性喂养1 周后,禁食14 h 后称重编号,随机分为正常组(n=9)和造模组(n=27)。 造模组使用高脂高糖饲料(饲料为湖南中医药研究院动物实验中心提供)喂养2 周,大鼠每天摄入饲料30~40 g,控制其食量。待2 周后,空腹12 h 后称重编号, 按30 mg/kg 剂量一次性腹腔注射STZ,正常组腹腔注射等量的生理盐水。STZ腹腔注射72 h 后取尾静脉血测SD 大鼠空腹血糖,测得血糖稳定在16.7 mmol/L 并表现为多饮、多食、多尿者则为建立糖尿病大鼠模型成功[15]。若大鼠血糖<16.7 mmol/L,则追加注射等剂量STZ,从模型建立成功1 周后开始计算病程。
2.2 糖尿病视网膜水肿模型的制备与分组
自糖尿病模型造模开始时,每4 周选择1 只正常组大鼠与1 只造模组大鼠,HE 染色观察大鼠视网膜是否存在组织紊乱不均的情况,并发现视网膜厚度高于(209.78±3.62) μm 即为造模成功[16]。8 周时确认造模成功后,将糖尿病视网膜水肿大鼠随机分为模型组9 只、安多明组9只、灯盏花素组9 只。模型组大鼠给予10 mL·kg-1生理盐水灌胃。 根据人与大鼠体表面积换算,人的临床剂量换算为大鼠等效剂量灌胃安多明0.09 g·kg-1,灯盏花素组给予0.002 g/kg,按10 mL·kg-1·d-1灌胃给药,均治疗4 周。 实验过程死亡大鼠严格按照上述造模方式补齐。
2.3 指标检测
2.3.1 大鼠的一般情况 观察大鼠的饮食情况、体质量、精神状态。 造模前1 周,造模后2、4、8 周,以及用药后的1、2、4 周后的早上,称取大鼠体质量、空腹血糖并记录。
2.3.2 HE 染色观察造模前后视网膜结构变化 正常组以及模型组的大鼠分别在造模后4、8 周各处死1只,进行眼球的取材,然后进行HE 染色,具体步骤如下:蒸馏水冲洗视网膜组织10 min,PBS 返蓝;伊红染3~5 min,蒸馏水冲洗;梯度乙醇(95%~100%)脱水,60 ℃烤片1~2 h;切片脱蜡至水:二甲苯中放切片约10 min,2 次,然后依次在100%、100%、95%、85%和75%乙醇中,每级放置5 min。 再用蒸馏水浸洗5 min;苏木素染色5 min。 取出后置于二甲苯维持10 min,2 次,中性树胶封片、显微镜观察。 用药4 周后以同法对各组视网膜结构进行HE 染色。 应用同法处理造模后大鼠的肾脏组织,观察其变化。
2.3.3 OCT 观察视网膜厚度变化 造模开始之前,麻醉机吸入2 mL/L 异氯烷麻醉,符大鼠全身麻醉成功后,并用复方托吡卡胺滴眼液扩瞳,然后玻璃酸钠滴眼液滴眼,保持大鼠角膜湿润状态。 待老鼠反应迟缓后,包裹全身,暴露待检鼠眼,用OCT 对各组大鼠进行眼底检查。进行OCT 检查时测量距离视盘上方、下方、鼻侧、颞侧4 个方向2 个视盘直径(disc diameter, DD)处的视网膜厚度(视网膜内界膜至视网膜色素上皮高反射层)并记录,检查完予以盐酸左氧氟沙星眼用凝胶预防角膜干燥。 使用检测系统的自带软件手动测量视网膜厚度。于用药前(造模后8周)及用药4 周后,以同法对各组进行OCT 检查,观察视网膜厚度变化。
2.3.4 Western blot 检测VEGF、PKCβ 蛋白表达 分离眼后节视网膜组织,用PBS 洗浴1 次,制备10%分离胶及4.8%浓缩胶,取待测蛋白样本80 μL 进行凝胶电泳。用10% PAGE 负载蛋白,然后将其转移至PVDF 膜,5%脱脂牛奶进一步封闭PVDF 膜,膜与特异性一抗VEGF、PKCβ,4 ℃杂交过夜。 次日放置30 min 后,加入兔抗大鼠VEGF 一抗(1∶1 000)、兔抗大鼠PKCβ 一抗(1∶500)和小鼠抗大鼠β-actin 一抗(1∶5 000)孵育90 min,结束后用PBS 液冲洗3次。 用TBST 洗后将PVDF 膜放入装有HRP 标记的山羊抗鼠二抗(1∶5 000)、山羊抗兔二抗(1∶6 000)孵育90 min,然后用TBST 洗3 次,每次15 min。 使用ECL 化学发光液与膜孵育1 min,用滤纸吸尽液体,用塑封膜将膜包裹杂交膜,在暗盒内与X 胶片曝光5~20 min;显影冲洗。 并使用Image J 软件进行分析,蛋白表达量以目的蛋白灰度值与β-actin 灰度值的比值表示。
2.3.5 ELISA 法检测VEGF、PKCβ 含量 全麻下分离腹主动脉采血,用肝素抗凝管采血。将室温血液自然凝固10~20 min,离心约20 min(3 000 r/min),取上清液进行检测;或进行分装,并将标本放于-20 ℃或-80 ℃保存,禁止反复冻融。解冻后的样品应再次离心,然后依据试剂盒步骤检测VEGF、PCKβ 的表达量。
2.3.6 免疫组织化学检测claudin-5、occludin 蛋白表达水平 采用两步法,眼球组织标本(取3 只大鼠标本)石蜡包埋,制成4 μm 常规切片,脱蜡及梯度脱水后,经3%过氧化氢阻断内源性过氧化物酶活性,高压修复抗原后,滴加兔抗鼠occludin、小鼠抗大鼠claudin-5 抗体(稀释浓度分别为1∶100、1∶100)置于湿盒,4 ℃冰箱过夜。 次日复温后滴加抗-兔、兔-IgG 抗体-HRP 多聚体,于37 ℃温箱孵育30 min。 经DAB 显色,苏木素复染,二甲苯透明封片。 所有切片用滨松Nano Zoomer 2.0RS 扫描成像,每个切片图像400 倍放大后截取3 个视野,采用IPP 6.0 进行图像分析,分析结果为总光密度,取平均值为蛋白表达强度。
2.4 统计学分析
采用SPSS 21.0 统计学软件进行统计处理,两组进行比较,满足正态分布及方差齐性,采用独立样本t 检验;否则采用秩和检验。多组数据进行比较时,满足正态分布及方差齐性,采用方差分析;否则采用Kruskal-Wallis 检验。 P<0.05 为差异有统计学意义,P<0.01 为差异有显著统计学意义。
3 结果
3.1 一般情况变化
注射STZ 后,模型组、安多明组及灯盏花素组的大鼠大鼠体质量增长缓慢,并有体质量下降趋势。在造模后2、4、8 周以及给药后1、2、4 周,与空白组对比,模型组、安多明组、灯盏花素组体质量增长较慢(P<0.01);在给药后1 周,与模型组对比,安多明组体质量增长较少(P<0.05);在给药后2 周,与安多明组对比,灯盏花素组体质量增长较多(P<0.01);在给药后4 周,与模型组、安多明组对比,灯盏花素组体质量增长较多(P<0.01)(图1)。 注射STZ 后,与空白组对比,其他组大鼠血糖>16.7 mmol/L(图2)。在造模后2、4、8 周以及给药后1、2、4 周,与正常组对比,模型组、安多明组、灯盏花素组血糖显著升高(P<0.01)。在给药后2 周,与模型组对比,灯盏花组血糖降低(P<0.05)(图2)。
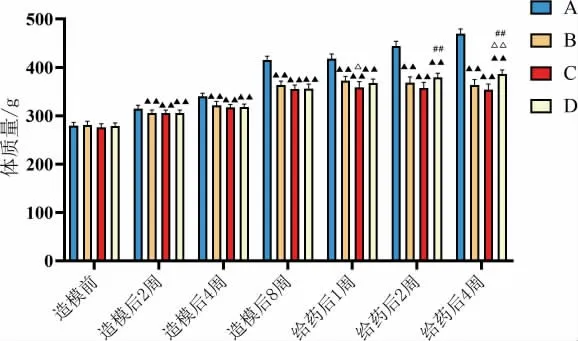
图1 大鼠体质量变化图(±s,n=9)
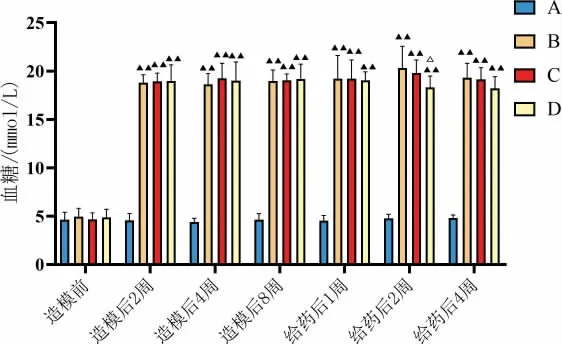
图2 大鼠血糖浓度变化图(±s,n=9)
3.2 视网膜形态组织学改变
4 周后正常组大鼠视网膜层间结构清晰,排列整齐致密(图3A);而造模4 周后造模组视网膜结构较为疏松(图3B);造模8 周后造模组细胞排列紊乱,可见明显疏松,数目减少,内界膜、神经纤维层、内外核状层肿胀,细胞呈空泡样改变(图3D);而正常组未见明显的异常(图3C)。
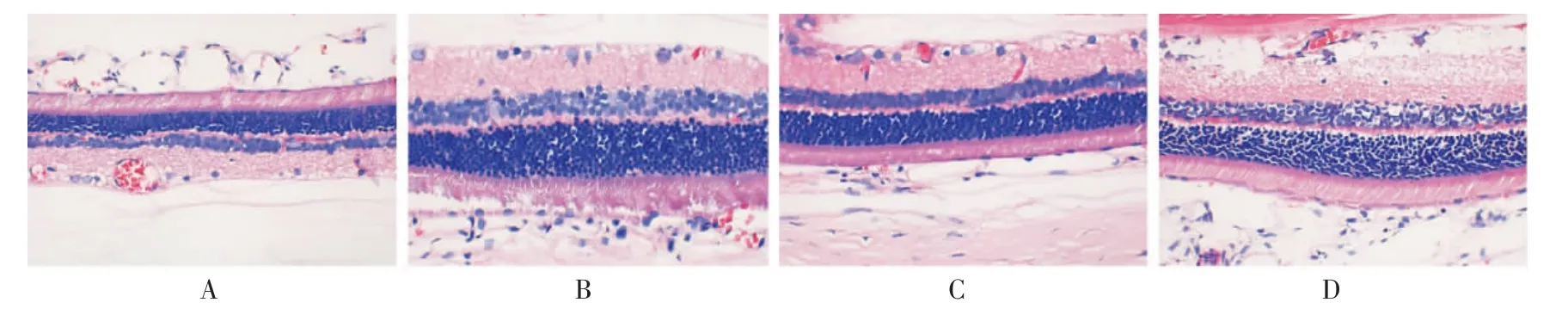
图3 造模后正常组与造模组的HE 染色图(×400)
用药4 周后,与正常组对比,模型组可见视网膜神经节细胞呈空泡样改变,内丛状层、外丛状层排列紊乱,内核层、外核层细胞密度减少,排列疏松(图4B)。 安多明组视网膜神经节细胞仍呈空泡样改变,内核层、外核层的水肿未见明显改变(图4C)。 灯盏花素组视网膜结构较安多明组紧密,层间水肿不明显,层次结构清晰(图4D)。

图4 用药4 周后各组的HE 染色图(×400)
3.3 各组视网膜厚度变化
给药前,与正常组对比,模型组视网膜厚度增加(P<0.01),表明出现视网膜水肿(图5A)。给药后,安多明组、灯盏花素组与模型组对比,视网膜厚度均下降(P<0.01)(图5B2—4)。 给药4 周后,灯盏花素组大鼠视网膜厚度接近于正常水平(表1)。 由于后期部分大鼠出现白内障或屈光间质不清,故OCT 检查成像模糊或窥不清。
表1 各组大鼠给药前后视网膜厚度比较(±s,μm)

表1 各组大鼠给药前后视网膜厚度比较(±s,μm)
注:与正常组比较,▲▲P<0.01;与模型组比较,△△P<0.01。
组别正常组模型组安多明组灯盏花素组F 值P 值n9999给药前198±3.53 218.33±2.58▲▲219.77±4.94▲▲218.67±2.71▲▲61.701 P<0.01给药后200.89±3.00 220.44±4.47▲▲213.11±4.63▲▲△△209.78±3.08▲▲△△35.11 P<0.01

图5 用药前后视网膜厚度OCT 对比
3.4 Western blot 检测视网膜PKCβ、VEGF 的表达情况
与正常组对比,模型组、安多明组视网膜组织中PKCβ、VEGF 水平显著升高(P<0.01);与模型组相比,安多明组、灯盏花素组的PKCβ、VEGF 水平显著降低(P<0.05,P<0.01),其中安多明组PKCβ 差异有统计学意义(P<0.05),安多明组VEGF 水平和灯盏花素组的PKCβ、VEGF 水平差异具有显著统计学意义(P<0.01);与安多明组相比,灯盏花素组PKCβ 水平下降(P<0.05)。 详见图6。

图6 各组视网膜组织PKCβ、VEGF 的表达情况(±s)
3.5 ELISA 检测血清PKCβ、VEGF 的表达情况
与正常组对比,模型组、安多明组、灯盏花素组血清中PKCβ、VEGF 水平显著升高(P<0.01);与模型组相比,安多明组、灯盏花素组的PKCβ、VEGF 水平显著降低(P<0.01);与安多明组相比,灯盏花素组PKCβ、VEGF 水平下降(P<0.05)。 详见图7。

图7 各组血清PKCβ、VEGF 的表达情况(±s)
3.6 免疫组织化学法检测视网膜claudin-5、occludin 的表达情况
给药4 周后,模型组的组内界膜、色素上皮层、内外丛状层细胞胞浆中claudin-5 的染色较浅,且视网膜组织排列紊乱,结构稀疏,安多明组染色与模型组相比相对较深。 灯盏花素组的视网膜组织claudin-5、occludin 表达呈阳性,排列相对整齐,结构致密。与正常组对比,模型组、安多明组及灯盏花素组视网膜组织中claudin-5、occludin 水平显著降低(P<0.01);与模型组相比,安多明组的claudin-5、occludin水平升高(P<0.05)。 与模型组对比,灯盏花素组的occludin 水平显著升高(P<0.01),claudin-5 水平升高(P<0.05)。 详见图8 和表2。
表2 各组大鼠视网膜claudin-5、occludin 的表达情况(±s)

表2 各组大鼠视网膜claudin-5、occludin 的表达情况(±s)
注:与正常组比较,▲▲P<0.01;与模型组比较,△P<0.05,△△P<0.01;与安多明组比较,#P<0.05。
组别正常组模型组安多明组灯盏花素组F 值P 值n3333 claudin-5 0.027 5±0.003 4 0.009 1±0.000 7▲▲#0.014 1±0.001 0▲▲△0.014 1±0.001 7▲▲△69.62<0.01 occludin 0.149 5±0.008 0 0.052 0±0.002 0▲▲0.088 8±0.021 4▲▲△0.102 0±0.014 2▲▲△△32.45<0.01
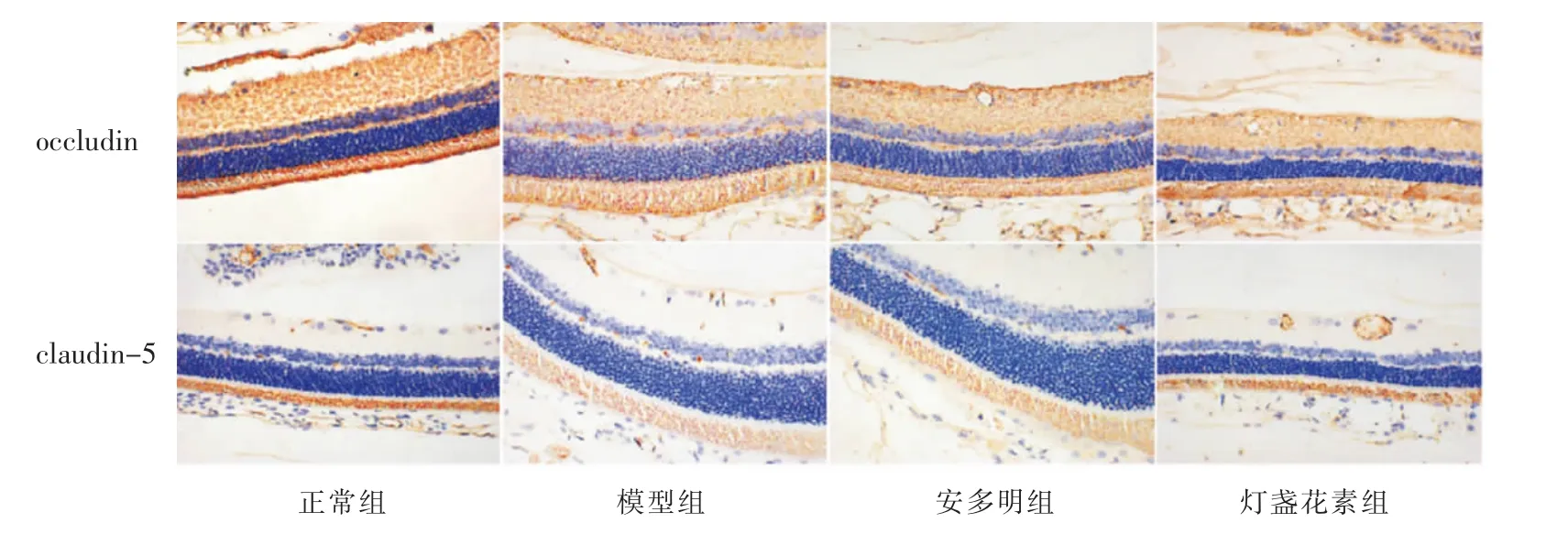
图8 各组大鼠视网膜claudin-5 与occludin 的表达情况
4 讨论
在糖尿病视网膜病变发展过程中由于血管通透性的改变,液体聚集在有限空间内,使得视网膜外丛状层形成囊样改变,导致黄斑水肿的发生。 DME 的发生机制尚未阐明,其本质是视网膜毛细血管内皮细胞受损,内皮细胞通透性增大,使得血-视网膜屏障功能破坏,涉及氧化应激、炎性因子及VEGF 的积累,从而加重黄斑区水肿[17-18]。 PKC 是VEGF 促进血管形成的信号转导分子,可增加血管内皮细胞通透性,改变视网膜血管血流状态。 当机体处于糖代谢紊乱情况,视网膜血管组织的DAG 水平升高,从而激活PKC 及下游多条通路,改变血管通透性、促进血管生成及细胞因子反应[19];AGE 与RAGE 受体相互作用可激活PKC[20];活性氧激活PARP 并与己糖胺和PKC 通路共同作用,促进氧化应激反应,诱发慢性炎症损害[21]。研究表明,PKC 参与细胞生长与分化相关的基因表达的调控,在DME 的发展过程中发挥重要作用,PKCβ 抑制剂的应用能有效降低患者致盲率,缓解视网膜水肿[22-23],因此,PKCβ 抑制剂广泛应用于治疗糖尿病诱发的黄斑及视网膜水肿。
VEGF 是最强的促血管生长因子,其表达水平与微血管形成数呈正相关,广泛存在于玻璃体、视网膜中,正常情况下,促进血管生成因子与抑制血管生成因子相互协调,使机体达到平衡状态[24]。若个体长期处于糖代谢紊乱状态,正常的机体功能受损后激活PKC,活化的PKC 介导VEGF 生成,促使血管生成因子占据主导地位,抑制紧密连接的表达[25-26]。 生长因子会介导血管通透性增大,紧密连接结构变得紊乱无序,因此,VEGF 是破坏BRB 的重要介质,具诱发视网膜水肿、血管渗漏的元凶[27]。
BRB 正常功能的发挥主要依赖于紧密连接蛋白的完整性,claudin-5、occludin 及ZO-1 是3 种研究最为广泛的紧密连接蛋白。 其中occludin 及claudin为跨膜蛋白,同时具有胞内环和胞外环,胞外环通过“拉链”状形式连接细胞并产生细胞旁封闭,与胞内ZO 蛋白共同形成紧密连接,参与维持和调节极性细胞的屏障功能[28]。 而STZ 诱导下会使得糖尿病大鼠视网膜claudin-5、occludin、ZO-1 蛋白减少,微血管通透性增大,破坏BRB 的屏障功能[15,29]。实验研究表明,玻璃体腔注射VEGF 抑制剂能有效抑制claudin-5、occludin 的表达下调,保护SD 大鼠的BRB功能[30]。可见,糖尿病视网膜水肿的发生可能与高糖环境下激活PKC 信号通路相关,活化的PKC 介导VEGF 上调,VEGF 磷酸化紧密连接蛋白进一步破坏BRB,通过阻断PKC 的激活可以减少水肿的发生。
临床研究与实验研究显示,灯盏花素具有较强的抗新生血管的作用,能有效增加血流量,扩张血管,降低血液黏度,抑制血小板聚集和血栓形成[31],同时也扮演着PKC 抑制剂的重要角色[32],为糖尿病微血管病变的治疗开辟新思路。 灯盏花素能调控人视网膜色素上皮细胞VEGF 及其受体VEGFR2 下游相关蛋白,阻止丝裂原活化蛋白激酶通路的激活[33],通过抑制p-ERK、p-FAK 和p-Src 蛋白的表达[34],发挥抑制新生血管的作用,阻止糖尿病视网膜病变进一步发展,减少黄斑水肿、出血、渗出的风险。
本研究通过STZ 联合高糖高脂饲料诱导DM大鼠模型,并于造模后4、8 周联合OCT、HE 染色观察视网膜水肿的情况,用药后观察灯盏花素对STZ诱导糖尿病视网膜水肿大鼠视网膜组织的影响。 本实验结果显示,与模型组对比,用药后视网膜组织以及血清中VEGF、PKCβ 的表达量不同程度下降,视网膜组织中occludin、claudin-5 水平上调,视网膜水肿得到不同程度缓解,以灯盏花素组最为明显,说明灯盏花素可能通过下调VEGF、PKCβ 的表达水平,同时上调claudin-5、occludin 的表达以保护BBB。
综上所述,灯盏花素可以通过影响VEGF、PKCβ的表达量以抑制新生血管的形成,保护BBB,改善视网膜水肿。 灯盏花素可增加微循环,改善血管通透性,调整PKCβ、VEGF 与紧密连接相关蛋白的平衡,是灯盏花素治疗糖尿病视网膜水肿的作用机制之一,这对于今后深入研究糖尿病视网膜水肿打下坚实的基础。 本实验对象仅限于动物,而且关于糖尿病视网膜水肿的生成因素只考虑了PKC-VEGF通路的某些蛋白,实际上其发病机制繁杂,涉及多种通路及细胞因子,是多种因素相互作用的结果。灯盏花素对STZ 诱导的视网膜水肿及VEGF、PKCβ蛋白的调控具体机制亟待进一步深入研究。

