祛风明目丸对实验性自身免疫性葡萄膜炎大鼠NLRP3、ASC、IL-1β 表达的影响
刘溪源,喻京生*
1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007
全球范围内常见的一类高致盲眼病——葡萄膜炎,发病率为17/10 万~52/10 万,致盲率较高,发病率逐年上升[1]。 常见病因包括感染与非感染因素,其中,非感染因素包括自身免疫反应、创伤及理化、氧化损伤、炎症因子释放、遗传因素等,临床大多以自身免疫反应多见[2-5]。 葡萄膜炎的治则主要为散大瞳孔防止粘连、抗炎及消除致病因素,目前,临床常采用中西医结合疗法防治葡萄膜炎,具有较好疗效。中医药虽有确切疗效,但对具体的治疗机制缺乏详细阐述。 本研究团队的前期研究发现,祛风明目丸能够通过多种途径调节机体自身免疫机制,减轻实验性自身免疫性葡萄膜炎(experimental autoimmune uveitis, EAU)大鼠的炎症反应[6-9];有研究证实,祛风明目丸治疗EAU 大鼠是通过上调视网膜组织中Bcl-2 的表达,并抑制Bax、Caspase-3,调节细胞凋亡途径而发挥疗效[10]。 本研究拟通过观察EAU 动物模型中房水及视网膜组织中NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)、蛋白凋亡相关斑点样蛋白(apoptosis related spot like protein, ASC)、白细胞介素-1β(interleukin-1β, IL-1β)的动态变化情况,从细胞凋亡途径,深入研究祛风明目丸治疗EAU 的效果与机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 70 只纯系健康雄性Lewis 大鼠(SPF 级),4~6 周龄,大鼠体质量180~220 g,由北京维通利华实验动物技术有限公司提供[动物生产许可证号:SCXK(京)2021-0006]。 实验开始前,对70只大鼠双眼进行常规检查以排除眼部病变及全身疾病,剔除患鼠,后进行为期1 周的喂养使其适应环境。 实验室为SPF 级,实验室环境保障:维持室温(24±2) ℃、相对湿度50%~60%、通风情况良好。 所有大鼠均予以常规饲料及动物饮用水喂养。 本实验研究方案及过程均严格遵守湖南省实验动物管理办法,并按相关伦理要求执行(湖南中医药大学第一附属医院伦理委员会审批号:ZYFY20211104-05)。
1.1.2 实验药物 祛风明目丸由熟地黄、当归、川芎、柴胡、鱼腥草、黄芩、菊花、防风、车前子、白芍、丹参构成,每瓶120 g,于湖南中医药大学第一附属医院(批号:20220304)购进。需要时用粉碎机将药丸打粉,用蒸馏水溶散成质量分数为100 mg/mL 的悬浊液。
1.1.3 主要试剂 光感受器间维生素A 结合蛋白(interphotoreceptor retinoid-binding protein, IRBP 1177-1191)、结核菌素(tuberculin, TB)(上海生工生物工程股份有限公司,批号:P25801-22070401、24761);完全弗氏佐剂(complete Freund's adjuvant, CFA)(美国Sigma 公司,批号:SLCJ4384);PBS 缓冲液(普诺赛公司,批号:WH0021A061);ASC 抗体、NLRP3 抗体、β-actin 抗体、羊抗兔IgG-HRP(Affinity 公司,批号:DF6034、DF7438、T0021、BL003A);大鼠隐热蛋白3(NLRP3)ELISA 检测试剂盒、大鼠白细胞介素1β(IL-1β)ELISA 检测试剂盒(厦门仑昌硕生物科技有限公司,批号:YD-34924、YD-30206)。
1.1.4 主要实验仪器 酶标分析仪(美国Rayto 公司,型号:RaytoRT-6100);电泳仪(北京百晶生物技术有限公司,型号:BG-subMIDI);电热恒温水浴槽(上海一恒恒温设备厂,型号:HWS-24);PVDF 膜(美国Millipore 公司,型号:ISEQ00010);低温离心机(德国Sigma 公司,型号:3-30k);脱色摇床(海门其林贝尔仪器制造公司,型号:TS-100);凝胶成像系统(美国UVP 公司,型号:GelDoc-It310);化学发光成像系统(中国CLINX 勤翔,型号:chemiScope6100);全自动洗板机(雷杜生命科技有限公司,型号:RT-3100C);酶标检测仪(Bio TeK,型号:Epoch);台式高速冷冻离心机(大龙兴创实验仪器有限公司,型号:D3024R)。
1.2 造模方法
1.2.1 试剂准备 根据造模需求,对IRBP1177-1191和TB 分别进行精确称量:100 μg/只;将CFA(150 μL/只)和PBS 缓冲液(150 μL/只)准确地加入并充分混合到5 mL EP 管中,直至乳糜状(滴入水中成团状不散开)。
1.2.2 造模 根据随机数字表法取19 只Lewis 大鼠为空白组,剩余51 只为造模组,参照文献方法[11-13]:在造模组大鼠后腿内两足底皮下注射混合好的乳糜液,每只100 μL,建立大鼠EAU 模型;空白组大鼠注射等量不含IRBP 的乳糜液于相同部位。连续4 d每天重复以上操作1 次,共对51 只大鼠进行动物模型制作。
1.2.3 模型验证 每天同时段,使用便携式手持裂隙灯,观察各组大鼠眼部表现变化,当Lewis 大鼠出现睫状血管充血明显,角结膜水肿,前房渗出,虹膜血管扩张、纹理消失,对光反射迟钝或消失、瞳孔粘连或膜闭等眼前节炎症表现,则说明EAU 模型成功建立。 参照表1 Caspi 0~4 分的标准[13],对大鼠眼前节表现进行炎症评分。 造模后第7 天,从空白组和造模组大鼠中各随机抽取3 只处死,取眼球组织制作病理切片,HE 染色后进行组织病理学检查并进行炎症评分。
1.3 实验分组及干预
HE 染色后,依照随机数字表法,将造模成功的48 只大鼠分为3 组:模型组、祛风明目丸正常剂量组(简称正常剂量组)和祛风明目丸低剂量组(简称低剂量组),每组16 只,未注射IRBP乳糜液的16 只为空白组。
于造模后第7 天开始灌胃。 将提纯的药物按照人-动物体表面积等效剂量比值表[14]计算得出的结果给药。根据计算得出正常剂量组及低剂量组分别予以祛风明目丸药液4、2 g/(kg·d)灌胃,使用大鼠专用灌胃针头,连续14 d 灌胃给药;另两组均予以等容量蒸馏水,每天1 次灌胃处理。干预14 d 后,在显微操作下取眼球、房水及视网膜组织,进行指标检测。
1.4 观察指标和方法
1.4.1 EAU 大鼠眼前节改变观察 自造模开始后每天于同时段,采用Caspi 临床分级评分标准,使用便携式手持裂隙灯显微镜观察各组大鼠的眼前节体征变化,进行评分并记录。
1.4.2 组织病理学检查 自造模后第7 天随机抽取6 只大鼠处死(空白组和造模组大鼠中各3 只),腹腔注射麻醉后,静待大鼠逃避等运动反射消失,将大鼠眼球摘除,放入1.5 mL 离心管中,浸泡于4%多聚甲醛中性缓冲液中固定24 h 后去除多余组织,脱水浸蜡,包埋,予以HE 染色。 显微镜下进行观察并拍照,对病理切片进行组织病理学检查。
1.4.3 ELISA 检测房水中NLRP3、IL-1β 水平 给药14 d 后,大鼠予以10%水合氯醛经腹腔麻醉,在手术显微镜下将针头轻轻刺入前房,房水自动吸入毛细管中,收集房水于无菌EP 管中,立即转移至-80 ℃超低温冰箱冷冻保存。 参照ELISA 试剂盒说明书的要求,对获得的房水标本,进行规范操作,利用酶标仪检测各组大鼠房水中NLRP3、IL-1β 表达水平。
1.4.4 Western blot 检测视网膜组织中ASC、NLRP3蛋白水平 大鼠取出房水后,随即充分暴露大鼠眼球,将周围结缔组织分离后剪断视神经,取出眼球。参考MCMENAMIN 的方法[15],在显微镜下使用显微剪沿角巩膜缘剪开,并仔细分离其他组织。 将剥离的视网膜组织小心地放入1.5 mL 离心管中,并立即存放至-80 ℃冰箱。 检验时, 加入适量液氮与PBS后离心提取蛋白质,制备BCA 工作液,测定蛋白质浓度,加入相应体积的总蛋白样品与5×蛋白质凝胶电泳上样缓冲液混合, 进行SDS-PAGE 电泳,后在PVDF 膜上转印;依次加入兔抗鼠NLRP3(1∶500)、ASC(1∶500)、β-actin(1∶1 000)一抗4 ℃反应过夜孵育,洗膜后将羊抗兔IgG-HRP 二抗用1×TBST 稀释1 500 倍,室温、避光环境中缓慢摇动60 min 后洗膜,按1∶1(V/V)混合ECL 试剂盒中两种液体后,均匀铺在PVDF 膜表面4 min,随后抖除膜上液体,放入化学发光成像系统中成像,对蛋白条带行灰度分析,蛋白相对表达量用目的蛋白与β-actin 灰度值比值表示。
1.5 统计学方法
2 结果
2.1 EAU 大鼠眼前节变化
造模后连续使用手持裂隙灯观察大鼠眼前节变化,造模第1 天:大鼠眼前节无明显炎症反应,眼部情况基本如图1A;造模第3 天:观察到炎症反应,睫状充血,虹膜血管轻度扩张,48 只大鼠如图1B,2 只大鼠如图1A,1 只出现图1C;造模第5 天:观察到葡萄膜炎反应,多数大鼠睫状充血明显,虹膜血管中度扩张、迂曲,部分出现前房轻度混浊,瞳孔欠圆,对光反射稍迟钝,眼底红光反射减弱,29 只大鼠如图1C,22 只如图1B;造模第7 天:多数体征同前,部分大鼠出现前房积脓、瞳孔膜闭,视网膜红光反射减弱或消失,46 只大鼠如图1C,4 只如图1D。

图1 造模后不同时间大鼠眼前节表现对比
自造模第3 天起,造模组评分均明显高于空白组(P<0.01),说明EAU 大鼠模型制备成功。 详见表2。
表2 造模后不同时间Caspi 临床分级评分比较(±s,分)
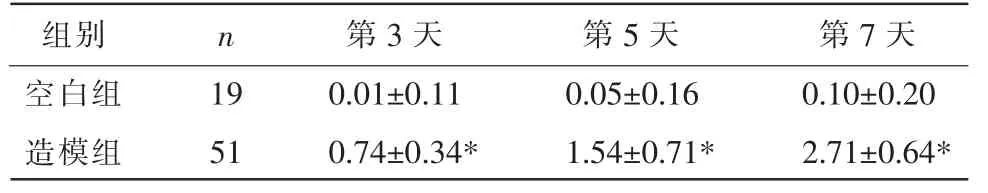
表2 造模后不同时间Caspi 临床分级评分比较(±s,分)
注:与空白组相比,*P<0.01。
组别空白组造模组n 19 51第3 天0.01±0.11 0.74±0.34*第5 天0.05±0.16 1.54±0.71*第7 天0.10±0.20 2.71±0.64*
2.2 组织病理学检查
造模后第7 天,空白组可见视网膜各层组织结构清晰完整;造模组可见视网膜的视细胞层、双极细胞层等有炎症细胞的浸润,血管扩张,且组织结构较空白组欠清晰。 详见图2。
造模第7 天,裂隙灯显微镜下观察大鼠眼前节改变,可见大部分大鼠房水中度混浊,少数大鼠前房重度混浊,瞳孔膜闭,视网膜红光反射消失。 炎症评分为(2.71±0.64)分,HE 染色显示,免疫后第7 天造模组大鼠视网膜多层出现不同程度的炎症细胞浸润。 以上表明,免疫后第7 天,EAU 大鼠模型建立成功。
2.3 祛风明目丸对房水中NLRP3、IL-1β 水平的影响
与空白组对比,模型组房水中NLRP3 及IL-1β水平均明显升高(P<0.05);与模型组相比,给药14 d后,正常剂量组及低剂量组房水中NLRP3 与IL-1β含量均降低(P<0.05);正常剂量组与低剂量组差异无统计学意义(P>0.05)。 详见表3。
表3 各组大鼠给药后14 d 房水中NLRP3、IL-1β水平比较(±s,ng/mL)
注:与空白组相比,*P<0.05;与模型组相比,#P<0.05。
组别空白组模型组正常剂量组低剂量组n 16 16 16 16 NLRP3 10.34±1.51 17.86±2.30*14.13±2.07#13.93±1.38#IL-1β 13.31±3.12 27.66±3.56*20.90±3.48#22.28±3.60#
2.4 祛风明目丸对视网膜组织中ASC、NLRP3 蛋白水平的影响
与空白组相比,模型组视网膜组织中ASC、NLRP3 蛋白表达水平升高(P<0.05);与模型组相比,给药14 d 后,正常剂量组及低剂量组视网膜组织中ASC、NLRP3 蛋白表达含量均下降(P<0.05);与正常剂量组相比,低剂量组视网膜组织ASC、NLRP3蛋白表达水平升高(P<0.05)。 见表4、图3。

图3 祛风明目丸对视网膜中ASC、NLRP3 蛋白水平影响(±s,n=16)
表4 各组大鼠给药后14 d 视网膜中ASC、NLRP3蛋白水平比较(±s)

表4 各组大鼠给药后14 d 视网膜中ASC、NLRP3蛋白水平比较(±s)
注:与空白组相比,*P<0.05;与模型组相比,#P<0.05;与正常剂量组相比,+P<0.05
组别空白组模型组正常剂量组低剂量组n 16 16 16 16 ASC 0.32±0.02 0.68±0.02*0.53±0.01#0.61±0.01#+NLRP3 0.32±0.01 0.69±0.01*0.53±0.01#0.63±0.01#+
3 讨论
葡萄膜炎在临床上的治疗较为棘手,近几年针对葡萄膜炎的中西医结合治疗手段较多。 临床研究表明,配合中医治疗能减轻治疗药物带来的毒副作用,临床疗效良好,运用中医药辨证施治及多靶点整体调节的特点既能保证疗效,又能降低疾病复发率[16-18],但是具体的治疗机制缺乏详细阐述。 葡萄膜炎属于中医学“瞳神紧小”范畴,历代医家多将其发病归于肝胆的风热、湿热[19]。祛风明目丸是喻京生教授根据“除风益损汤”加减所制的中成药,临床中多因风热上扰,气血受损导致本病,治以祛风清热、养血活血,常用熟地黄、当归、柴胡、菊花、防风、鱼腥草等中药。 叶天士言:“目盲无所见,在肝经之风也。”柴胡、当归、菊花等药物均入肝经,上连目系,肝气通于目,柴胡退六经邪热往来,与黄芩一升一降,防风治风通用、除上焦风邪,入肝,甘温发散;配合菊花、鱼腥草祛风清热。 瞳神之处脉络较多,虚火上炎损伤脉络,故配伍熟地黄、当归、白芍等药养血活血。现代药理研究表明,柴胡、菊花、黄芩具有解热、镇痛、抗炎、抗菌作用,熟地黄、川芎、鱼腥草此类中药还具有双向免疫调节功效[20-21]。
大部分EAU 与自身免疫性应答关系密切[22-23],其发病与体内免疫系统的激活及多种细胞因子及信号通路的异常表达致细胞凋亡关系密切[24-26]。 活性氧(reactive oxygen species, ROS)的产生与清除平衡维持着机体正常的生理功能,且作为信号分子参与调节细胞内多种信号通路和免疫应答[27]。 ROSNLRP3 通路作为诱导和调节细胞凋亡的一条重要通路,当ROS 水平升高时,与硫氧还蛋白互作蛋白(thioredoxin interacting protein, TXNIP)发生反应,NLRP3炎症小体被激活[28]。 在ROS 的诱导下,TXNIP 与核心蛋白NLRP3 结合,结合后可引起内皮细胞炎症小体受激活化,再激活Toll 样受体通道,引起一系列炎症反应发生。
NLRP3 炎症小体是一种多蛋白复合体,具有高度保守性,包括核心蛋白NLRP3、效应蛋白pro-Caspase-1 以及接头蛋白ASC,是固有免疫系统的一大重要组成部分,属于模式识别受体,IL-1β、IL-18 为其下游炎症小体[29-30]。 核心蛋白NLRP3 响应微生物感染和细胞损伤后,介导Caspase-1 的激活及促炎因子IL-1β、IL-18 的分泌。有研究表明,免疫性葡萄膜炎(autoimmune uveith, AU)的发生发展与NL RP3 炎症小体密不可分,部分AU 患者的外周静脉血有NLRP3 的表达[31]。 另外,研究发现使小鼠体内的NLRP3 基因突变后,小鼠自身炎症反应明显减弱[32]。上述研究均证实,ROS-NLRP3 通路可引发一系列炎症反应。
目前,公认的研究人类AU 发病机制及药物治疗的动物模型为使用视网膜蛋白IRBP 诱导Lewis大鼠EAU 模型[33]。 本实验通过构建EAU 大鼠模型发现,造模第7 天,结合裂隙灯观察到的大鼠眼部体征与眼球HE 染色结果,提示造模成功。模型组大鼠房水中IL-1β 与NLRP3、视网膜组织中NLRP3与ASC 的表达均较空白组大鼠增加,经祛风明目丸治疗后,通过手持裂隙灯观察大鼠眼前节炎症变化,以及检测房水和视网膜中ROS 通路相关蛋白的表达量,均证实祛风明目丸的治疗发挥了一定疗效。 本病的消退与IL-1β 及NLRP3 两者的表达相关,通过影响IL-1β 及NLRP3 的平衡,使促炎因子与抑炎因子两者之间的平衡失调。 与空白组相比,模型组NLRP3、ASC、IL-1β 表达增加(P<0.05),正常剂量组与低剂量组同模型组相比,表达均减少(P<0.05)。正常剂量组及低剂量组均可有效减轻EAU 大鼠葡萄膜炎的炎症表现。
综上,本研究结果显示,祛风明目丸可通过多种途径在EAU 的治疗中发挥免疫调节作用。经祛风明目丸干预后,EAU 大鼠房水中NLRP3、IL-1β 水平及视网膜组织中ASC、NLRP3 蛋白水平降低,这表明祛风明目丸可能是通过下调ROS、ASC 的表达,抑制NLRP3 炎性小体的激活,然后抑制炎症因子如IL-1β 的分泌,进而发挥治疗葡萄膜炎的作用。但是本研究仅证实祛风明目丸对EAU 大鼠ROS 信号通路相关蛋白的影响,但ROS 信号通路相关蛋白复杂多样,且实验设计中未加入任何一种蛋白的有关抑制剂或激动剂,不能完全证实祛风明目丸是完全针对ROS 信号通路而发挥具体的作用,且ROS/NLRP3通路还涉及如细胞焦亡、线粒体自噬等多个机制,还需进行更深层次的研究,为本项目组开展进一步实验提供思路。

