胎龄<34周早产儿一氧化氮吸入的研究进展
梁国宝 综述 林新祝 审校
(厦门大学附属妇女儿童医院/厦门市妇幼保健院新生儿科/厦门市围产-新生儿感染重点实验室,福建厦门 361001)
一氧化氮(nitric oxide, NO)是由血管内皮衍生的一种血管舒张因子,能选择性扩张肺血管,降低肺动脉压力,增加肺血流,改善通气-血流比例[1]。20世纪90年代,吸入一氧化氮(inhaled nitric oxide,iNO)开始用于危重新生儿呼吸疾病的救治,现已在足月儿和晚期早产儿低氧性呼吸衰竭(hypoxic respiratory failure, HRF)和新生儿持续肺动脉高压(persistent pulmonary hypertension of the newborn, PPHN)的治疗中得到广泛应用[2-4]。1999年美国食品药品监督管理局批准iNO用于治疗除先天性膈疝外的足月儿和晚期早产儿HRF,可以减少对体外膜肺的需求,且不造成远期的神经系统损害[4-5]。目前研究表明,iNO用于胎龄(gestational age, GA)<34周早产儿的有效性和安全性依据不足,故国内外指南尚不推荐,但近年来,iNO用于GA<34周早产儿的超适应证治疗却呈上升趋势。本文就iNO治疗GA<34周早产儿的有效性、安全性、时机、剂量、撤离方案和与血管活性药物联合使用的国内外研究进展作一综述,以期为临床应用提供参考。
1 GA<34周早产儿iNO使用的现状
自20世纪90年代起,美国、欧洲、中国等先后批准或推荐iNO用于GA>34周晚期早产儿和足月儿HRF或PPHN的治疗[6]。由于iNO对GA<34周的早产儿肺部、生存率及远期神经系统发育的影响尚不确定,且担心iNO在早产儿中的不良反应,美国国立卫生研究院和美国儿科学会均不推荐GA<34周早产儿常规应用iNO治疗[7-8]。虽然iNO在GA<34周早产儿使用的安全性和有效性尚未得到充分证实,但近年来早产儿iNO超适应证试验性治疗不断增加[9-10]。美国、日本、英格兰等国家和地区的研究表明,iNO在GA<34周早产儿的使用率呈上升趋势,尤其是在超早产儿中增加更为显著[11-13],见图1。目前我国缺乏iNO治疗GA<34周早产儿的多中心临床研究报道,也无GA<34周早产儿iNO使用现状的数据。

图1 各国早产儿iNO的使用率
2 iNO在GA<34周早产儿中使用的有效性
现有多项研究结果显示,iNO可以快速改善早产儿氧合,提高生存率,已被视为重症肺动脉高压合并急性HRF早产儿的一种营救性治疗方法[14-17]。2019年日本一项调查超早产儿iNO的研究发现,超声心动图证实存在肺动脉高压的超早产儿,应用iNO的病死率低于GA>28周的早产儿,提出在这种情况下,应用iNO是一种有效的早期营救性措施[18]。但是,2010年美国国立卫生研究院发表一项声明,在患有呼吸窘迫综合征(respiratory distress syndrome, RDS)需要机械通气支持且有PPHN的早产儿中,iNO治疗的有效性应进一步评估[7]。Dani等[19]回顾性研究42例GA<30周、出生体重(birth weight, BW)<1 250 g、患有HRF的早产儿,发现PPHN是患有严重RDS极早产儿的常见并发症,且在iNO治疗后,合并PPHN的早产儿比非PPHN早产儿氧合改善更快。因此,提出对于RDS合并PPHN的早产儿iNO疗法应该仔细评估。但现有研究对于iNO治疗早产儿有效性的评估标准不一致[19-23],见表1,还需高质量临床试验研究来进一步探索,以达成共识指导临床实践。
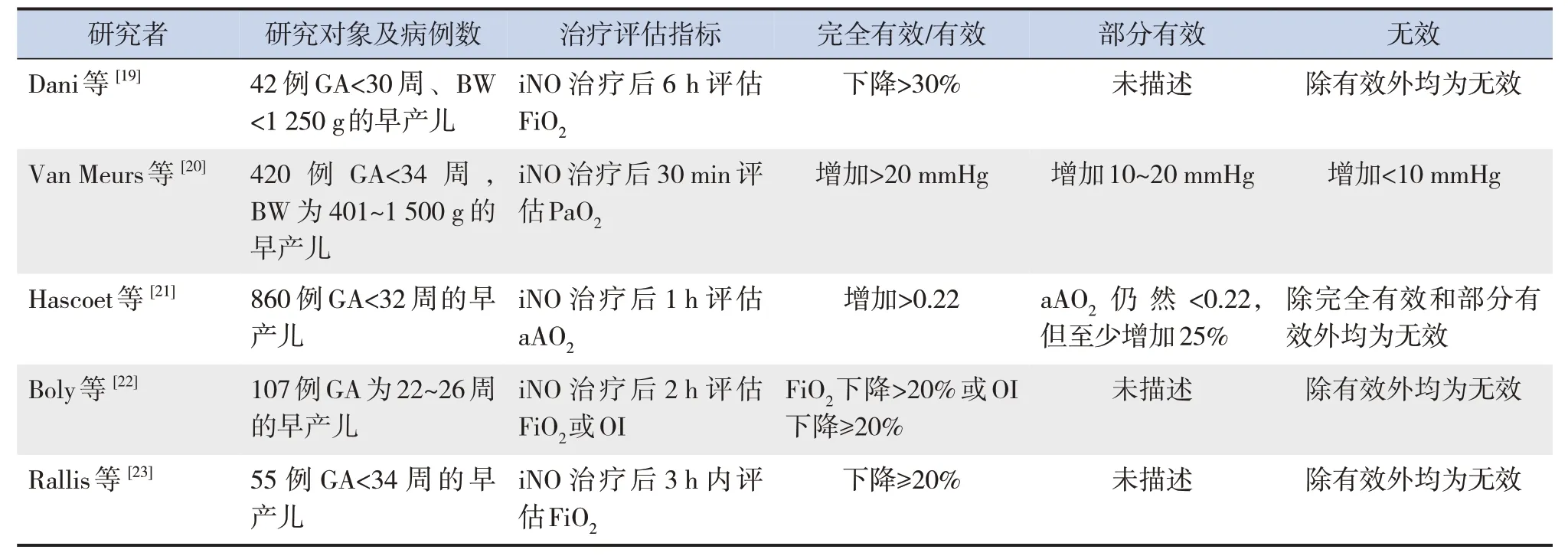
表1 不同研究关于iNO治疗评价的定义
一篇纳入17项iNO治疗早产儿HRF随机对照试验(randomized controlled trial, RCT)的Meta分析显示,早期常规使用iNO不能预防支气管肺发育不良(bronchopulmonary dysplasia, BPD)的发生(RR=0.91,95%CI:0.74~1.13),也不能降低早产儿病死率(RR=0.94,95%CI:0.87~1.01)、3~4级脑室内出血发生率(RR=0.89,95%CI:0.73~1.09),不能改善远期神经发育结果(RR=0.91,95%CI:0.74~1.13)[24]。考虑iNO治疗存在潜在不良反应及缺乏高质量RCT研究证据,故不推荐iNO早期常规用于早产儿BPD的预防[24-28]。
目前研究表明,iNO用于早产儿胎膜早破和羊水过少导致的PPHN或HRF效果是肯定的[29-31]。早产儿BW也会影响iNO的疗效[9,32]。一篇纳入17项关于iNO的RCT Meta分析表明,iNO治疗可降低BW>1 000 g早产儿的病死率或BPD发生率,而对BW<1 000 g早产儿的治疗效果欠佳[33]。这与之前的对足月儿和晚期早产儿的研究发现,体重越小的新生儿对iNO治疗效果越差相符[20]。
3 iNO在GA<34周早产儿中使用的有关问题
3.1 iNO治疗的时机
关于iNO在GA<34周早产儿中的治疗时机,目前没有统一定论。Schreiber等[34]研究发现,患儿在生后12~24 h内接受iNO治疗7 d,可以降低慢性肺部疾病的发生率和病死率,还可以降低脑室内出血或脑室周围白质软化的发生风险。但也有不同的研究结果,Van Meurs等[20]研究发现,BW<1 500 g,且在30 min至12 h内连续2次氧合指数(oxygenation index, OI)≥10的早产儿,在生后24 h开始iNO治疗,不会降低病死率或BPD的发生率。有研究发现,患有PPHN伴有羊水过少的早产儿,在生后3 d内开始iNO治疗,其有效率明显高于出生3 d后使用患儿[30]。一篇纳入17项iNO研究的Meta分析发现,生后≤7 d开始iNO治疗可降低BPD发生风险,而生后>7 d使用的患儿BPD发生率无明显变化[33]。综上所述,各研究iNO的治疗时机不一致,目前尚无iNO治疗GA<34周早产儿的最佳推荐时机,但是,当最大程度的呼吸支持效果欠佳时,且OI≥10,应尽早给予iNO,对早产儿预后可能有改善作用。
3.2 iNO的治疗剂量
目前,iNO在早产儿疾病的研究中,治疗剂量有明显差异[35-38],见表2。虽然iNO有一定的剂量-效应关系,但吸入浓度越大,相应不良反应越明显,应尽可能用最小的剂量达到临床治疗的效果。因此,大多数研究iNO的起始剂量都是从小浓度开始,多为5~10 ppm(parts per million),最高剂量为20 ppm,部分研究iNO最高剂量达40~80 ppm[9]。在GA<34周早产儿中,iNO初始治疗没有统一剂量,临床上可考虑从5 ppm开始,后根据患儿对iNO的反应进一步调整剂量,最高剂量为20 ppm。也有研究认为,低浓度iNO疗效不佳时,再给以高浓度iNO,其敏感性会降低,所以建议起始治疗浓度为20 ppm[39]。

表2 不同研究关于iNO的治疗剂量
3.3 iNO与其他血管活性药物的联合使用
在iNO治疗无效时,若肺动脉高压持续存在,氧合没有得到改善时,可考虑联合使用血管活性药物。目前西地那非和米力农使用较多。在治疗足月儿和晚期早产儿难治性PPHN中,西地那非及米力农联合iNO治疗能有效改善氧合,但尚缺乏RCT证据[40-42]。应注意不同情况下血管活性药物的选择。若血压稳定,且在卵圆孔和/或动脉导管水平的右向左分流及心室功能良好的情况下,一线药物是西地那非。西地那非可以是静脉注射(首选)或口服,静脉注射的负荷剂量是0.42 mg/kg治疗3 h[相当于0.14 mg/(kg·h)],随后每天1.6 mg/kg持续维持输注,口服剂量为1~2 mg/kg,6 h 1次。若血压正常,但存在左心室功能障碍时,禁止使用iNO,因为可能会导致肺水肿及严重低氧血症,此时米力农可能是PPHN的首选治疗药物,负荷剂量是50 μg/kg,持续30~60 min,然后以0.33 μg/(kg·min)维持,根据患儿反应可增至0.66 μg/(kg·min)或1 μg/(kg·min)。米力农或西地那非使用时应监测血压,在全身性低血压的情况下,不建议使用负荷剂量。当患儿存在全身性低血压且心脏功能良好的情况下,应及时补液治疗,补液后使用肾上腺素、去甲肾上腺素、多巴酚丁胺、多巴胺或血管升压素等血管活性药物来维持全身血压,维持收缩压在50 mmHg以上,更有利于阻止卵圆孔或动脉导管水平的右向左分流,从而增加左心室的输出量,改善全身灌注和氧合[3,43]。研究发现西地那非可增强并显著延长NO肺血管舒张作用的持续时间,其作用机制可能是当外源性NO减少时(如NO撤离),通过增加环磷酸鸟嘌呤核苷促进内源性NO的产生,故在iNO撤离时口服西地那非,可以改善这种低氧反跳现象[NO撤离时经皮血氧饱和度(percutaneous arterial oxygen saturation, SpO2)下降>5%,且吸入气氧浓度(fraction of inspiration O2, FiO2)需增加0.15来维持动脉血氧分压>60 mmHg][44]。血管活性药物还有内皮素受体阻滞剂、前列腺素及其衍生物。一项波生坦治疗PPHN的系统综述发现,波生坦治疗PPHN有效,但使用波生坦治疗时要监测肝功能,并注意其他不良反应的发生[45-46]。现有研究表明,吸入前列腺素及其衍生物,在改善PPHN方面可能有效果[44,47]。在应用血管活性药物时,应注意患儿有无肺血管发育不全、急性肺水肿、气道梗阻等,若存在上述情况应不用或慎用。目前有关血管活性药物与iNO联合使用的报道大都是在足月儿和晚期早产儿中,在GA<34周早产儿中的相关报道还非常少,其有效性、安全性及应用的剂量和适应证有待进一步研究。
3.4 iNO的撤离
启动iNO撤离的适应证和方法各研究均不一致[18-19,21,35],见表3。若iNO开始治疗无反应,则浓度升至10 ppm后2 h重新评估,若还是无反应,则iNO 4 h停止吸入。研究表明,iNO浓度≥10 ppm时突然撤离可能会出现低氧反跳现象,故美国呼吸治疗协会临床实践指南推荐,在iNO撤离前应将其浓度逐渐下降至1 ppm或更低,并在撤离过程中适当提高FiO2,且在完全撤离前再次提高FiO2或口服西地那非,可降低撤离时低氧反跳现象的发生[41]。目前,关于iNO在GA<34周早产儿中的撤离时机,一般是在临床改善的情况下,根据OI值、SpO2、导管前后SpO2的差异、动脉-肺泡氧含量比(arterial alveolar ratio in oxygen, aAO2)和FiO2等指标启动撤离模式,但具体根据哪个指标较适合没有定论,有待进一步的研究达成共识,以提高撤离成功率。
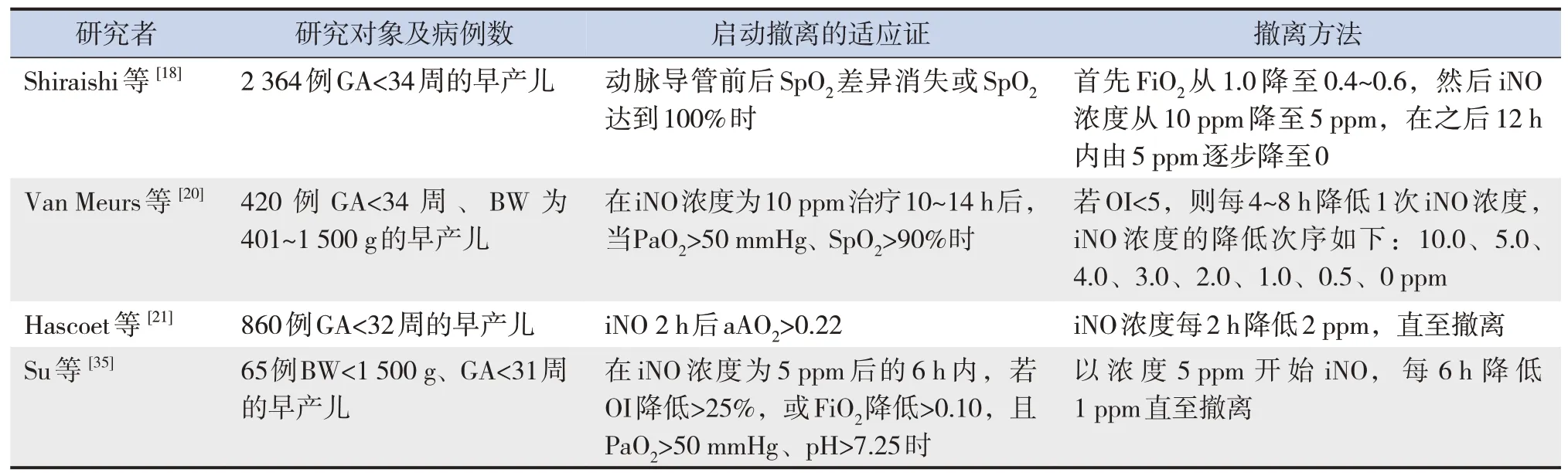
表3 不同研究关于iNO的撤离
4 iNO的安全性
NO与氧气结合可形成二氧化氮(nitrogen dioxide, NO2),NO2对气道和肺组织可产生刺激,从而导致炎症反应。NO还与超氧化物阴离子反应形成过氧化亚硝酸盐,其可以干扰表面活性物质的功能。iNO还可以通过环磷酸鸟嘌呤核苷通路影响血小板的聚集,从而影响凝血功能,增加颅内出血的发生风险,并可能诱导肺外血管的扩张。此外NO还可与血液中的氧合血红蛋白结合形成高铁血红蛋白(methemoglobin, MetHb),从而影响氧气的运输,产生高铁血红蛋白血症危及患儿生命[9,47]。美国食品药品监督管理局在NO输送设备和分析指南提出,在FiO2为0.6、NO浓度为40 ppm时,NO2浓度不应超过1.0 ppm,故在应用iNO治疗时应对呼吸机管道内的NO2浓度、血小板数量及MetHb浓度进行监测,当血液中MetHb含量超过5%时,NO需减量或停止使用[48]。iNO对远期神经发育的影响尚不明确[49]。除上述对患儿造成的不良影响外,患儿呼出的NO2还可在人体内与水反应生成硝酸,对医务人员造成伤害。有研究表明,iNO的绝对禁忌证是导管依赖性发绀型先天性心脏病和严重左心室功能障碍,因为在合并肺动脉高压的情况下,单独使用NO可能会加重肺水肿,导致气体交换恶化,氧合下降[25]。因此,关于早产儿iNO使用的安全性目前仍存在争议,需进一步研究来证实,临床上使用iNO时应严格掌握适应证及剂量,密切监测不良反应的发生,规范NO吸入的操作流程,使用符合要求的装置和气体来源,以避免患儿和医务人员受到伤害。
5 小结
国内外关于iNO在GA<34周早产儿中的相关研究尚处于初步阶段。现有研究表明,iNO可作为GA<34周早产儿合并PPHN或HRF的一种营救性治疗措施,但不推荐iNO早期常规使用,早产儿合并有胎膜早破和羊水过少等情况,iNO治疗的效果是肯定的,BW>1 000 g早产儿iNO治疗可能更有效。关于iNO的应用时机、剂量、撤离方式和与血管活性药物联合使用等问题,还没有统一的共识。因此,iNO在GA<34周早产儿中治疗的有效性和安全性还有待于进一步评估。
利益冲突声明:所有作者声明无利益冲突。

