烟草种子萌动前后的蛋白与多分析
王国平,齐胤尧,徐国云,李元君,牛永志,李晓旭,乔雨,郑昀晔*
生物技术
王国平1,齐胤尧2,徐国云3,李元君1,牛永志1,李晓旭4,乔雨1,郑昀晔1*
1 玉溪中烟种子有限责任公司,云南玉溪 653100;2 湖南大学生物学院,湖南长沙 410082;3 中国烟草总公司郑州烟草研究院,河南郑州 450001;4 湖南中烟工业有限责任公司,湖南长沙 410001
【背景和目的】种子的萌发是幼苗建成并正常生长的基础,研究种子萌发机制并鉴定相关功能物质,对于促进萌发、提高种子活力具有重要意义。【方法】本研究基于液相色谱-质谱(LC-MS/MS)方法,对吸水萌动前后的烟草种子的蛋白和多肽进行了分析。【结果】在干种子(萌动前种子)中鉴定到蛋白72个,在吸水萌动种子中鉴定到蛋白192个。富集分析发现,干种子中的蛋白主要富集在应对种子的氧化或逆境胁迫,吸水萌动种子中的蛋白主要富集在蛋白合成以及温度响应相关过程。在干种子中进一步筛选到7个多肽分子,在吸水萌动的种子中进一步筛选到13个多肽分子,其中有5个为共有多肽。通过外源多肽处理种子,发现适宜浓度的半胱氨酸蛋白酶抑制剂(Cysteine proteinase inhibitor,)能够促进未成熟(授粉后20 d采收)烟草种子的萌发。【结论】本研究从蛋白和多肽层面为解析种子吸水萌发的机制提供了理论依据,也为多肽在种子萌发过程的功能研究提供了新的认识。
烟草;种子;多肽;蛋白;萌发
种子萌发是指种子从吸胀到胚根突出种皮,种子内部发生一系列生理生化变化的过程[1]。种子萌发的速度、萌发的比例(发芽率)体现了种子的活力,是幼苗正常形成并茁壮生长的基础。研究种子萌发机制并鉴定关键功能物质对于促进萌发、提高种子活力具有重要意义。虽然烟草成熟种子的发芽率均可达90%以上[2],但进一步提高其发芽率或者发芽势、整齐度等指标仍具有一定现实意义。
种子萌发通常可以分为3个阶段[3],第一阶段为吸胀阶段,烟草种子吸水3~5 h左右完成。在扩散作用和毛细管作用下,水从种子外部高水势区域移动到种子内部低水势区域,种子含水量快速增加,主要涉及细胞壁及原生质体中的大分子(主要指蛋白质与多糖)对水的吸收[4]。第2阶段为萌动阶段,也是最关键的一个阶段,烟草种子吸水35~46 h左右完成。此过程种子含水量基本保持稳定,各种代谢开始活跃,涉及氨基酸代谢、脂类代谢、糖代谢、能量代谢以及细胞生长与结构、细胞防御与救援等相关蛋白质的大量合成[5-8]。其中很关键的一类long-lived mRNA对种子萌发也起到重要作用,其会直接翻译成蛋白质,当翻译受到抑制时,棉花、拟南芥以及水稻的种子均不能正常完成萌发[9-12]。第3阶段为胚根突出阶段,此阶段伴随着种子形态发生变化,种子含水量开始重新上升,胚根突破种皮并开始伸长。种子完成萌发后子叶展开,逐步形成幼苗并开始正常生长。
已有研究发现多肽分子广泛参与植物的生长发育[13-14],例如根系发育[15]、植物受精[16]、逆境胁迫[17]等。在拟南芥中已经发现了大量的多肽分子,但绝大多数功能依然未知,对于种子萌发过程中起到关键作用的多肽分子更未见报道。本研究利用基于质谱的多肽组学方法分析烟草种子萌动前后的蛋白质表达差异[18-21],筛选出可能起到重要功能的多肽分子,并进一步通过外源处理,以明确多肽分子在种子萌发过程中的潜在功能,为促进种子萌发、提高种子活力提供理论和技术支撑。
1 材料与方法
1.1 样品前处理
供试材料为烟草品种K326的种子,由玉溪中烟种子有限责任公司提供。称取两份干燥的种子,其中一份种子不进行处理(CK),另一份种子用水浸种48 h,在室温下回干(WS)。
向样品中加入裂解液[1% SDS,8 mmol/L urea,1×蛋白酶抑制剂(罗氏)],研磨3次,每次400 s。将研磨液放在冰上裂解30 min,在15000 rpm、4℃下离心15 min,取上清液。使用10 kDa超滤管(Millipore,Billerica)在8000 g、4℃下离心30 min,收集流穿液,以去除高分子量的蛋白质。流穿液用离心浓缩器进行浓缩,并用100 mmol/L TEAB重新溶解。之后用C18除盐柱除盐后真空抽干,最终样品保存于-80℃备用。
1.2 质谱仪参数设置
将前处理后的样品重新溶于0.1%甲酸水溶液,并使用配备在线纳喷离子源的LC-MS/MS进行分析。整套系统为串联EASY-nanoLC 1000的Orbitrap Fusion Lumos质谱仪(Thermo Fisher Scientific, MA, USA)。样品体积为5 μL(分析柱:acclaim pepmap C18,75 μmol/L x 25 cm),柱流量控制在400 nL/min,柱温55℃,电喷雾电压为2 kV,色谱梯度为:流动相A:0.1%甲酸水溶液;流动相B:含0.1%甲酸的ACN溶液。
质谱参数设置如下:(1)MS:扫描范围(m/z)= 200~1500,分辨率=120,000,AGC target=4e5,最大注入时间=50 ms,扫描电荷=1~7。(2)HCD-MS/MS (top 10):分辨率=15,000,隔离窗口=3 m/z,AGC target=5e4,最大注入时间=35 ms,碰撞能量=35,动态排除时间=30 s。
1.3 搜库参数设置
完成质谱分析后,利用PEAKS Studio version X + (Bioinformatics Solutions Inc., Waterloo, Canada)对串联质谱的原始数据进行分析。使用PEAKS DB对Nicotiana tabacum数据库(https://solgenomics.net/ organism/Nicotiana_tabacum/genome)和Uniprot数据库(https://www.uniprot.org/)进行搜库。设置None enzyme即非酶切,搜库参数碎片离子质量容许误差:0.02 Da,母离子质量容许误差:7 ppm,可变修饰:Oxidation(M)15.99,Acetylation(Protein N-term)42.01。肽段经过1% FDR质控过滤。
同样使用PEAKS Studio version X+对过滤后的肽段进行非标记定量。首先,软件分别识别各样本中肽段母离子的峰面积即肽段的相对丰度,然后采用高性能的保留时间对来源于不同样本的相同肽段进行对齐。采用样本的总离子流(TIC)进一步对数据进行归一化处理,样本中各肽段的丰度由原始丰度除以归一化系数获得。
1.4 数据初步分析
原始数据使用PEAKS鉴定,最小肽段长度为7个氨基酸,当谱图水平接近1% FDR时曲线平滑上升,identified peptides-spectrum matches数值合理,证明鉴定结果可信且数量理想。
使用PEAKS提取肽段峰强度、峰面积、液相色谱保留时间等信息,多肽定量使用PEAKS默认参数。使用总和归一化方法对不同重复间蛋白的定量值进行归一化处理。根据鉴定结果对多肽及前体蛋白进行GO和KEGG功能注释。
1.5 生物信息学方法
在本研究中,以下R包用于GO富集分析和KEGG注释:clusterProfiler(用于富集分析),topGO(用于绘制GO富集图片),AnnotationHub(用于下载数据库),BioFileCache(依赖包),dbplyr(依赖包),pathview(用于查看KEGG路径)。分析过程中使用的数据库编号为AH93857。
1.6 原核表达载体构建
采用Infusion连接法设计引物,以K326样品的cDNA为模板,PCR扩增目的片段。使用H I和R I切割pET32a空载体,将PCR产物用Infusion法连接到pET32a质粒载体上。热激转入宿主菌大肠杆菌DH5α,挑取单个菌落培养后,用东盛质粒小量提取试剂盒(N1011)提取质粒DNA,并进行PCR检测及双酶切检测,将检测为阳性的重组质粒送擎科生物技术有限公司进行桑格测序并比对序列。本研究选取的3个小肽的参考序列RefSeq登录号以及UniPort登录号分别为:XM_016605163(A0A1S3Z8G7)、XM_016624929(A0A1S4AV16)和NM_001325761(A0A075F933),载体构建相关引物序列见表1。

表1 原核表达载体构建引物
1.7 重组蛋白的原核表达
将测序正确的质粒转入大肠杆菌菌株BL21(DE3),挑取单菌落接种到5 mL LB/AMP液体培养基,37℃、220 r/min培养12 h。取1 mL菌液接种于100 mL LB/AMP液体培养基,37℃振荡培养至OD600≈ 0.6~0.8,取诱导前菌液1 mL用于后续检测。加入IPTG至终浓度0.5 mmol/L,然后16℃、110 rpm振荡培养12~16 h,再取诱导后菌液1 mL用于SDS-PAGE检测蛋白表达情况。
确认表达成功后,每100 mL菌液菌体沉淀使用10 mL Lysis Buffer重悬,加入PMSF至1 mmol/L,使用超声法破碎细胞,菌液上清与镍柱共孵育4~8 h(可隔夜挂柱)。将镍柱装载入蛋白纯化柱,静置沉淀,待上清流出。使用10 mL Lysis Buffer洗两次,10 mL Wash Buffer洗两次,收集穿透液。使用2.5 mL Elution Buffer 洗脱,每收集500 μL停止收集,孵育10 min。使用SDS-PAGE检测蛋白纯化情况。纯化蛋白后,稀释至15 mL,使用Amicon-Ultra-15超滤管(MWCO10kD,UFC901096)浓缩至500 μL。再次稀释,浓缩,重复5次。
1.8 烟草种子处理
处理的种子为品种K326种子,包括授粉后20 d提前采收的种子(不成熟的种子);经过密度分选,筛选出的密度小于0.95的种子(不饱满的种子);经45℃ 100%湿度老化处理5 d的种子(人工老化的种子)。
将目标多肽稀释至目标浓度10、7.5、5、2.5、1、0 μmol/L(第一次筛选使用浓度)以及5、2、1、0.75、0.5、0.25、0 μmol/L(第二次筛选使用浓度)。使用多肽溶液浸泡烟草种子24 h,回干,将种子播到湿润的滤纸上,每天统计萌发数量,并拍照。
2 结果与分析
2.1 肽段特征分析
本研究首先以吸水萌动种子的质谱数据为例,对数据库进行了筛选。分别将质谱数据搜索Nicotiana tabacum Genome Data数据库和Uniprot数据库。结果显示,吸水萌动种子分别匹配到763个肽段(Nicotiana tabacum Genome Data数据库)和1549个肽段(Uniprot数据库)。由于搜索Uniprot数据库获得的肽段数量较多,后续均采用Uniprot数据库进行分析。最终的结果显示:干种子(CK)共计鉴定到肽段311条,匹配到蛋白114个,吸水萌动种子(WS)共计鉴定到肽段1549条,匹配到蛋白268个。而鉴定获得的肽段的长度主要集中在6~35个氨基酸范围内,占全部鉴定肽段的98%以上(图1)。

图1 肽段长度分布
2.2 蛋白鉴定与富集分析
本研究主要关注多肽对种子萌发的影响。早期认为多肽的大小为小于100个氨基酸的蛋白分子[22]。随着研究的不断深入,发现很多有功能的多肽大小并不限定在100个氨基酸,并且基因组越复杂的物种,多肽的大小越大。例如快速碱化因子RALF多肽,拟南芥中最大的RALF23多肽大小为138个氨基酸,水稻中OsRALF5多肽大小为170个氨基酸,烟草中NtRALF12多肽大小为212个氨基酸。本研究为了鉴定到更多的有潜在功能的多肽分子,将整体大小定义在小于402个氨基酸的蛋白为多肽分子。因此本研究将肽段匹配到的蛋白中去除超过402个氨基酸的较大蛋白,最终得到干种子(CK)中的蛋白数量为72个,吸水萌动种子(WS)中的蛋白数量为192个。分别对得到的蛋白进行GO和KEGG注释分析(图2A~D)。GO富集结果显示:干种子中(CK)的蛋白主要富集在脱落酸响应、脂质响应、RNA代谢等过程(图2A)。吸水萌动种子中(WS)的蛋白主要富集在转录、翻译相关事件,同时与种子萌发相关的蛋白质也得到富集(图2B)。说明干种子中所富集到的蛋白质可能更多应对种子的氧化或者逆境胁迫。而在吸水萌动的种子中,转录与翻译迅速增强,一些蛋白质分子快速合成用于促进种子萌发、温度响应等过程。KEGG富集结果显示:干种子中富集到嘧啶和嘌呤代谢,这与GO富集中UTP、GTP、CTP等合成相对应(图2C)。此外,吸水萌动的种子中有一类应答低温的蛋白质被显著富集(图2D)。说明在种子萌发早期,蛋白质除了用于形成核糖体外,也参与了温度的响应,这也为后续研究种子萌发过程中低温应答蛋白提供了参考。
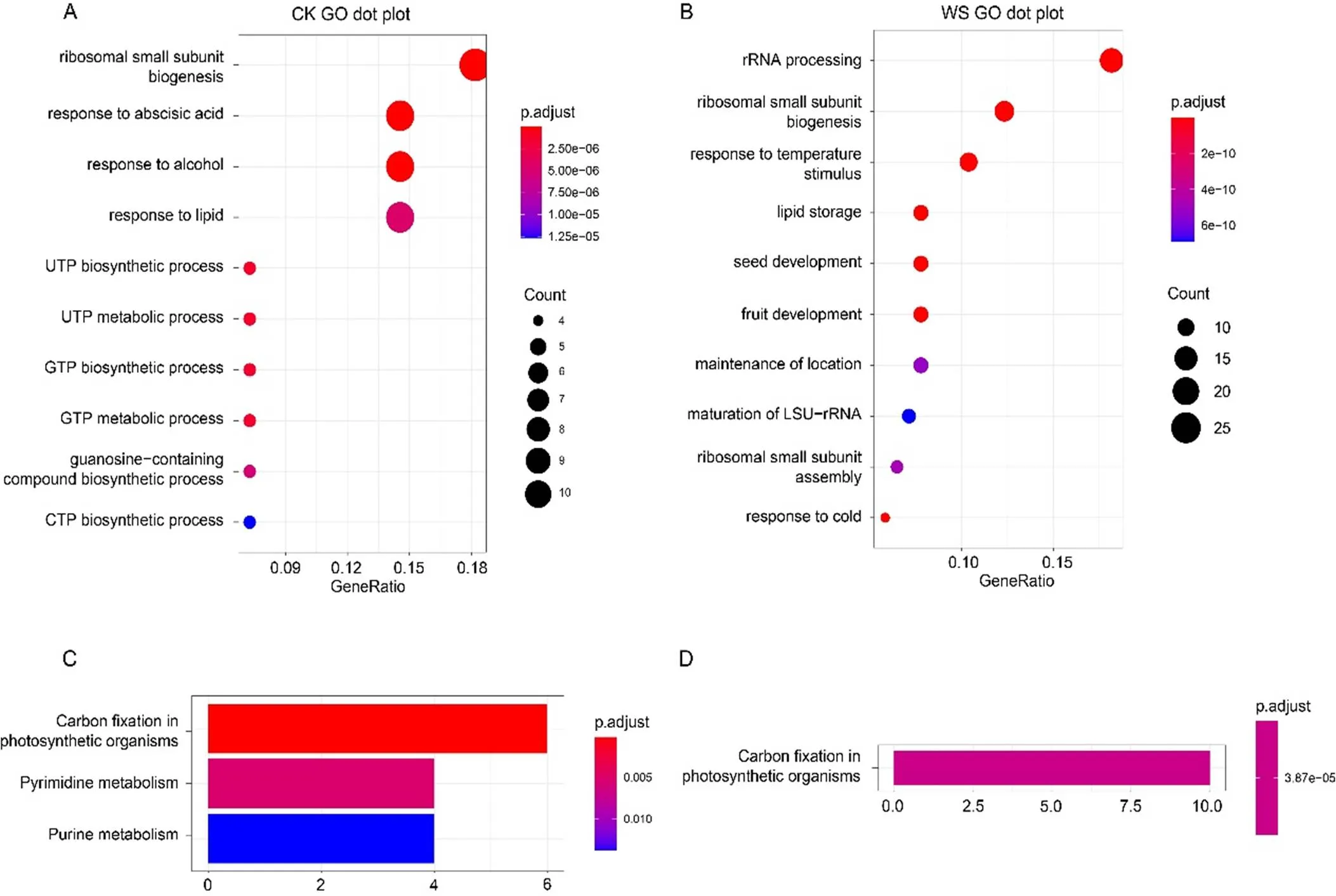
注:(A)GO富集分析干种子(CK)得到的生物过程(Biological Process, BP)气泡图。(B)GO富集分析吸水萌动种子(WS)得到的生物过程(Biological Process, BP)气泡图。(C)KEGG富集分析干种子(CK)的柱状图。(D)KEGG富集分析吸水萌动种子(WS)的柱状图。
2.3 多肽的筛选与差异分析
对所匹配的蛋白质进行筛选,将目标进一步缩小到分泌型多肽。在筛选到的小于402个氨基酸的多肽中,进一步筛选具有信号肽,能够分泌到胞外;具有多个半胱氨酸结构的多肽。经过筛选后,干种子中(CK)符合条件的多肽有7个,吸水萌动的种子(WS)中符合条件的多肽有13个(表2,图3)。吸水萌动的种子中新增多肽8个,减少多肽2个,5个多肽同时被检测到(图4)。

表2 多肽的质谱结果

图3 候选多肽A0A1S3Z8G7(A)、A0A1S4AV16(B)及A0A075F933(C、D、E、F)肽段的二级质谱图
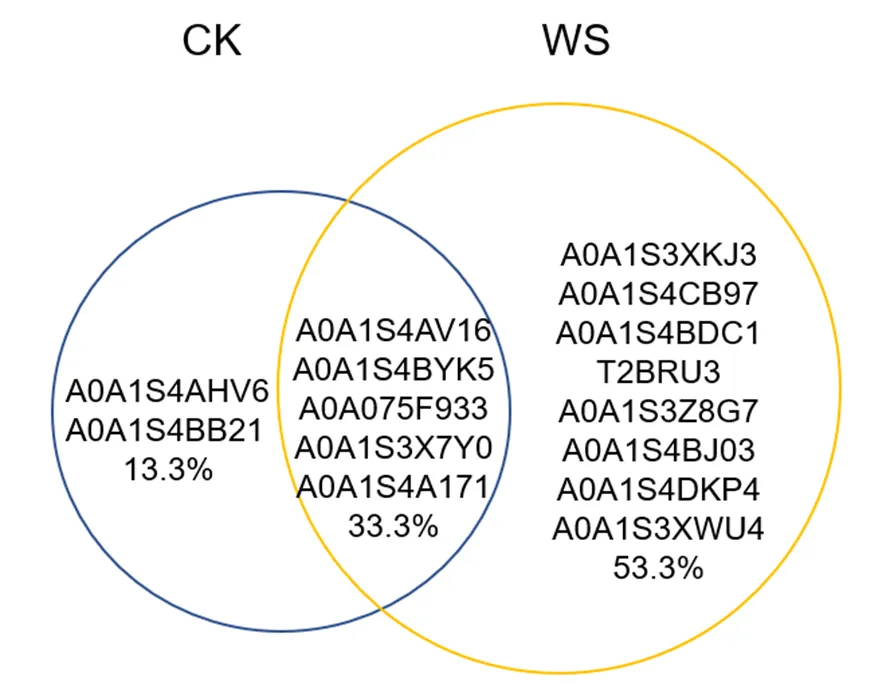
图4 烟草种子吸水萌动前后检测多肽的韦恩图
2.4 多肽功能探究
本研究选择半胱氨酸含量较高的3个多肽进行原核表达,分别为:(2S sulfur-rich seed storage protein 2-like)、(Translocon- associated protein subunit beta)和(Cysteine proteinase inhibitor,)。其中,能够顺利有效表达纯化(图5A),利用处理烟草不成熟的种子、不饱满的种子以及老化的种子。在初筛实验中,发现在低浓度(0~1 μmol/L)时可以促进不成熟种子的萌发,而在高浓度(1~10 μmol/L)则会抑制不成熟种子的萌发(图5B~C),对其他两种种子的处理效果不明显。进一步将0~1 μmol/L的多肽浓度进行细致划分,发现随着多肽浓度的增加,种子的萌发速率显著地提升(图5B~C)。因此,本研究发现了一种新型的多肽分子能够促进不成熟烟草种子的发芽率和发芽速度。

注:(A)CYS3蛋白的诱导。(B)CYS3多肽处理不成熟烟草种子的发芽率统计。(C)CYS3多肽处理不成熟烟草种子的萌发状态。
3 讨论
本研究通过对烟草K326吸水萌动前后的种子进行多肽组分析,鉴定到萌动前种子肽段311条,吸水萌动后种子肽段1549条,萌动后的蛋白数量明显多于萌动前,说明种子吸水萌动过程中大量蛋白质的表达被激活。在去除大于402个氨基酸的蛋白后,干种子匹配到蛋白72个,吸水萌动种子匹配到蛋白192个。其中众多蛋白没有功能注释信息,这些蛋白为新多肽的鉴定和功能研究提供了数据基础。在筛选出的多肽中,吸水萌动的种子中检测到了多肽:(GDSL esterase,脂肪酶)、(vignain-like,半胱氨酸型内肽酶活性)、(Protein disulfide-isomerase,催化蛋白质中-S-S-键的重排)、(Cysteine protease CP8,半胱氨酸型内肽酶活性)、(2S sulfur-rich seed storage protein 2-like,营养储存相关蛋白)、(Translocon- associated protein subunit beta,调节内质网驻留蛋白的保留)、(late embryogenesis abundant protein D-29-like,胚胎发育晚期丰富蛋白)、(uncharacterized protein LOC107769471,无功能注释)。这些多肽的功能主要集中在对蛋白质结构的切割、重排和定位,进一步印证了众多蛋白质参与到种子的吸水萌发过程。
在生物信息学筛选的基础上,本研究选取3个多肽进行表达分析,发现()多肽能够促进不成熟烟草种子的萌发,提示该多肽在种子吸水与萌发的过程中起重要功能。在鉴定到的包括在内的多肽分子中,绝大多数都未被研究报道,这为后续研究相关多肽在低温应答或者其他的生物学功能方面奠定了基础。本研究鉴定到的多肽中,占比最大的是富含半胱氨酸的多肽,它是一类多功能性糖蛋白,在哺乳动物中参与了生殖相关生物学过程,比如与精子成熟、精卵融合[23]。在肿瘤中,这类蛋白则参与肿瘤细胞增殖、分化、转移和侵袭等各个生物学过程[24]。然而,在植物中这类蛋白的功能很少见到报道,本研究揭示这类蛋白可能参与了种子的萌发。
4 结论
本研究通过对烟草种子吸水萌动前后的多肽组进行分析,在干种子中鉴定到蛋白72个,主要富集在应对种子的氧化或逆境应答过程;在吸水萌动种子中鉴定到蛋白192个,主要富集在蛋白合成以及温度响应过程。进一步在干种子中筛选到7个多肽分子,在吸水萌动的种子中筛选到13个多肽分子,其中适宜浓度的多肽能够促进不成熟烟草种子的萌发。
[1] Bewley J D. Seed germination and dormancy[J]. The Plant Cell, 1997, 9(7): 1055-1066.
[2] 李勇,逄涛,郑昀晔,等. 烟草种子成熟过程的蛋白组学研究[J]. 西南农业学报,2020, 33(6): 1121-1125.
LI Yong, PANG Tao, ZHENG Yunye, et al. Proteomics research of maturing tobacco seeds[J]. Southwest China Journal of Agricuhural Sciences, 2020, 33(6): 1121-1125.
[3] Bewley J D, Bradford K J, Hilhorst H W M, et al. Seeds:Physiology of development, germination and dormancy (3rd edition)[M]. New York: Springer, 2013.
[4] 徐恒恒,黎妮,刘树君,等. 种子萌发及其调控的研究进展[J]. 作物学报,2014, 40(7): 1141-1156.
XU Hengheng, LI Ni, LIU Shujun, et al. Research progress in seed germination and its control[J]. Acta Agronomica Sinica, 2014, 40(7): 1141-1156.
[5] Job C, Rajjou L, Lovigny Y, et al. Patterns of protein oxidation inseeds and during germination[J]. Plant Physiol, 2005, 138(2): 790-802.
[6] HE Dongli, HAN Chao, YAO Jialing, et al. Constructing the metabolic and regulatory pathways in germinating rice seeds through proteomic approach[J]. Proteomics, 2011, 11: 2693-2713.
[7] HUANG Hui, Møller Ian Max, SONG Songquan. Proteomics of desiccation tolerance during development and germination of maize embryos[J]. J Proteomics, 2011, 75(4): 1247-1262.
[8] Sheoran I S, Olson D J H, Ross A R S, et al. Proteome analysis of embryo and endosperm from germinating tomato seeds[J]. Proteomics, 2005, 5(14): 3752-3764.
[9] Dure L, Waters L. Long-lived messenger RNA: evidence from cotton seed germination[J]. Science, 1965, 147(3656): 410-412.
[10] Nakabayashi K, Okamoto M, Koshiba T, et al. Genome-wide profiling of stored mRNA inseed germination: epigenetic and genetic regulation of transcription in seed[J]. The Plant Journal, 2005, 41(5): 697-709.
[11] Sano N, Ono H, Murata K, et al. Accumulation of long-lived mRNAs associated with germination in embryos during seed development of rice[J]. Journal of Experimental Botany, 2015, 66(13): 4035-4046.
[12] Sano N, Permana H, Kumada R, et al. Proteomic analysis of embryonic proteins synthesized from long-lived mRNAs during germination of rice seeds[J]. Plant and Cell Physiology, 2012, 53(4): 687-698.
[13] Czyzewicz N, Yue K, Beeckman T, et al. Message in a bottle: small signalling peptide outputs during growth and development[J]. Journal of Experimental Botany, 2013, 64(17): 5281-5296.
[14] Murphy E, Smith S, De Smet I. Small signaling peptides indevelopment: how cells communicate over a short distance[J]. The Plant Cell, 2012, 24(8): 3198-3217.
[15] Murphy E, De Smet I. Understanding the RALF family: a tale of many species[J]. Trends in Plant Science, 2014, 19(10): 664-671.
[16] Shiba H, Takayama S, Iwano M, et al. A pollen coat protein, SP11/SCR, determines the pollen S-specificity in the self-incompatibility ofspecies[J]. Plant Physiology, 2001, 125(4): 2095-2103.
[17] Ryan C A, Pearce G. Systemin: a polypeptide signal for plant defensive genes[J]. Annual Review of Cell and Developmental Biology, 1998, 14(1): 1-17.
[18] Sano N, Takebayashi Y, To A, et al. Shotgun proteomic analysis highlights the roles of long-lived mRNAs and de novo transcribed mRNAs in rice seeds upon imbibition[J]. Plant and Cell Physiology, 2019, 60(11): 2584-2596.
[19] WANG Xiaoyu, LI Min, LIU Xuming, et al. Quantitative proteomic analysis of castor (L.) seeds during early imbibition provided novel insights into cold stress response[J]. International Journal of Molecular Sciences, 2019, 20(2): 355.
[20] Schrader M. Origins, technological development, and applications of peptidomics[J]. Methods Mol Biol , 2018,1719: 3-39.
[21] Farrokhi N, Whitelegge J P, Brusslan J A. Plant peptides and peptidomics[J]. Plant Biotechnology Journal, 2008, 6(2): 105-134.
[22] Hsu P Y, Benfey P N. Small but Mighty: Functional Peptides Encoded by Small ORFs in Plants[J]. Proteomics, 2017, 18(10): e1700038.
[23] 刘宇,肖蓉,杨东辉,等. 富含半胱氨酸分泌蛋白生物学功能的研究进展[J]. 中国细胞生物学学报,2013, 35(3): 367-373.
LIU Yu, XIAO Rong, YANG Donghui, et al. The Progress of the biological functions of cysteine-rich secretory proteins[J]. Chinese Journal of Cell Biology, 2013, 35(3): 367-373.
[24] 高萌,呼群,李超. 过表达富含半胱氨酸的酸性分泌蛋白对非小细胞肺癌细胞白蛋白结合型紫杉醇敏感性的影响[J]. 中国医药,2020, 15(2): 221-225.
GAO Meng,HU Qun,LI Chao. Effect of up-regulating secreted protein acidic and rich in cysteine on sensitivity to nanoparticle albumin-bound paclitaxel in human non-small cell lung carcinoma[J].China Medicine, 2020, 15(2): 221-225.
Analysis of protein and peptide in tobacco seeds before and after germination
WANG Guoping1, QI Yinyao2, XU Guoyun3, LI Yuanjun1, NIU Yongzhi1, LI Xiaoxu4, QIAO Yu1, ZHENG Yunye1*
1 Yuxi Zhongyan Tobacco Seed CO., Ltd, Yuxi 653100, Yunnan, China;2 College of Biology, Hunan University, Changsha 410082, Hunan, China;3 Zhengzhou Tobacco Research Institute of China National Tobacco Corporation, Zhengzhou 450001, Henan, China;4 China Tobacco Hunan Industrial CO., Ltd, Changsha, 410001, Hunan, China
Seed germination is the basis for the establishment and normal growth of seedlings. Studying the mechanism of seed germination and identifying the functional substances are of great significance for promoting germination and improving seed vigor. In this study, we used liquid chromatography-mass spectrometry (LC-MS/MS) to identify the protein and peptide in tobacco seeds before and after germination. A total of 72 proteins were identified in dry seeds and 192 proteins were identified in germinating seeds. Enrichment analysis showed that the proteins in dry seeds were mainly enriched in response to oxidation or stress and the proteins in germinating seeds were mainly concentrated in the process of protein synthesis and temperature response. Seven peptides were further screened in dry seeds, and thirteen peptides were further screened in germinating seeds, among which five were common peptides. Suitable concentration of Cysteine proteinase inhibitor () can promote germination of immature tobacco seeds (harvest on the 20th day after pollination) by treating seeds with exogenous peptides. This study provides a theoretical basis for the analysis of the mechanism of seed germination at the protein level, and also offers a new understanding of the function of peptides in seed germination.
tobacco; seeds; peptides; protein; germination
Corresponding author. Email:zhengyunye2000@163.com
中国烟草总公司云南省公司科技计划一般项目“多肽激素调控烟草种子活力研究与应用探索”(2021530000242033)
王国平(1989—),硕士,主要研究方向为烟草育种与种子科技,Tel:13511083113,Email:738969794@qq.com
郑昀晔(1978—),Tel:0877-2661278,Email:zhengyunye2000@163.com
2021-07-25;
2023-01-19
王国平,齐胤尧,徐国云,等. 烟草种子萌动前后的蛋白与多肽分析[J].中国烟草学报,2023,29(5). WANG Guoping, QI Yinyao, XU Guoyun, et al. Analysis of protein and peptide in tobacco seeds before and after germination[J]. Acta Tabacaria Sinica, 2023,29(5). doi:10.16472/j.chinatobacco.2022.150

