术后早发性结直肠癌患者预后模型的构建及验证
高丹丹 张 恒 秦浩人 王 辉
1.天津中医药大学中西医结合学院,天津 301617;2.天津市人民医院 南开大学附属人民医院放射治疗科,天津 300121
近年来,结直肠癌(colorectal cancer,CRC)发病率逐渐呈年轻化趋势[1]。目前,将50 岁前诊断为CRC定义为早发性结直肠癌(early-onset colorectal cancer,EOCRC)[2],现EOCRC 的发病率和死亡率持续上升[3]。据预测,到2030 年,<50 岁的CRC 患者约占35%[4]。EOCRC 具有独特的病因学和生物学特征,可能是不同于晚发性CRC 的独立亚型[5-6],相较于晚发性CRC,EOCRC 患者临床分期晚,预后差[7-8],分子谱变异大[9]。手术切除是EOCRC 的主要治疗方式,为提高术后EOCRC 患者效果、改善生活质量和延长生存期,本研究通过SEER 数据库对术后EOCRC 相关危险因素进行深入研究,以期为改善术后EOCRC 的生存质量提供参考。
1 对象与方法
1.1 研究对象
从SEER 数据库中提取2010—2015 年接受手术治疗的EOCRC 患者。纳入标准:①年龄<50 岁;②经病理确定的原发性结肠癌或直肠癌;③种族、婚姻状况、分化程度、癌胚抗原(carcinoembryonicantigen,CEA)水平等信息完整;④接受手术治疗。排除标准:①其他原发恶性肿瘤;②30 d 内死亡。
1.2 观察指标
从SEER 数据库中获取以下临床变量:性别、年龄、种族、婚姻状况、原发部位、肿瘤大小(肿瘤最大直径)、组织学类型、美国癌症分期联合委员会(American Joint Committee on Cancer,AJCC)分期、TNM 分期、分化程度、SEER 分期、CEA水平。
1.3 统计学方法
使用X-tile 软件确定年龄和肿瘤大小的适当临界值。采用R 统计学软件进行数据分析。基于Cox 回归筛选的独立预后危险因素,构建3 年和5 年总生存率(overall survival,OS)的概率列线图。并使用C 指数、受试者操作特征(receiver operating characteristic,ROC)曲线、校准曲线对模型的预测能力进行验证,通过决策曲线分析来评估列线图的临床有效性。以P<0.05为差异有统计学意义。
2 结果
2.1 人口统计学和临床特征
通过X-tile 软件确定年龄和肿瘤大小变量的截断值(图1)。
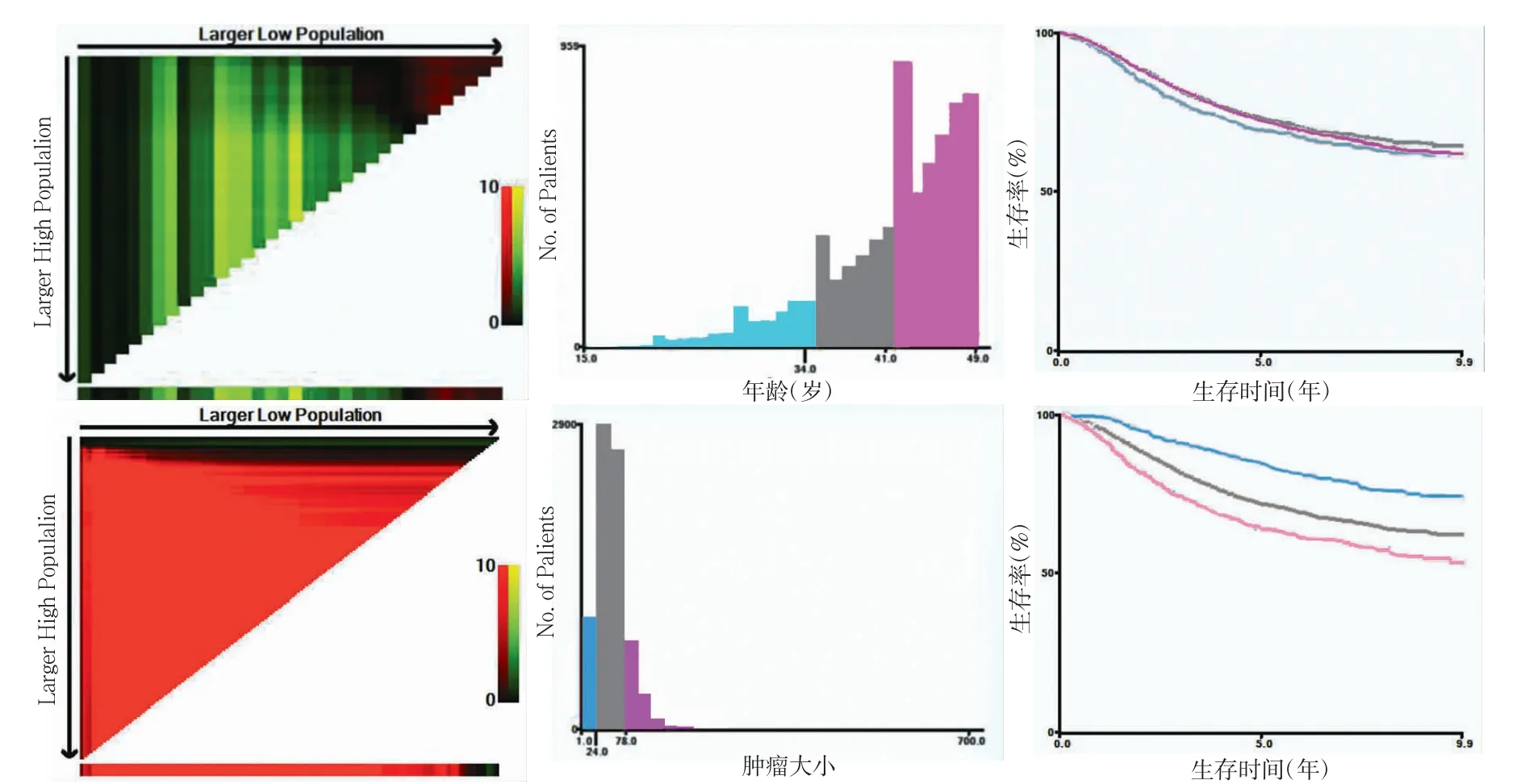
图1 年龄与肿瘤大小的最佳截断值
从SEER 数据库中共纳入7 930 例符合条件的术后EOCRC 患者,并以7∶3 随机分配到训练集和验证集。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
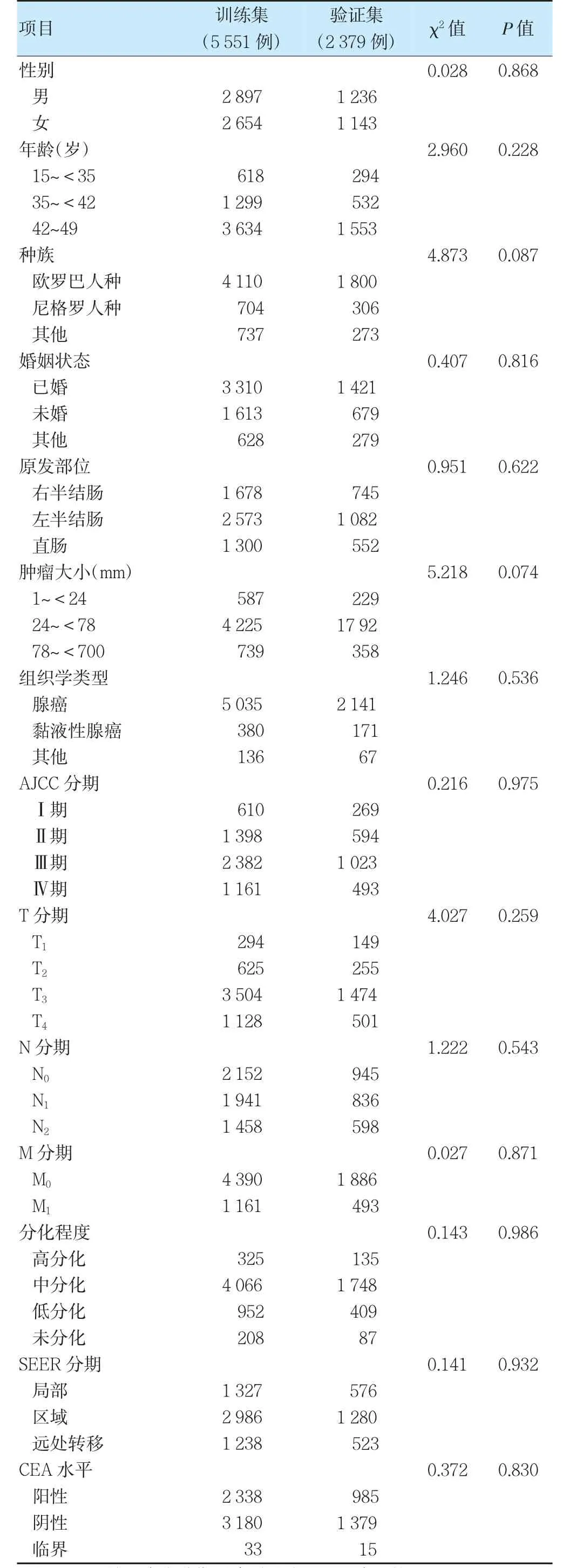
表1 训练集和验证集一般资料比较(例)
2.2 术后EOCRC 患者预后Cox 回归分析
将训练集患者的信息纳入Cox 回归分析显示,种族、婚姻状况、组织学类型、TNM 分期、分化程度、SEER 分期及CEA 水平是影响患者生存的独立预后因素(HR>1,P<0.05)。见表2。
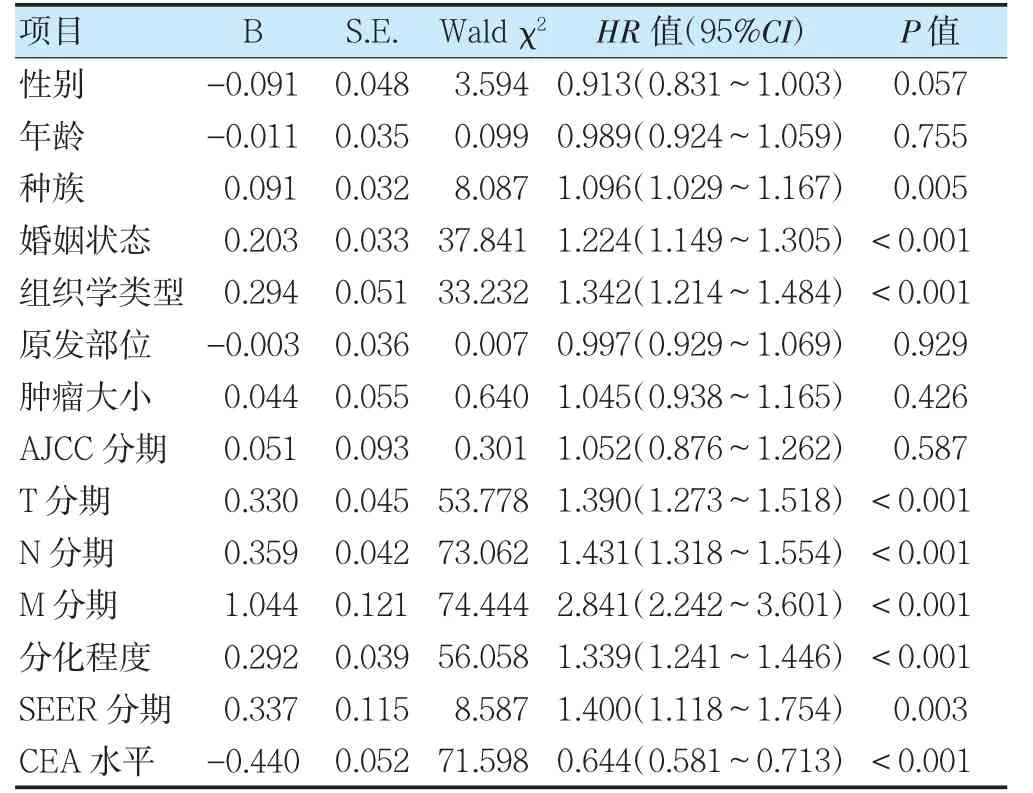
表2 术后EOCRC 患者预后Cox 回归分析
2.3 列线图构建
为了预测术后EOCRC 患者的生存时间,基于Cox 回归分析结果,将9 个独立预后因素构建列线图。见图2。

图2 术后EOCRC 患者预后列线图模型
2.4 预测模型的评价及验证
训练集和验证集的C 指数分别为0.801、0.811。在训练集中,模型预测患者3、5 年生存率的AUC 分别为0.862、0.845,AJCC 分期预测的AUC 分别为0.803、0.792。在验证集中,模型预测3、5 年的AUC 分别为0.860和0.854,AJCC 分期预测的AUC 分别为0.790、0.784,提示模型相较于AJCC 分期有更好的区分度。校准曲线和决策曲线提示预后模型能够较为准确地预测患者生存情况。见图3。

图3 术后EOCRC 患者ROC 曲线、校准曲线及决策曲线
2.5 术后EOCRC 患者的风险分层
根据列线图获得患者对应的风险总得分,使用X-tile 软件计算总得分与预后相关的临界值,见图4。基于列线图评分将患者分为低、中风险组和高风险组。根据分组绘制训练集和验证集中各个风险组患者的生存曲线,见图5。该风险分层能够较准确地识别高危群体。

图4 风险评分最佳截断值
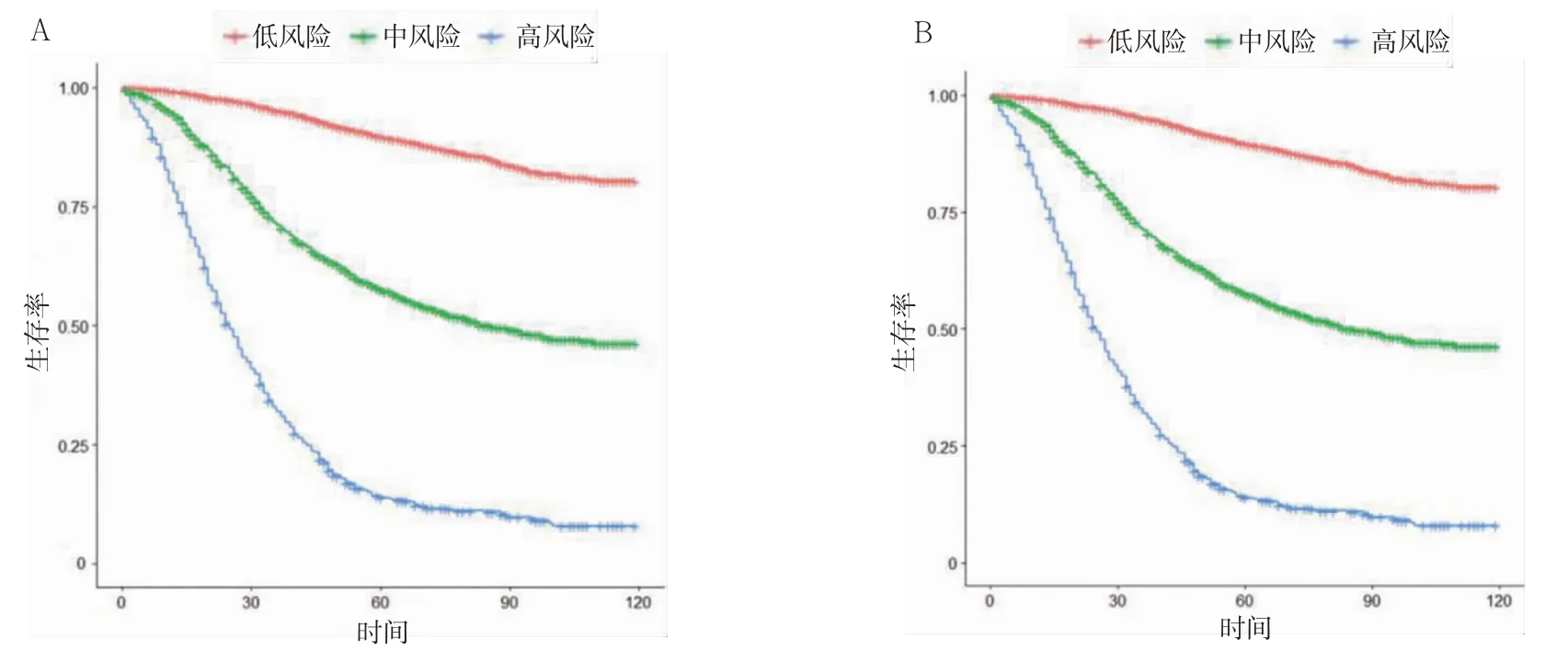
图5 训练集、验证集风险分层的生存曲线
3 讨论
EOCRC 的生存分析结果已有报道[10-13],但是术后EOCRC 的相关预后研究尚处于空白状态,且该列线图在预测术后EOCRC 患者的总生存期(overall survival,OS)中优于AJCC 分期系统。
据列线图可得知,TNM 分期、分化程度及SEER分期是影响预后的关键危险因素,这与CRC 预后模型的研究一致[14]。本研究中,肿瘤大小和原发部位与OS无关,因此是否可将肿瘤原发部位作为一个独立的预后影响因素存在较大争议。研究显示[15],左半结肠癌患者的OS 高于右半结肠癌患者。在本研究中,左侧CRC 占46.1%,使用X-tile 软件确定肿瘤大小的适当临界值,但目前大部分对结直肠癌肿瘤大小的划分是任意的。CRC 的患病率存在性别差异[16],本研究术后EOCRC 的男女患病率基本一样,考虑EOCRC 的发病与遗传密切相关,约20%归为遗传因素,主要与错配修复基因突变有关。目前,术前血清CEA 水平具有重要的预后意义[17],但关于其最佳临界值仍有争议。
另外,种族是影响术后EOCRC 患者OS 的独立因素,欧罗巴人种发病率普遍高,但预后较尼格罗人种好。现普遍认为,不同种族间的遗传差异也是肿瘤预后的重要危险因素[18]。目前包括肿瘤在内的疾病病因已不仅是生物学因素,更与心理状态密切相关[19],而婚姻状态作为重要的社会心理因素,对癌症进展有着重要影响。Aizer 等[20]发现,已婚癌症患者更易于接受系统规范的治疗,生存期显著延长。虽然EOCRC患者的肿瘤较晚发性CRC 更具侵袭性,但有研究表明EOCRC 患者的预后更好[21],可能与心理状态和积极治疗有关。在列线图中发现,高分化与中分化分层不明显,也证实了研究中一般将分化程度作为双层分层变量,分为低级别和高级别。
然而,本研究也存在一些局限性。作为一项回顾性研究,列线图仍需前瞻性研究验证。而且,SEER 数据库中没有记录患者的详细治疗信息,包括化疗方案和具体的手术方法等。另外,其他预后影响因素[22-25],如KRAS、BRAF、体重指数、家族史、低纤维摄入量及饮食习惯没有包含在SEER 数据库中。

