臭氧对MBBR硝化效率及副溶血弧菌杀菌效果影响
石婷宇,王国庆,胡鑫,谭洪新,2,3,刘文畅,2,3,罗国芝,2,3
(1 上海海洋大学上海水产养殖工程技术研究中心,上海 201306;2 上海市水产动物良种创制与绿色协同创新中心,上海 201306;3 上海海洋大学水产科学国家级实验教学示范中心,上海 201306)
循环水养殖系统(Recirculating Aquaculture System,RAS)是一种节水且高产的养殖模式[1-2]。在养殖过程中,病原微生物会以各种方式引入系统中,从而对养殖动物构成风险[3]。臭氧作为一种消毒氧化剂[4],其强氧化性可以杀灭病原微生物[5],改善养殖环境[6-7]。其氧化过程最终产物是氧气(O2),几乎不产生对动物有害的消毒副产物,常用作养殖场、市政和水产养殖育苗场预处理地表水源的消毒剂[8-10],现已广泛用于RAS中[11-14]。移动床生物膜反应器(Moving Bed Biofilm Reactor,MBBR)作为RAS中最常用的水处理单元[15-16],不仅能有效处理氨氮[17-18],而且还可去除臭氧化过程中形成的许多有害化合物[19-21]。MBBR的工作原理是通过附着在其滤料表面的硝化细菌转化氨氮和亚硝酸盐氮[22-23]。已有研究主要集中在臭氧的杀菌性能上[24],但在实际应用时,过量的臭氧可能会影响养殖系统硝化性能和水生动物的安全[25],故研究水体中臭氧使用的安全阈值对实际生产有重要意义[26]。
副溶血性弧菌(Vibrioparahaemolyticus)是循环水养殖水体中一种常见的致病菌[27],本研究通过评估不同臭氧剂量对MBBR处理水质及对副溶血弧菌的杀菌效果影响,为臭氧在RAS中的实际应用提供参考。
1 材料与方法
1.1 试验材料
试验装置由10 L(有效容积5L)的MBBR反应器和罗茨鼓风机(功率750W,森森集团股份有限公司)组成,曝气石从底部不停曝气保持滤料(Mutag BioChip 30TM,德国)悬浮,滤料填充率为60%[28]。臭氧发生器(FH-CYJ1910D-Y,枫花仪器,中国)产生臭氧后通过流量计(DK科德KD800-4-6,南京大华仪器仪表,中国)控制通入剂量。副溶血弧菌冻干粉(ATCC17802)由广东环凯生物科技有限公司购买。通过日常添加氨氮(10 mg/L,硫酸铵溶于纯水)驯化使得各组反应器处理水质能力没有显著性差异(P>0.05)。
1.2 试验设计
1.3 水质监测

总氨氮去除率[31]计算公式如式(1):
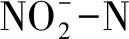
硝化速率[32]计算公式如式(2):
(2)
式中:S表示TAN去除速率,mg/(g·h);Ci表示试验前的TAN质量浓度,mg/L;Ce表示试验后的TAN质量浓度,mg/L;t为氨氮变化的时间,h。
1.4 细胞死亡率测定
在各组随机取5片生物膜裁剪成小块并用超声波震荡仪将生物膜表面附着物脱离,使用Live/Dead BaclightTMViability Kit (Invitrogen,美国)对生物膜样品进行染色,使用激光共聚焦显微镜(Confocal Laser Scanning Microscope,CLSM)(Leica TCS SP8,德国)观察各组滤料生物膜上细胞的活/死情况。活细胞被绿色荧光标记,死细胞被红色荧光所标记,用绿-红荧光的平均荧光强度比来评估生物膜活/死情况。计算方法如式(3):
M=I/A
(3)
式中:M表示平均荧光强度;I表示该区域荧光强度总和;A表示该区域面积。
1.5 副溶血弧菌计数
于感染前一天进行副溶血弧菌的活化与纯培养。经扩大培养后离心取沉淀并用无菌水稀释。将副溶血弧菌直接加入水中[33],使水体副溶血弧菌浓度为107~108CFU/mL,对照组加入等体积灭菌培养液。在无菌操作台中,取等量水样涂布于硫代硫酸盐-柠檬酸盐-胆汁-蔗糖(TCBS)琼脂平板(印度Himedia®)上,将涂布后的平板在恒温箱中37 ℃下培养24 h,产生蓝绿色菌落的菌株即为副溶血性弧菌(VP)。采用标准平板计数法进行计数,计数结果作为水体副溶血弧菌总数(Total vibrio bacteria)。
1.6 统计分析
数据表示为平均值±标准差(Mean±SD)。在进行统计分析之前,原始数据分别通过Kolmogorov-Smirnov检验和Levene检验诊断为分布正态性和方差均匀性。在SPSS 26.0上进行统计分析。采用单因素方差分析(ANOVA),并进行Tukey检验,在显著性水平为0.05(P<0.05)进行多重比较。如果数据不符合正态分布,执行非参数Kruskal-Wallis检验。使用Origin(2022版)进行图片绘制。CLSM拍摄的图片使用Imge J软件分析,计算平均荧光强度。
2 结果
2.1 生物膜细胞死亡率
5组生物膜活死细胞结果未观察到明显红色(图1)。2 mg/L臭氧剂量对滤料生物膜上细胞死亡率(12.79%±0.74%)和对照组(13.16%±1.01%)无显著性差异(P=0.49)(表1)。4 mg/L臭氧剂量下的细胞死亡率(15.29%±0.71%)显著高于0、1、2 mg/L臭氧剂量下的细胞死亡率(P=0.033)。
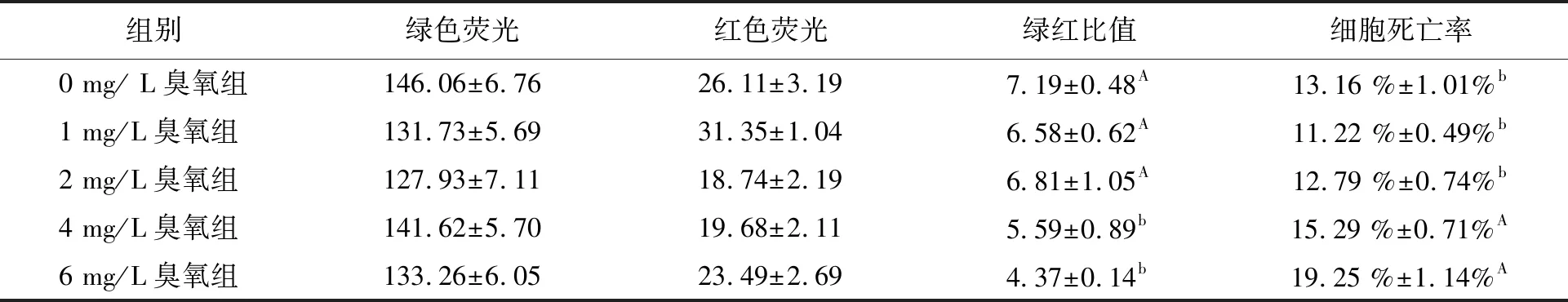
表1 各组绿-红荧光的平均荧光强度
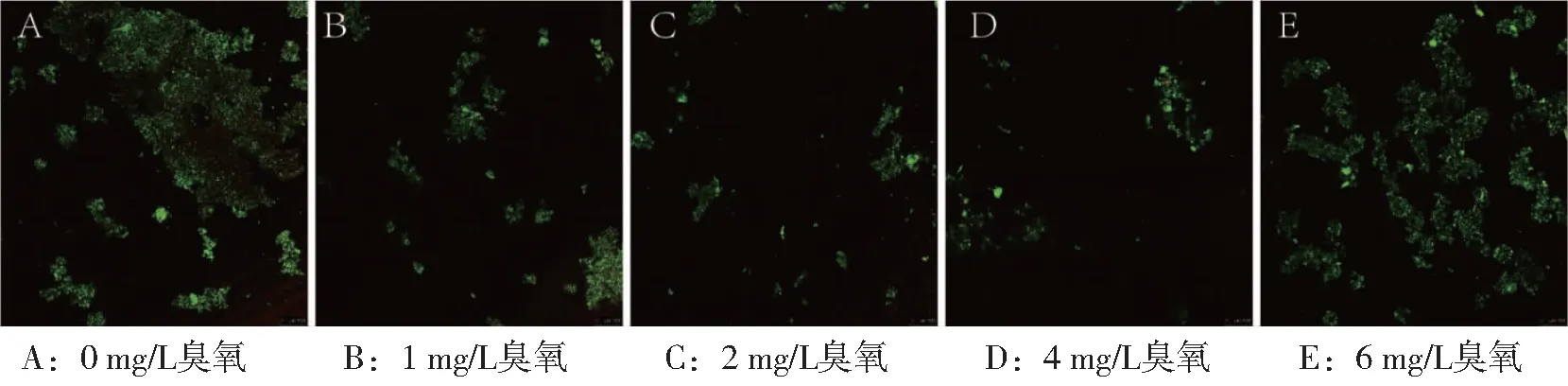
注:绿色荧光标志着活细胞,红色荧光代表死细胞
2.2 TAN去除效率
试验期间TAN在所有组别中都呈现波动下降的趋势,氨氧化速率无显著性差异(P=0.12)(图2)。试验结束时各组反应器TAN去除率分别达到了55.11%±5.32%(0 mg/L臭氧组),57.89%±9.01%(1 mg/L臭氧组),49.2%±5.99%(2 mg/L臭氧组),33.07%±2.68%(4 mg/L臭氧组),34.22%±8.89%(6 mg/L臭氧组)(表2)。
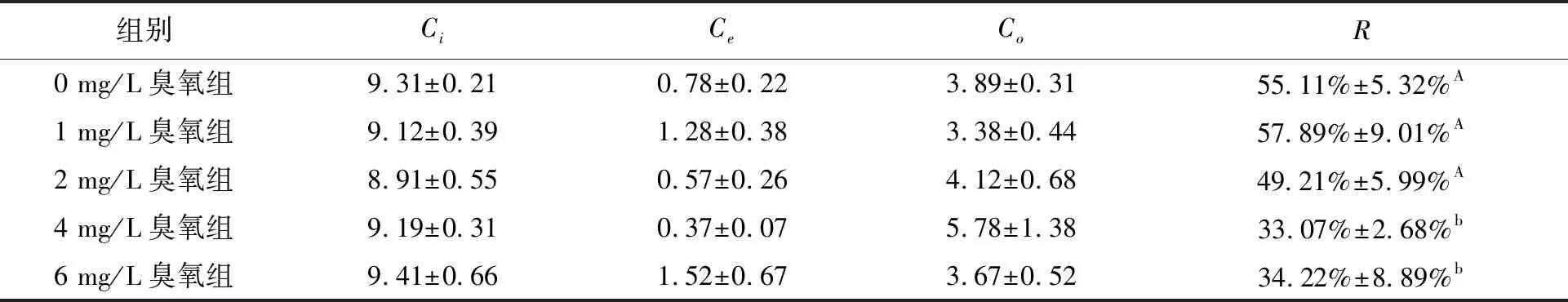
表2 各组总氨氮去除率

图2 各处理组试验期间和质量浓度
整个氨氧化试验过程中,相较于对照组,4 mg/L组的氨氮去除率显著抑制氨氧化的趋势(P=0.042)。对照组TAN去除率(55.11%±5.32%)与2 mg/L臭氧组(49.2%±5.99%)无显著差异(P=0.36)。
2.3 副溶血弧菌失活率
第一阶段通入臭氧质量浓度为0 mg/L、5 mg/L、15 mg/L、20 mg/L,确定第一阶段VP达到不能被检测水平的剂量区间为0~5 mg/L;第二阶段通入臭氧质量浓度为0 mg/L、1 mg/L、2 mg/L、3 mg/L、4 mg/L、5 mg/L,确定臭氧通入量为0~2 mg/L;第三阶段臭氧质量浓度分别为0 mg/L、0.25 mg/L、0.5 mg/L、0.75 mg/L、1 mg/L、1.25 mg/L、1.5 mg/L、1.75 mg/L、2 mg/L,臭氧剂量为2 mg/L时水体中108CFU/mL的副溶血弧菌无法被检测到(图3)。
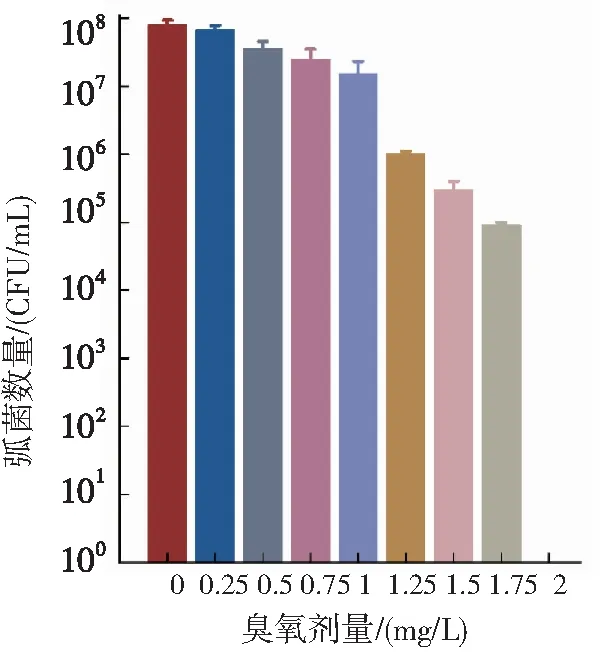
图3 不同臭氧投加剂量水体内副溶血弧菌浓度
3 讨论
3.1 臭氧安全阈值试验的必要性
选择适宜的臭氧投加量对提高净化处理效率有重要意义[34]。有研究表明在臭氧7~ 10 mg/L 时,去除1 mg TOC 所需臭氧剂量约为0.1~ 0.2 mg[35]。Good等[36]建议根据施用的饲料或根据鱼类饲料比例的变化自动调节臭氧[37]。据报道,RAS的臭氧剂量使用范围较广,臭氧与饲料为3~24 g O3/kg的比例投入较为合适[38]。养殖对象的安全性也是确定臭氧应用范围的因素之一,过量的臭氧残余会影响养殖物种的安全。如Reise等[39]为海水养殖品种大菱鲆(Psettamaxima)和太平洋白虾(Litopenaeusvannamei)设定了0.06 mg/L的残余臭氧量作为安全阈值以保证养殖生物的安全。过量的臭氧导致养殖生物畸形,降低幼苗孵化率和存活率[40]。因此,探究不同臭氧剂量对MBBR硝化效率及副溶血弧菌杀菌效果的影响,明确臭氧作为环境消毒剂的有效浓度有重要意义。
3.2 臭氧对MBBR生物膜细胞死亡率的影响
臭氧剂量高于4 mg/L时,生物膜上细胞死亡率比对照组有显著提高;臭氧剂量在2 mg/L及以下时,臭氧对滤料生物膜上死亡率影响不显著(表1)。Schulte等[41]总结了生物膜细菌免受强氧化性物质杀灭的机制,如扩散作用、胁迫响应、生物膜特异性表型等。这可能与细菌本身产生的胞外聚合物(EPS)有关[42]。EPS由细菌本身产生,氧化剂可与EPS组分反应[43],限制了氧化剂扩散,使其成为保护生物膜的高效屏障。此外,生物膜产生的降解酶助于氧化剂的降解[36],同时可保护自身所包含的细菌免受环境的影响[44]。而且嵌入生物膜基质中的固定化细菌对消毒剂的抵抗力是相应悬浮细胞的10 ~1000倍[45]。因此,与水中微生物群相比,生物膜上固着的微生物群受水处理的影响较小[46]。
3.3 臭氧对水体TAN去除效率的影响
臭氧通入量在4 mg/L及以上时硝化反应受到抑制(表2)。以往的研究主要集中在臭氧残余量上,根据冷守琴等[47]研究,4 mg/L臭氧投加量对应残余臭氧为0.5 mg/L。与本研究类似, Pumkaew等[48]报道了在0.4 mg/L的臭氧残余量下抑制了氨氧化过程。连续臭氧处理产生的微粒和溶解有机物对MBBR有损害[49],导致硝化作用减弱[50],这解释了本研究高浓度臭氧通入量显著抑制总氨氮去除率的结果。本研究中2 mg/L臭氧通入量(对应残余臭氧质量浓度为0.2 mg/L[47])对硝化性能影响不显著。与AOB和NOB连续长期暴露在臭氧残余质量浓度为0.15 mg/L环境下不会对细菌硝化性能产生负面影响的结果相似[51]。臭氧由于其强氧化性作用,低浓度臭氧可促进有机物形成絮凝体,高浓度则可直接将其氧化[52]。有机物作为异养细菌来源,有机物降低,自养细菌生态位扩张,降低了异养细菌对自养细菌的竞争力[53],因此臭氧的使用可以改善硝化性能。值得注意的是,臭氧的氧化性无选择性,因此需要关注臭氧的安全使用范围。不同臭氧剂量的推荐可能与试验条件和生物膜活性的不同有关。本试验仅探究了臭氧通入剂量达到相应浓度的即时影响,后期可补充在长期臭氧条件下对MBBR的作用效果,养殖对象对氨氮与臭氧的耐受性和敏感性由养殖对象的大小和种类等因素决定[55],未来应针对不同养殖生物在不同臭氧剂量下的影响探究,以便实际生产中参考。
3.4 臭氧对副溶血弧菌失活率的影响
在臭氧投入量为2 mg/L的 TCBS平板上无法观察到副溶血弧菌。在MBBR池中由于曝气的作用,滤料运动碰撞会增加弧菌与水中臭氧发生反应[56],因此臭氧在低剂量下也可有效进行杀菌消毒。而在高剂量臭氧通入下杀菌消毒作用没有进一步增加,这与Park等[57]研究结果一致。臭氧的有效浓度因微生物物种、生长期和密度不同而不同[58],不同细菌病原体消毒效率取决于浓度、细菌种类和水基质[59-61]。Teige等[62]指出,用臭氧将水中氧化还原电位调节至 350 mV的时无法完全消除凡纳滨对虾RAS系统中的弧菌属,尤其是VP。Schneider等[61]指出3 mg/L臭氧处理再循环人工海水2 h使贝类弧菌数量平均减少了3个对数单位,且在净化过程中不会对贝类产生不利影响。因为臭氧可穿透副溶血弧菌,使酶失活,降解gDNA和总RNA的遗传物质,最终杀灭副溶血弧菌[63]。实际养殖过程中由于残饲、粪便等原因,水体中含有一定浓度的溶解有机物[65],臭氧可氧化水体中的溶解有机物[64],消耗一定的臭氧,降低臭氧对病原微生物的杀灭效果。在实际使用时应考虑氧化有机物而消耗的臭氧量,综合平衡水质改良效果、养殖动物安全和弧菌杀灭效果等条件确定臭氧最适浓度。
4 结论
2 mg/L的臭氧通入量对MBBR生物膜硝化能力无显著影响,对副溶血弧菌有显著杀灭作用。4 mg/L及以上的臭氧通入量显著降低MBBR的TAN去除效率。综合考虑MBBR硝化能力,滤料细胞死亡率,副溶血弧菌失活率,推荐MBBR池使用2 mg/L臭氧投加量。未来应进一步探究臭氧在实际生产中对MBBR产生的影响,为臭氧的安全高效利用提供更优解的方案

