代谢综合征与慢性阻塞性肺疾病之间的关系
杨秋生 许能銮 邓宏莉
(福建省立医院感染性疾病科,福建 福州 350000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是发生率较高的一类慢性肺部疾病。COPD急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)的发生可加速肺功能恶化,增加住院患者的病死率,给医疗卫生保健机构和社会经济造成巨大的负担[1]。COPD全球倡议建议临床医师评估COPD严重程度时需考虑共病的存在,包括心血管疾病、代谢综合征(metabolic syndrome,MS)、糖尿病、肺癌、骨质疏松和精神疾病等[2]。MS是一组代谢紊乱的临床症候群,发病率在COPD患者中比正常人群更高,对呼吸功能和生活质量会产生负面的影响[3]。但MS是由多种组分构成的一种综合征,在实际临床实践中能达到诊断MS标准的COPD患者并不多,大多患者只存在其中1个或2个组分,各个独立的组分与COPD的肺功能变化有关[4]。本研究回顾性分析福建省立医院2014年1月至2017年12月收治的249例AECOPD患者的临床资料,比较不同MS组分数量的患者之间临床差异特点,并探讨其发生Ⅱ型呼吸衰竭的危险因素。
1 对象与方法
1.1 一般资料 选取2014年1月至2017年12月我院收治的AECOPD患者,根据纳入与排除标准排除不适用病例后,最终纳入249例病例。纳入标准:每例患者皆与COPD与AECOPD诊断标准相符。排除标准:支气管哮喘;严重支气管扩张;5年内的恶性肿瘤病史;气胸;活动性肺结核、肺梗死、矽肺、间质性肺炎;严重的肝肾功能不全者;未行或无法行肺功能检查者。
1.2 方法 病史资料收集以下内容。①一般情况:性别、年龄、身高、体质量、COPD病程、住院费用、住院时间、吸烟指数。②慢性基础疾病:高血压、高血糖、脂代谢异常、心力衰竭、冠状动脉粥样硬化。③实验室检查:血常规、肺功能、血气分析指标、三酰甘油(triglyceride,TG),低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C),高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C),载脂蛋白A(apolipoprotein A,ApoA),载脂蛋白B(apolipoprotein B,ApoB)。若与下述3项或3项以下相符,即可对MS加以确诊:超重与(或)肥胖,高脂紊乱,高血压,高血糖。按照MS合并数量将AECOPD患者进行分组:Normal组(不具有任何MS组分特征)、Factor 1组(具有MS组分中1个特征)、Factor 2组(具有MS组分中2个特征)、Factor 3组(具有MS组分中≥3个特征)。血气分析指标PaO2在60 mm Hg以下,同时PaCO2在50 mm Hg以上,就可确诊Ⅱ型RF。在年龄、性别与吸烟指数方面,4组差异无统计学意义(P>0.05)。本次研究经过本院医学伦理委员会同意。
1.3 统计学处理 统计学分析的工具为SPSS 22.0,对于呈正态分布的计量数值,用描述,组间对比实施单因素方差分析;若为非正态分布,通过中位数(四分位数间距)描述,组间对比实施非参数检验。计数资料用n(%)表述,用χ2检验,组间对比采用经由二元logistic回归分析对AECOPD发生Ⅱ型RF的危险因素展开探究,P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况 249例病例中Normal组89例,Factor 1组93例,Factor 2组43例,Factor 3组24例。最常见的MS组分是高血压(43.8%),其次是糖代谢异常(20.1%),超重或肥胖占(16.1%),最少的患病率是高三酰甘油血症(10.8%)。不同组间在冠状动脉粥样硬化发生率、住院时间、慢性心力衰竭(CHF)发生率、住院费用方面皆表现出显著区别(P<0.05)。见表1。
2.2 组间实验室指标比较 空腹血糖、载脂蛋白A、TG与HDL-C组间表现出显著区别(P<0.05)。见表2;不同组间其他临床实验指标未见明显区别(P>0.05)。见表2。

表2 实验室检查结果比较
2.3 Ⅱ型呼吸衰竭二元logistic回归分析 对和Ⅱ型RF存在联系的因素开展多因素二元logistic回归,结果显示高血糖、重度及极重度气流阻塞、低白蛋白是AECOPD发生Ⅱ型呼吸衰竭的危险因素(P<0.05)。见表3。
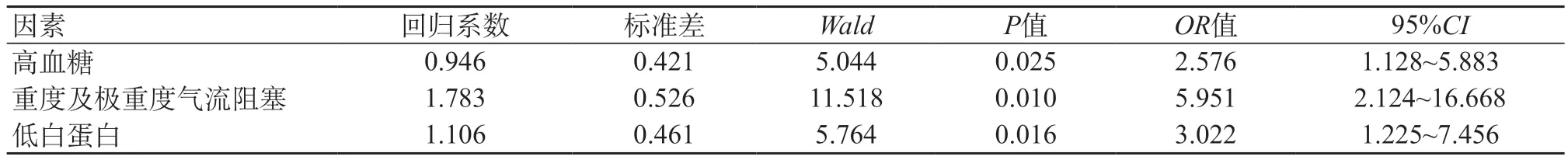
表3 多因素二元logistic回归分析
3 讨论
MS已成为全球公共卫生问题,会增加2型糖尿病、冠状动脉疾病及中风等疾病的风险。本研究结果显示,随着MS组分数增加,AECOPD患者进入重症监护室比例从2.4%增加至18.2%,当COPD合并的MS组分数越多,肺功能损害越大,出现急性加重时肺功能代偿能力越差,进入重症监护室可能性越高,住院时间和住院费用也随之增加。MS导致COPD患者气道症状加重的机制可能是:以胰岛素抵抗为基础的MS其胰岛素可能抑制毒蕈碱受体导致气道过度收缩[4];瘦素和脂联素失衡,加重过敏源刺激引起的嗜酸细胞和巨噬细胞聚集,加重气道炎症和重塑[5]。当COPD合并不同MS组分数量时,COPD严重程度、预后会受到不同程度影响,死亡风险增加。
高血压在此次研究中是MS组分中发生率最高的疾病,占43.8%,高血糖占20.1%,为第2个常见的合并症。COPD最常见的合并症是高血压,高血糖是第2个常见的合并症[6]。在COPD人群中高血压患病率比正常人群高,可因为长效β受体激动剂、全身性类固醇激素的使用,缺氧导致RAAS激活造成[7]。COPD的全身性炎症增加糖尿病患病率:肿瘤坏死因子干扰葡萄糖代谢和胰岛素敏感性,增加新发糖尿病风险;IL-6、CRP对糖尿病的发展具促进作用;类固醇吸入制剂的使用、久坐的生活方式及吸烟导致的氧化应激也可增加高血糖的发生风险[8]。
本研究发现,TG、LDL-C、ApoB与MS组分数量呈正相关,HDL-C、ApoA与之呈负相关,心血管疾病的患病率与MS组分数量呈正相关。MS的全身炎症状态可导致脂代谢异常,对心血管疾病、COPD产生间接影响。分析原因可能因巨噬细胞吞噬LDL-C导致脂质沉淀丝裂原活化蛋白激酶转导的细胞内信号级联反应,促进肺部的炎症[9]。而AECOPD的缺氧、继发性红细胞增多、肺气肿、肺动脉高压、β受体激动剂及糖皮质激素的应用是心血管疾病的恶化、死亡的危险因素[10]。因此,对于合并有MS组分的COPD人群,应监测脂类代谢、积极地进行心血管疾病评估和预防。
本研究对显示合并高血糖是AECOPD患者发生Ⅱ型RF的危险因素。糖尿病增加细菌感染的风险,中性粒细胞的趋化、吞噬作用介导肺泡毛细血管膜的破坏、通透性增加,同时对气道结构的影响和破坏,促进气道炎症和气道结构变化,增加急性发生风险[11];同时神经病变导致膈肌神经传导速度降低,肺通气下降[12];胰岛素抵抗使肌肉中蛋白质合成减少、呼吸肌力量下降及运动障碍,降低呼吸功能[13]。以上原因可使COPD患者出现二氧化碳潴留。高血糖作为MS的一个组分,是COPD患者病情恶化和死亡的危险因素,因此当COPD患者合并糖尿病,更应密切的临床随访。同时本研究发现合并低白蛋白的AECOPD病例发生Ⅱ型RF风险增高,与低白蛋白水平与COPD发生呼吸衰竭相关性研究的结果一致[14]。低白蛋白血症导致免疫球蛋白减少、多形核白细胞和单核细胞功能低下,减低宿主防御系统,增加感染风险[14]。负氮平衡使得肌肉萎缩,减弱呼吸肌肉力量,引发呼吸功能不全。且低白蛋白可能提示患者处于长期慢性炎症状态,进行性的肺部损伤增加Ⅱ型RF的可能[15]。白蛋白对AECOPD患者来说不仅与营养状态、免疫功能有关,还与呼吸衰竭风险相关。
综上所述,随着AECOPD患者合并MS组分数量增加,心血管合并症增加,进入重症监护室的概率更高。低白蛋白水平、基础肺功差以及高血糖是AECOPD患者发生Ⅱ型RF的独立危险因子。

