偏头痛经颅磁刺激治疗的研究进展
贺麟媛,潘永惠,侯岳,刘妮
偏头痛是一种常见的神经系统疾病,临床特点为发作性中重度、搏动样头痛,疼痛多为单侧,常伴有恶心、呕吐和/或对光和声音极度敏感等[1-2]。该疾病在全球范围内患病率达15%,其中欧洲国家最高,约为35%,中国偏头痛患病率为9.3%。这是一种多见于女性及青年的疾病,男女比例1∶3,35~39岁为其高发年龄区间[3-4]。偏头痛被认为是导致残疾的主要原因之一,根据2019年全球疾病负担数据[5]显示,该疾病在致残性疾病中位居第二,超过其他神经系统疾病的总和。偏头痛的确切机制尚不明确,主流学说包括血管学说、三叉神经血管系统学说、皮质扩散抑制学说、炎症介质学说、基因遗传学说等[6]。
药物治疗是偏头痛最常见的治疗策略,分为缓解疼痛的急性治疗和减少发作的预防性治疗,包括非甾体抗炎药、麦角胺制剂、曲坦类药物、β受体阻滞剂、钙通道调节剂、抗抑郁药等,但这些药物并非针对偏头痛而设计,从而有着不可忽视的缺陷和局限,例如疗效欠佳、产生不良反应、出现药物依赖、患者依从性差等,长期的药物治疗还可能引起药物过度使用性头痛[7]。降钙素基因相关肽(CGRP)在偏头痛的病理生理学中起到关键作用,近年来由此研发的抗CGRP药物被认为是偏头痛迈向精准治疗的重要节点[8]。多数偏头痛患者最终发展为慢性病程导致终生患病,给患者的日常生活和工作学习带来负面影响,同时对社会造成严重的经济负担,考虑到药物治疗的诸多问题,非药物治疗领域受到越来越多的关注,并已取得初步成果。
神经调控技术是指通过有创或无创的方式,利用物理或化学手段,对神经系统进行调控的技术。其中,经颅磁刺激(TMS)因其治疗有效、非侵入的方式、高安全性等特点,在国内外已有许多将其应用于偏头痛治疗的报道。
1 TMS技术
20世纪80年代,Barker等[9]将磁场线圈放置在人类运动区所对应的头皮上,记录到受试者对侧手上的运动诱发电位(MEP),这一结果被视作首次的TMS。TMS技术以电磁感应与电磁转换原理为基础:发生器产生的高压电流作用于刺激线圈产生磁场,后者无衰减地穿过导电不良的颅骨作用于大脑皮质及外周神经,以唤起刺激部位神经元的动作电位,影响脑内代谢和神经电活动,从而引起一系列化学反应。TMS主要有以下几种模式:单脉冲TMS(sTMS)、成对脉冲TMS(ppTMS)、重复TMS(rTMS)、配对关联刺激(PAS)、模式化rTMS(prTMS)。在临床治疗中,以rTMS和theta爆发式刺激(TBS)(模式化重复刺激的一种)模式多见[10-11]。
这是一种无创、无痛,且几乎没有不良反应的治疗方式,临床中通常将其用来治疗多种神经及精神类疾病。
2 偏头痛的TMS治疗
TMS用于缓解疼痛已有许多报道,近年来研究者们发现TMS在偏头痛患者中也有着不错的疗效,多项研究[12-18]证实了其在偏头痛治疗中的重要作用,TMS治疗偏头痛的不同方案主要体现在治疗靶点、刺激频率等的不同(表1)。
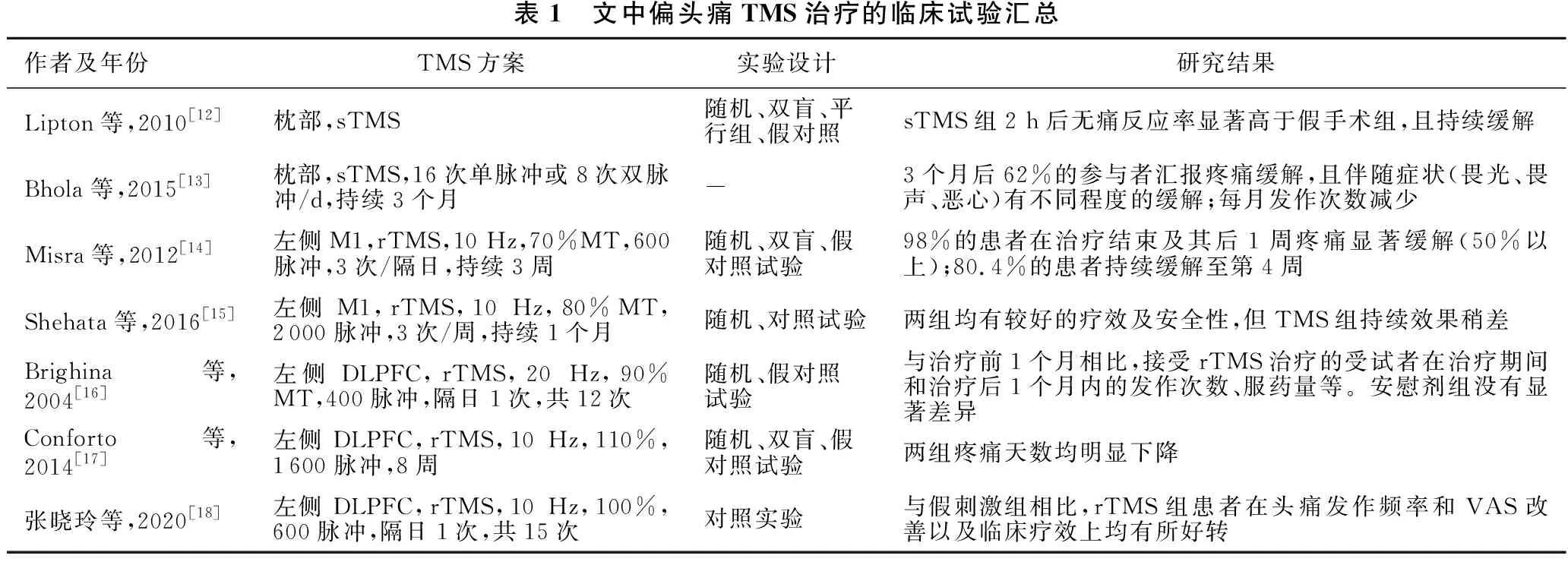
表1 文中偏头痛TMS治疗的临床试验汇总作者及年份TMS方案实验设计研究结果Lipton等,2010[12]枕部,sTMS随机、双盲、平行组、假对照sTMS组2 h后无痛反应率显著高于假手术组,且持续缓解Bhola等,2015[13]枕部,sTMS,16次单脉冲或8次双脉冲/d,持续3个月-3个月后62%的参与者汇报疼痛缓解,且伴随症状(畏光、畏声、恶心)有不同程度的缓解;每月发作次数减少Misra等,2012[14]左侧M1,rTMS,10 Hz,70%MT,600脉冲,3次/隔日,持续3周随机、双盲、假对照试验98%的患者在治疗结束及其后1周疼痛显著缓解(50%以上);80.4%的患者持续缓解至第4周Shehata等,2016[15]左侧M1,rTMS,10 Hz,80%MT,2000脉冲,3次/周,持续1个月随机、对照试验两组均有较好的疗效及安全性,但TMS组持续效果稍差Brighina等,2004[16]左侧DLPFC,rTMS,20 Hz,90%MT,400脉冲,隔日1次,共12次随机、假对照试验与治疗前1个月相比,接受rTMS治疗的受试者在治疗期间和治疗后1个月内的发作次数、服药量等。安慰剂组没有显著差异Conforto等,2014[17]左侧DLPFC,rTMS,10 Hz,110%,1600脉冲,8周随机、双盲、假对照试验两组疼痛天数均明显下降张晓玲等,2020[18]左侧DLPFC,rTMS,10 Hz,100%,600脉冲,隔日1次,共15次对照实验与假刺激组相比,rTMS组患者在头痛发作频率和VAS改善以及临床疗效上均有所好转
2.1 枕叶sTMS 偏头痛包括两种主要形式:有先兆偏头痛和无先兆偏头痛。先兆症状通常在头痛前出现,多表现为可逆的局灶性神经缺损症状,尤其以视觉先兆最为常见。一些证据[19-20]表明偏头痛患者存在发作期和发作间期视觉皮质兴奋性的改变,提示视觉系统在偏头痛中起着重要作用。枕叶TMS用于偏头痛急性期或先兆期的治疗已经得到认可,2013年,一种手持式皮质sTMS仪被美国食品和药物管理局批准用于缓解先兆偏头痛的急性发作[21],枕叶sTMS也可以用于偏头痛的预防治疗[22-23]。
皮质扩散性抑制(CSD)是一种发生在神经元和神经胶质细胞上的缓慢传播的去极化波,与偏头痛先兆症状有密切联系[24-25]。Lloyd等[26]的研究认为阻止偏头痛患者皮质CSD可能是sTMS治疗偏头痛的机制之一,而并非影响血管张力:在去极化诱导所致的CSD动物模型中,sTMS增加了其CSD诱导阈值,但这种作用在GABA拮抗剂存在时却并未发生,这提示sTMS阻止CSD可能是通过抑制GABA能活性而不是直接抑制谷氨酸能活性达到的。sTMS还被证明显著抑制丘脑皮质的自发神经元活动,并影响三叉丘脑通路的痛觉诱发活性——被认为是治疗偏头痛的关键,这种调节可能具有阿片能成分[27-28]。一项随机、双盲、平行、假对照试验[12]证明sTMS对先兆偏头痛患者的急性偏头痛治疗有效,该研究显示sTMS组2 h后无痛反应率显著高于假刺激组,且于24 h及48 h后仍有效。英国的一项sTMS治疗急性偏头痛的试验[29]中,190例患者使用便携式TMS仪完成了3个月的治疗并接受了所有随访调查,该研究结果显示患者在疼痛程度、疾病发作频率、偏头痛伴随症状如畏光、畏声等方面均显著改善;值得一提的是,包括3例孕妇在内无不良反应报告。
2.2 rTMS rTMS是指在某一特定部位给予重复刺激的过程,这种规律并重复的刺激不仅可以在被刺激皮质局部产生累积效应,还能影响到该部位功能相关的远隔区域的大脑功能。同时rTMS所产生的生物学效应在时间上也有延续性,刺激停止后其作用仍可持续一段时间,这种长时程效应被认为与突触可塑性密切相关。不同频率的rTMS对神经兴奋性的调节作用不同,高频率rTMS(>1 Hz)易化局部神经元活动,使大脑皮质兴奋性增加,低频rTMS(≤1 Hz)抑制局部神经元活动,降低大脑皮质兴奋性[10]。
2.2.1 初级运动皮质高频率rTMS 初级运动皮质M1被认为是最经典的疼痛治疗靶点,rTMS的循证指南[29]指出,高频率rTMS刺激疼痛对侧M1区具有A级阵痛效果。Nuguyen等[30]的综述指出,有创的硬膜外初级运动皮质刺激(MCS)产生的阵痛效果可能与调节丘脑皮质通路以及递质释放有关,而对于rTMS来说,当线圈平行于中线放置(前后方向)时产生I波,此时类似于MCS阴极电刺激,起到缓解疼痛的作用。Hirayama等[31]使用导航引导的rTMS对M1及其周围皮质如中央后回、运动前区和辅助运动区进行刺激,结果显示仅有M1体现出良好的阵痛效果,证实了M1区在治疗疼痛方面的突出作用。印度的一项研究[14]对难治性偏头痛患者左额叶进行高频率(10 Hz)rTMS刺激,结果显示该研究中98%的患者在治疗结束1周头痛次数减少超过50%,第4周时仍有80.4%的患者持续改善。Shehata等[15]纳入29例慢性偏头痛患者,随机分为两组,其中14例接受左侧M1区高频(10 Hz)rTMS治疗;另外15例患者接受肉毒毒素注射,结果显示,rTMS组中10例患者(71.4%)报告在经过4~5次治疗后头痛频率和严重程度降低75%,而肉毒毒素组在注射第3周结束时才有相近比例的患者——11例(73.3%)得到了相同的结果,第4周随访发现两组参与者头痛频率及头痛程度均显著降低且无明显组间差异,而在第6周和第8周时,rTMS组患者上述参数差异变得不显著;相反,肉毒毒素注射组仍具有显著差异。
2.2.2 前额叶背外侧高频率rTMS 大脑前额叶背外侧(DLPFC)是rTMS常用刺激部位之一。DLPFC是一个具有复杂功能的大脑区域,涉及认知、情感和感觉处理等,功能影像学研究[32]发现DLPFC参与调节急性疼痛,并在成功干预慢性疼痛之后显示出结构和功能异常的逆转,表明DLPFC是疼痛调节的关键节点。rTMS刺激前额叶背外侧起到阵痛作用的机制尚不完全明确,但与M1不同的是,刺激DLPFC所带来的镇痛效果并非通过内源性阿片能引起,这提示M1与DLPFC对疼痛的缓解由不同的机制介导[33]。Fierro等[34]将高频率rTMS应用于左侧DLPFC,发现该方案可在辣椒素诱导的疼痛中起到镇痛作用,且能恢复因疼痛而引起的运动皮质兴奋性变化,证实了高频rTMS激活左侧DLPFC可以缓解疼痛。另一项荟萃分析[35]也指出,高频率rTMS刺激左侧DLPFC在慢性疼痛及诱发性疼痛中具有潜在镇痛效应。临床研究发现刺激DLPFC用于治疗偏头痛也取得了一定效果,Brighina等[16]将11例慢性病偏头痛患者随机分成治疗组和对照组,应用高频rTMS刺激左侧DLPFC,结果显示在治疗中及治疗后1个月,治疗组偏头痛发作频率、用药情况及头痛指数均明显改善,而对照组在治疗前后无明显变化。张晓玲等[18]利用TMS技术对左额叶背外侧区进行刺激,治疗结束后rTMS组患者头痛发作率及视觉模拟评分(VAS)相比假刺激组均显示出明显改善,差异具有统计学意义(P<0.05)。Saltychev等[36]的荟萃分析表示,与假刺激相比,rTMS似乎对偏头痛的严重程度和发作频率都有积极的影响。但此方案也存在争议,一项双盲、随机的研究[17]报告了不一样的结果,该研究将参与者随机分为真刺激组和假刺激组,事后分析显示在假刺激组中,头痛天数的平均下降为>50%,表明安慰剂的有效性,但疼痛强度在两组的改善程度相似。相比M1区,2019年发表的INS-NANS专家共识小组将高频率rTMS刺激DLPFC分级为不确定性[37]。
3 TMS应用于偏头痛机制的研究与治疗效果的评价
TMS技术的应用十分广泛,偏头痛患者具有皮质兴奋性周期性变化的特点,是偏头痛的病理生理机制之一[38]。利用TMS技术可以获得MEP和视觉诱发电位(VEP)等指标,通过其阈值、振幅等体现出运动皮质及视觉皮质的兴奋性从而研究偏头痛的皮质机制[39]。TMS技术不仅被用于偏头痛的治疗及发病机制的研究,还有望为偏头痛的治疗效果提供客观指标。光幻视阈值(PT)是指能够引起视幻觉的最小刺激强度,Young等[40]观察接受左乙拉西坦治疗的偏头痛患者,利用TMS检测PT,将发作频率与PT值相关联,发现在药物治疗期间PT值升高,头痛频率与PT值呈负相关,可以侧面说明患者视皮质兴奋性降低,提示治疗的有效性。另一项研究[41]于29例患者中调查了PT与运动阈值,指出相比未治疗组,预防治疗组患者头痛频率下降,PT值升高,该研究认为PT可适用于评估预防治疗对患者皮质兴奋性的影响。
4 小结与展望
综合现有的研究,在偏头痛先兆期或急性期多对患者进行枕叶单脉冲刺激,而在偏头痛发作间期则主要采用高频率刺激M1或左侧DLPFC的治疗方案。学者们认为对于偏头痛的治疗不应该仅仅关注头痛症状,偏头痛的治疗须是全面、综合的治疗,例如伴随疾病的改善等。作为精神疾病重要的辅助治疗手段之一,不难发现,TMS治疗精神障碍相关疾病与治疗头痛症状之间存在部分相同靶点,由此可认为该技术能使偏头痛患者得到除头痛症状外的其他症状,如焦虑抑郁情绪等的治疗。随着病程的延长,约35%~72%的偏头痛患者出现眩晕、恶心、不稳等前庭症状,由此,前庭性偏头痛(VM)这一概念被提出。尽管目前还没有研究证实TMS可缓解VM症状,但已有将TMS用于治疗遗传性脊髓小脑共济失调[42]等疾病的报道,这提示TMS治疗VM存在极大可能。TMS技术已经过百十年的发展,但仍有庞大的进步和探索空间,尽管该技术的安全性已经被广泛认可,但疗效却具有不确定性和异质性,治疗机制也并不明确,客观证实TMS治疗的有效性才能更广泛地推广这一技术。TMS的治疗效果往往与刺激线圈的形状、大小,刺激部位、方案参数有密切关联,因此基于患者个体的精准治疗也尤为重要,未来在线圈设计、最佳方案的确定、精准定位等方面也需要借助更多的方式,从而更大程度地制定个体化治疗方案。作为一种十分有前景的治疗方式,TMS仍需要更多、更大基数的研究,以期更好地服务患者。

