肝硬化患者肌少症的发生机制及诊疗进展
张兴会, 郑梦瑶, 杨晋辉
昆明医科大学第二附属医院消化内科, 昆明 650101
1 肌少症在肝硬化患者中的流行情况
肝硬化是指在各类肝炎病毒、酒精、代谢障碍、自身免疫系统功能紊乱、药物、毒物、血吸虫及一些不明原因的病因下导致肝损伤,随着损伤的进一步加重,使得肝细胞坏死,肝结节再生、纤维结缔组织增生,最终形成以假小叶为病理特征的病变;肝硬化早期为代偿期较为隐匿,未引起足够重视,大多数患者来就诊时已达到肝硬化失代偿期,死亡率极高,寻找影响肝硬化预后的因素,得到广大学者的重视,例如肌少症。肌少症最初是1989年由希腊科学家罗森·伯格提出,描述与年龄相关的肌肉质量和数量进行性、广泛性下降的增龄性疾病。随着研究的深入,发现在肝硬化患者中肌少症发生率极高,肌少症会增加患者发生跌倒、残疾、失能等身体功能下降的风险。综合国内外对肝硬化与肌少症的研究发现,肌少症可受多种危险因素的影响,例如性别、种族、年龄、躯体疾病、评估工具及选取的诊断标准,有研究[1-2]显示在肝硬化患者中肌少症的发病率为23% ~ 70%。
2 肌少症的诊断要点
当前用于肌肉质量的测量工具有双能X线吸收法(DEXA)、生物电阻抗方法(BIA)、核磁共振、电子计算机断层扫描(CT),CT是目前在肝硬化患者中识别肌少症比较公认的方法,可以不受腹水的影响,准确地评估切面的肌肉和脂肪含量,价格便宜,也是常用在肝硬化患者中监测病情变化的检查之一;肌力评估的手段主要有手握力测试和椅立实验,其中手握力测试最为常用;身体体能是指在日常生活中独立完成生活任务的能力,常用的方法有步速测定和简易身体状况量表(SPPB)。
3 肌少症的诊断标准
肌少症受人种的不同,定义、诊断及标准有所不同,表1、2总结了AWGS和EWGSOP2的诊断标准与常见的评价工具。
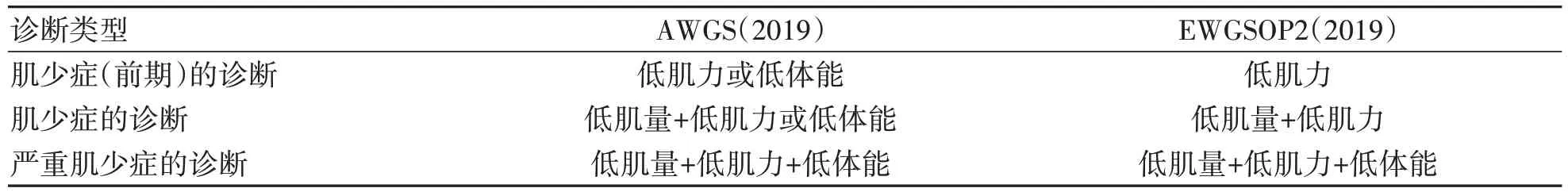
表1 肌少症诊断标准的区别Table 1 Diagnostic difference of sarcopenia

表2 AWGS(2019)和EWGSOP2(2019)肌少症的常用工具诊断标准Table 2 Common diagnostic criteria of AWGS (2019) and EWGSOP2 (2019) for sarcopenia
4 肌少症在肝硬化患者中的发生机制
4.1 营养不良和摄入减少 营养不良是肝硬化常见的并发症之一,是肝硬化患者病死率增加的独立危险因素[7]。摄入不足是发生肌少症的主要原因,正常生命机体在存活状态时需要多种生命营养物质的参与,但在肝硬化患者中营养摄入不达标,临床中患者常有厌食、恶心、呕吐、味觉改变、意识状态改变、限盐、禁食、长期饮酒,食物摄入较正常人明显减少,因此较正常人更容易发生肌少症。
4.2 高氨血症 营养物质分解、骨骼肌消耗等途径导致氨在体内蓄积,而支链氨基酸的消耗仍在进行,形成高氨血症。高氨血症可以诱导肌生成抑制素的表达[8],肌生成抑制素是由肌细胞分泌,属于TGF-β家族成员,具有强大的自分泌抑制功能,肌生成抑制素介导途径通过mTOR信号通路抑制骨骼肌生长,导致肌肉量减少,而肌生成抑制素通过调节NF-κB信号通路提高肌分泌抑制素的表达[9],并且高氨血症会介导肌肉发生自噬,降低肌肉的收缩能力,加速发生肌少症[10]。
4.3 激素水平异常 肝硬化是处于一种获得性的激素抵抗状态,导致性激素、胰岛素、维生素D等激素减少,而骨骼肌作为人体的内分泌器官,激素分泌异常时对骨骼肌也有影响。Sinclair等[11]研究发现男性肝硬化患者中高达90%的患者睾酮水平较低,睾酮可以刺激肌肉卫星细胞的有丝分裂,增加细胞数量[12],肌肉卫星细胞的增殖和分化是肌肉生长的前提;在肝硬化患者中,肝细胞和肌肉组织产生的IGF-1明显减少,IGF-1与BCAA一起通过PKB、AKT激活mTOR通路,参与蛋白质合成和肌肉卫星细胞增殖[13]。睾酮、IGF-1合成减少后,导致蛋白质合成减少,因此更容易发生肌少症。
4.4 线粒体功能障碍及氧化损伤 线粒体功能障碍被认为是发生肌少症的主要原因之一[14]。Romanello等[15]研究认为当线粒体发生功能障碍时,导致ATP平衡紊乱,AMPK作为能量感受器可以激活FOXO3及诱导C2C12在肌管中萎缩基因的表达,同时线粒体功能障碍会产生大量的活性氧导致肌肉萎缩。肝硬化患者中也同样存在线粒体能量及功能代谢障碍,途径与线粒体对肌少症的影响相似[16]。
4.5 系统性炎症和内毒素 在肝硬化患者中脓毒症和普通感染比正常人群更为常见,是患者发生病情恶化和死亡的常见原因。肌少症与炎症之间的关系早已在多项研究中得到证实,较高水平的炎症标志物与肌肉质量和数量呈负相关[17],CRP、IL-6、TNF-α是临床上常用且容易获取的炎症标志物,TNF-α作为慢性炎症标志物和内分泌刺激因子,会导致肌肉收缩功能障碍,并且TNF-α会促进肌肉释放出活性氧和一氧化氮抑制肌纤维,进一步导致肌肉萎缩,IL-6已经被证明可以打破线粒体能量稳态和减缓肌肉合成,即通过NF-κB促进炎症细胞对肌肉的浸润造成肌肉损伤导致肌肉萎缩[18];有研究[19]指出血清CRP水平升高与肌少症有关,但其相关机制未进行阐明。
4.6 胆汁淤积 胆汁淤积作为营养不良原因之一,其机制特殊且复杂,长期持续的胆汁淤积使肝脏进展为肝纤维化或肝硬化,影响脂肪和脂溶性维生素A、D、E、K的吸收。Abrigo等[20]通过对野生型(含TGR5)小鼠和TGR5(基因缺陷型)雄性小鼠的研究中也发现胆汁酸和脱氧胆酸在TGR5受体诱导下而发生肌少症。另一项通过行胆道结扎进行造模的小鼠实验[21]发现,当胆道结扎时小鼠发生肌少症的风险增加;经检索后发现关于胆汁淤积与肌少症的相关研究较少,需要开展进一步的深入研究。
4.7 泛素-蛋白酶体途径及肌肉自噬 泛素-蛋白酶体途径是肌肉蛋白质水解的主要途径,肌肉蛋白质水解在肝硬化中是常见并发症[8,22]。泛素-蛋白酶体途径包括E3型泛素连接酶、Atrogin-1和MuRF-1,而后两者是发生肌少症的主要途径。其中Atrogin-1主要降解蛋白质合成途径中的翻译起始因子,导致蛋白质合成不能完成,MuRF-1主要通过降解肌球蛋白重链、肌肉蛋白等肌肉的结构蛋白,导致肌肉质量下降[23]。肌肉自噬是程序性细胞死亡的生理过程,可以降解蛋白质及细胞器,泛素-蛋白酶体途径及应激激活自噬途径[8],自噬发生时,线粒体等细胞器也在发生死亡,从而发生肌少症,在对肌少症与自噬的研究中也提到自噬的激活会导致骨骼肌萎缩[24]。
4.8 维生素D缺乏 人体可以吸收利用的维生素D被称为活性维生素D,与维生素受体结合后,结合维甲酸X受体形成转录因子复合体,作用于靶器官参与钙磷代谢、肌肉功能调节,也参与调控C2C12肌管形成[25];活性维生素D在RAS和PKCα依赖性丝氨酸磷酸化下激活Raf-1,进而激活AMPK信号使肌细胞增殖;通过小鼠实验[26]发现,维生素D缺乏后通过诱导泛素蛋白酶体途径使肌肉蛋白发生降解;在对小鼠的另一项实验[27]中敲除维生素D受体后,且维生素D也缺乏时可以观察到实验组小鼠肌肉容积减小、肌纤维变小,但肌生成抑制素增加,补充钙、磷酸盐后仍存在肌少症。以上表明维生素D与肌少症之间存在关联。
4.9 利尿剂的使用 肝硬化患者处于失代偿期时,由于门静脉高压及营养等问题,发展成难治性腹水,难治性腹水的治疗中会频繁大剂量使用利尿剂。有研究[28]纳入226例肝硬化患者研究使用袢利尿剂对患者肌肉蛋白的消耗和其对患者预后的影响,发现袢利尿剂>20 mg与病死率独立相关,并且这种关系与肝病严重程度无关,其机制在Mandai等[29]的研究中发现可能与钠钾氯共转运蛋白1有关;同样在心衰患者中也发现使用袢利尿剂与骨骼肌萎缩有关[30];在慢性肾脏病的研究[31]中,使用袢利尿剂被认为是发生肌少症的危险因素。以上研究表明利尿剂的使用与肌少症有关,但利尿剂的使用剂量与肌少症之间的定量关系还有待深入研究。
综上所述,总结肌少症在肝硬化患者中的发生机制见图1。
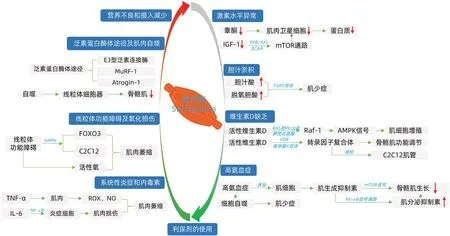
图1 肌少症在肝硬化患者中的发生机制Figure 1 Mechanisms of sarcopenia in patients with liver cirrhosis
5 肌少症对肝硬化患者的影响
肝硬化患者因并发症频繁住院,在应激及制动等因素影响下,肌少症对患者的影响贯穿全程。刘晓龙等[32]发现肌少症组发生并发症较无肌少症组频率高;一项回顾性研究[33]进行了长达6年的随访,发现肌少症组的总体病死率高于非肌少症组;在一项荟萃分析[34]中,肌少症是肝硬化患者死亡的独立危险因素,且亚洲人相较于西方人肌少症相关死亡风险更高;上述研究表明肌少症是影响肝硬化患者近期及长期预后的重要因素。
6 治疗
目前临床上将改变生活方式结合药物干预用于肝硬化患者肌少症的治疗,常用的主要有以下几种方法。
6.1 补充维生素D 维生素D可通过阻止细胞氧化应激,保护线粒体,促进钙的吸收,有研究[35]提出每日补充维生素D对预防肌少症具有明显疗效;也有研究[36]认为补充维生素D对肌少症的影响既有有利的一面,但也存在危害性,甚至增加跌倒风险,但其具体机制仍不明确,因此,是否补充维生素D对肝硬化患者来说应慎重。
6.2 降氨治疗 肝性脑病作为肝硬化失代偿期最严重的并发症,有研究[37]使用利福昔明和L-鸟氨酸L-天冬氨酸降氨处理可以逆转肌少症;肌肉注射或三餐后口服支链氨基酸(缬氨酸、异亮氨酸、亮氨酸)可以增加肌肉质量,提高血清白蛋白水平,平衡营养状态[38];但另一项研究[39]以运动、饮食、药物等手段治疗肌少症的基础上加入支链氨基酸后发现并不能改善肌少症,未来需要更多研究加以证实。
6.3 体育锻炼 每周3 ~ 4次的体育锻炼对改善肌少症有积极作用,如抗阻运动、有氧运动,有研究[40]对肝硬化合并肌少症的患者进行12周的阻力训练管理后,肌肉力量及数量得到提升;有氧运动可增加ATP的产生,促进线粒体功能,例如太极拳、八段锦,对身体平衡也有改善。但就肝硬化患者而言,应充分考虑门静脉高压的危险性。
6.4 激素补充 雄激素可以增加肌肉质量,在睾酮水平较低的患者中,使用睾酮对增加肌肉质量有明显效果,还观察到睾酮可以增加该类人群的存活率[11]。生长激素、生长激素释放激素、胰岛素样生长因子可促进细胞增殖分化、骨骼发育及组织蛋白质合成,有研究[41]对患者使用12个月生长激素释放肽模拟物mk-677后,观察到肌肉质量增加,且耐受性较好,但长期使用有增加患前列腺癌、心血管、组织水肿、内分泌紊乱和精神疾病的风险。
6.5 营养治疗 增加营养是防止肌少症的关键,尤其是蛋白质,在肌少症的治疗中,欧洲和国内的指南均推荐摄入1.2 ~ 1.5 g·kg-1·d-1的蛋白质可以改善肌肉功能,既往临床治疗肝性脑病时会限制蛋白的摄入,但最新的研究也指出发生肝性脑病时应早期开始补充蛋白,很多研究者认为睡前加餐对改善肌少症也有帮助[42],Hey等[43]的研究指出补充左旋肉碱、W-3多不饱和维生素、维生素、锌等对肌少症有效,但仍需要临床验证。
6.6 利尿剂的合理使用 有研究[44]显示使用螺内酯可以防止骨骼肌细胞丢失,增加镁和钠钾泵,提高肌肉收缩能力,但是该研究是在动物和慢性心衰患者中开展的,且螺内酯属于RASS拮抗剂,其本身具有改善心功能预后的作用,不确定是螺内酯利尿后心功能增强从而改善骨骼肌,还是因为螺内酯本身对骨骼肌量的改善;另外一项使用托伐普坦对袢利尿剂和醛固酮拮抗剂治疗肝腹水不应答的研究[45]发现,托伐普坦可减缓失代偿期肝硬化患者肌肉减少的进展并改善预后。因此,在临床实践中对于肝腹水患者,结合发生肌少症的风险,权衡后再对患者予以利尿处理很有必要。
7 小结
肌少症在肝硬化患者中的发生机制复杂。虽然肌少症的定义、诊断等得到了逐步的完善和修订,但仍没有统一的标准。大多数研究表明肌少症是影响肝硬化患者预后和治疗的重要因素,目前从营养、运动、激素、药物等多个维度治疗,但是干预效果有限,且各种研究结论不一致,因此肝硬化肌少症的治疗任重而道远,未来还需更多前瞻性、大样本、多中心的研究进一步验证。现阶段,在治疗原发病的同时,也应该关注患者是否存在肌少症,尽早予以有限的干预措施,制订个体化的治疗方案,以期提高肝硬化患者的生活质量,改善患者预后。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:张兴会负责查阅文献、资料分析、图表制作、撰写论文;郑梦瑶参与修改论文;杨晋辉指导撰写文章并最后定稿。

