肝硬化患者非肿瘤性门静脉血栓形成的相关危险因素分析
刘天府, 王亮, 张岭漪
兰州大学第二医院肝病科, 兰州 730030
门静脉血栓(portal vein thrombus,PVT)是指门静脉主干和/或分支的管腔内血栓形成,是肝硬化的常见并发症之一。PVT包括非肿瘤性PVT和恶性肿瘤并发门静脉瘤栓。据报道,肝硬化患者1年、3年和5年的非肿瘤性PVT发生率分别为1.6%、6.0%和8.4%[1]。PVT形成可加重肝硬化患者的肝功能障碍,导致顽固性腹水、食管胃底静脉曲张破裂出血和肠道血栓性缺血等门静脉高压不良事件,并对进一步肝移植造成困难[2]。目前肝硬化非肿瘤性PVT的病因尚不明确。本研究回顾性分析肝硬化患者非肿瘤性PVT形成的相关影响因素,筛选早期预测因子,以期为临床医生早期识别PVT提供参考。
1 资料与方法
1.1 研究对象 纳入2021年7月1日—2022年6月30日于本院肝病科住院治疗的肝硬化非肿瘤性PVT患者作为PVT组,另收集同期资料完整的肝硬化无PVT患者作为对照。肝硬化诊断参照2019年版《肝硬化诊治指南》[3]中的诊断标准进行判断。PVT诊断依据超声和/或计算机断层扫描血管造影的结果进行判断。纳入标准:明确诊断为肝硬化,有PVT相关检查资料,且有完整的临床及随访资料。排除标准:合并肝内或肝外恶性肿瘤、Budd-Chiari综合征、其他血栓栓塞性疾病。
1.2 研究方法 查阅所有纳入研究患者的病史、辅助检查结果。记录一般资料,包括性别、年龄、肝硬化病因、脾脏切除史、食管胃底静脉曲张出血史、食管胃底静脉曲张内镜下治疗史、肝性脑病史、腹水及自发性腹膜炎发生史、是否服用非选择性β受体阻滞剂(NSBB)等。记录凝血指标:蛋白C、蛋白S、凝血酶原时间(PT)、国际标准化比值(INR)、D-二聚体(D-dimer)、纤维蛋白原(FIB);血常规:白细胞(WBC)、血红蛋白(HGB)、血小板(PLT);生化指标:总胆红素(TBil)、丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、谷氨酰转肽酶(GGT)、碱性磷酸酶(ALP)、胆碱酯酶(ChE)、总蛋白(TP)、白蛋白(Alb)、尿素氮(BUN)、肌酐(Cr)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)及门静脉内径和门静脉流速的结果。凝血指标使用美国Werfen公司生产的ACL TOP 750 LAS全自动凝血分析仪检测,生化指标使用Roche公司Cobas 8000全自动生化分析仪检测。
1.3 统计学方法 应用SPSS 25.0软件进行统计分析。正态分布的计量资料以表示,两组间比较采用成组t检验;非正态分布的计量资料以M(P25~P75)表示,两组间比较采用Mann-WhitneyU检验。计数资料两组间比较采用χ2检验。使用多因素Logistic回归模型分析肝硬化发生PVT的影响因素,并通过受试者工作特征曲线分析各变量对PVT的预测效能。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共纳入肝硬化非肿瘤性PVT患者50例,其中男23例,中位年龄52.0岁;对照组100例患者中男57例,中位年龄53.5岁。PVT组与对照组性别、年龄、肝硬化病因、Child-Pugh分级、MELD评分比较,差异均无统计学意义(P值均>0.05)(表1),具有可比性。
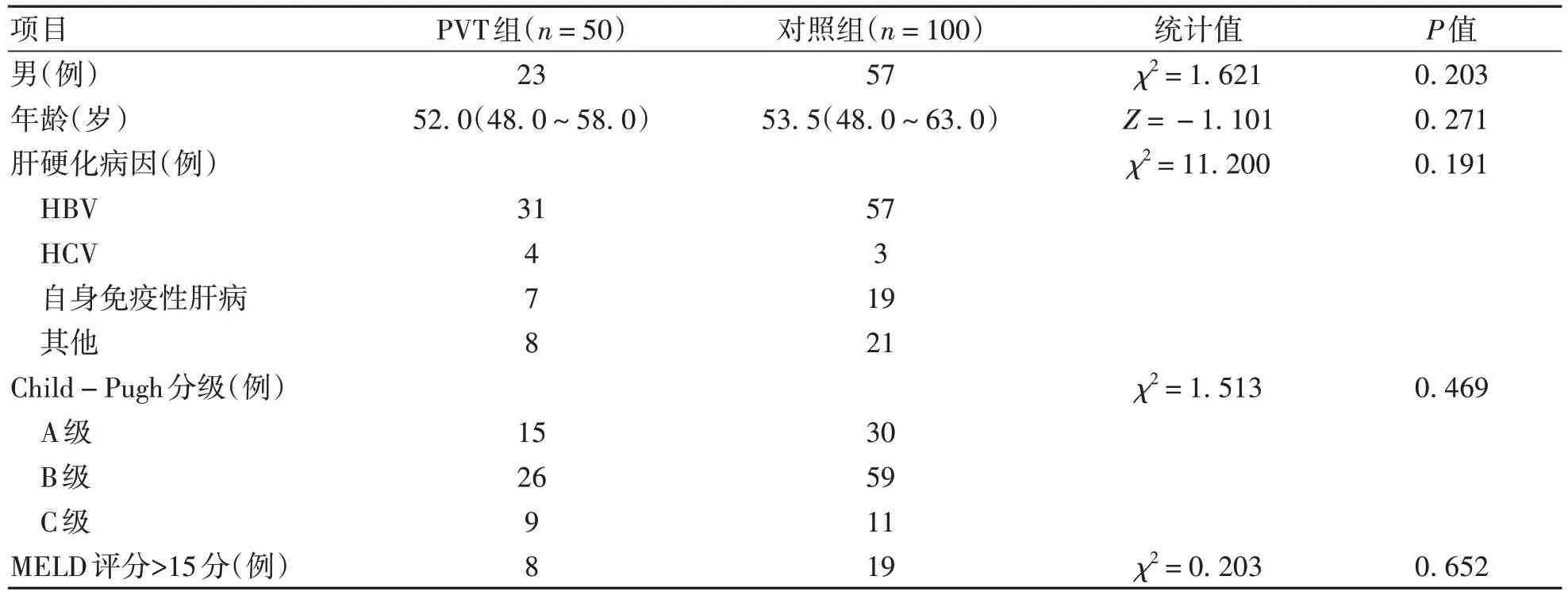
表1 PVT组与对照组患者的一般资料比较Table 1 Comparison of general data between PVT group and control group
2.2 单因素分析 PVT组与对照组患者比较,脾脏切除史、食管胃底静脉曲张内镜下治疗史、肝性脑病史、服用NSBB以及D-dimer、HGB、TG水平差异均有统计学意义(P值均<0.05)(表2)。
2.3 多因素分析 将可能与PVT形成有关的影响因素如脾脏切除史、食管胃底静脉曲张内镜下治疗史、肝性脑病史、服用NSBB、D-dimer、HGB进行多因素Logistic回归模型分析。单因素分析两组患者间TG水平虽有统计学差异,但均在正常范围,故未纳入多因素分析。结果显示,D-dimer水平、脾脏切除史、肝性脑病史、服用NSBB是肝硬化患者PVT形成的独立危险因素(表3)。绘制受试者工作特征曲线分析以上独立危险因素的预测效能,结果显示D-dimer的曲线下面积最高(0.721),其次为脾脏切除史(0.625)。
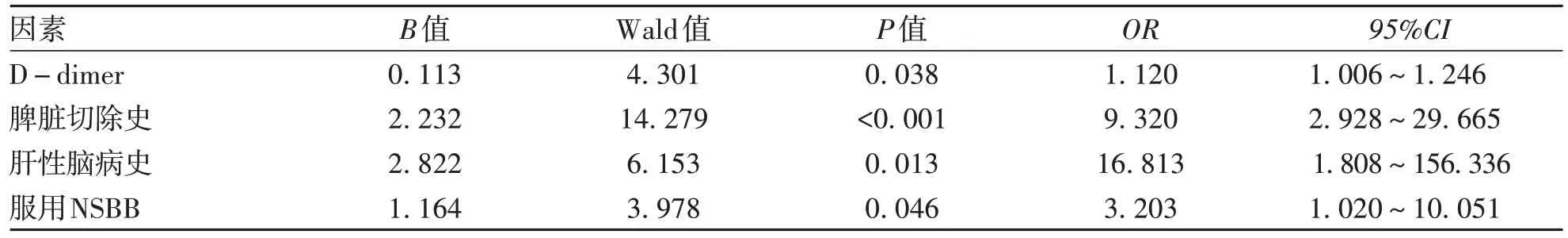
表3 Logistic回归分析肝硬化并发PVT形成的影响因素Table 3 Multivariate Logistic regression analysis of risk factors of liver cirrhosis complicated with PVT
3 讨论
近年来,国内外有多项针对肝硬化非肿瘤性PVT形成机制和影响因素的研究。由于不同研究纳入肝硬化患者的病因、肝功能严重程度、资料完整程度各异,报道的影响因素也存在差异。大部分研究认为,Virchow静脉血栓形成的三要素适用于解释肝硬化PVT的形成机制,包括血液高凝状态、局部血管损伤和血流缓慢[2,4-5]。本研究结果显示D-dimer水平、脾脏切除史、服用NSBB以及肝性脑病史是肝硬化患者发生非肿瘤性PVT的独立危险因素(P值均<0.05)。
高凝状态在肝硬化PVT形成中的作用存在争议。肝硬化以低凝为主的传统观念已被打破。更多证据表明,肝硬化凝血系统中促凝血因子和抗凝血因子的平衡极不稳定,可能随时会转向高凝或低凝[4-6]。抗凝血因子在凝血平衡中发挥重要作用,主要包括蛋白C、蛋白S和抗凝血酶。蛋白C和蛋白S均由肝细胞合成,肝功能受损患者常伴有抗凝蛋白水平下降。蛋白S作为蛋白C和维生素K依赖的凝血酶-血栓调节蛋白复合体的辅助因子,可选择性地抑制活化形成的凝血因子Ⅴ和Ⅷ。此外,D-dimer来源于纤溶酶溶解的交联纤维蛋白凝块,是纤溶亢进的敏感指标。一些研究表明,蛋白C、蛋白S和抗凝血酶水平降低以及D-dimer和凝血因子Ⅷ水平升高是肝硬化PVT的危险因素[7-10]。2020年Hung等[11]研究发现,伴有PVT的肝硬化患者普遍存在蛋白S减低,蛋白S水平是失代偿期肝硬化患者发生PVT的独立危险因素。本研究结果显示,D-dimer水平是肝硬化患者PVT形成的独立危险因素,预测价值较高;而蛋白C和蛋白S水平在两组患者中无统计学差异。然而,Chen等[12]研究发现,促凝血因子和抗凝血因子失衡可能不是导致肝硬化患者PVT形成的因素。在贾继东教授团队[13]的研究中,根据Child-Pugh分级比较了伴和不伴PVT的肝硬化患者的蛋白C和蛋白S水平。结果显示,两组患者的蛋白C和蛋白S水平无显著差异。因此,肝硬化患者PVT的发生与凝血功能的关系,仍有待进一步探讨。
脾脏切除术是我国肝硬化PVT最常见的局部血管损伤因素。我国学者Qi等[14]研究发现,脾脏切除术后发生PVT的风险增加10倍以上,且PVT的程度更严重。本研究结果显示,脾脏切除是肝硬化患者PVT形成的独立危险因素,与以往的报道一致。一些研究发现食管胃底静脉曲张的内镜下治疗也可导致血管内皮损伤,与PVT的发展有关,但也有研究认为两者没有关联[4]。原因可能与选择的治疗方式不同有关,其中硬化剂和组织胶治疗可引起血管全层损伤,与PVT的发生关系更密切[15-16]。本研究中有内镜下治疗史的13例患者中,10例为单纯食管静脉曲张套扎术,仅3例使用硬化剂和组织胶治疗,结果显示内镜下治疗不是PVT发生的独立危险因素。不同内镜下治疗方式与PVT的关系需进一步扩大样本研究证实。
血流速度减慢是血栓形成的关键因素之一。多项研究[17-18]发现,门静脉血流速度<15 cm/s是预测肝硬化患者发生PVT的重要指标。本研究对行门静脉彩超检查的82例患者的门静脉内径和门静脉血流速度进行单因素分析,结果显示PVT组与对照组的门静脉血流速度比较差异有统计学意义(χ2=-2.774,P=0.006),因资料不全,未行多因素分析。除肝硬化的严重程度对门静脉血流变学影响以外,用于预防静脉曲张出血的NSBB也会降低门静脉血流速度。一项Meta分析[19]显示,服用NSBB的肝硬化患者PVT发生风险增加4.62倍。本研究中使用的NSBB均为卡维地洛片。研究结果显示,服用NSBB是肝硬化患者PVT形成的独立危险因素。然而,Nery等[20]通过前瞻性研究发现,服用NSBB的肝硬化患者门静脉血流速度和心率下降与发生PVT的风险没有相关性。Noronha Ferreira等[21]的前瞻性研究中,使用NSBB与PVT的发生有关,但不是PVT发生的独立预测因子。这可能因为NSBB通常用于预防中重度食管胃底静脉曲张患者的出血事件,此类患者门静脉高压程度更重,发生PVT的风险更高。因此,NSBB和PVT之间的关系仍需进一步研究。
此外,本研究还发现肝性脑病史是肝硬化患者发生PVT的独立危险因素。笔者无法完全解释肝性脑病与PVT发生的机制,一方面可能与肝性脑病患者肝功能障碍增加有关;另一方面,肝性脑病患者有更多的门体分流,门静脉血流量减少,可能有利于PVT的形成。这一结果与近期国外的两项研究[22-23]结果一致。肝性脑病史是否可以成为肝硬化非肿瘤性PVT形成的预测因子,尚需要更多研究加以证实。
综上所述,肝硬化患者非肿瘤性PVT的形成受多个因素影响,不同研究中危险因素存在差异。本研究显示,D-dimer水平升高、脾脏切除史、肝性脑病史、服用NSBB是肝硬化患者非肿瘤性PVT发生的独立危险因素。在今后的临床工作中,对存在上述因素的肝硬化患者,应重点关注PVT的发生,争取早发现、早治疗,改善预后。但本研究存在一定的局限性:本研究为回顾性研究,门静脉内径和血流速度数据有缺失;样本量较小,未来需要大样本、多中心的研究进一步探讨PVT发生的预测因子。
伦理学声明:本研究方案于2022年10月20日经由兰州大学第二医院伦理委员会审批,批号:2022A-699。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:刘天府负责实施研究过程,采集整理数据,设计论文框架,起草论文,修订论文;王亮参与研究数据的获取分析解释过程,提供指导性支持;张岭漪参与起草和修改文章关键内容,终审论文。

