茶叶中21种吡咯里西啶生物碱检测方法研究
万静宜,冯 超,陈宇航,徐 骞,林元杰,乐孙阳,卢大胜,邱歆磊
(上海市疾病预防控制中心,上海 200336)
吡咯里西啶生物碱(Pyrrolizidine alkaloids,PAs)是植物所产生的次生代谢产物,含有该物质的植物广泛分布在世界各地,目前已在6 000多种植物中检出近600多种不同的PAs及其氮氧化物(PANOs)[1]。摄入高剂量PAs可能导致肝脏损伤,动物实验发现其具有遗传毒性和致癌性,吡咯啶环的1,2位为双键的PAs 被称为肝毒性吡咯里西啶生物碱(HPAs),在临床上可导致肝窦阻塞综合征(HSOS)[2-5]。茶叶是全球消费最广泛的饮料之一,其本身不含有PAs,但因茶园中存在含有PAs的植物,可能通过土壤、水等环境循环造成茶树根部吸收从而污染茶叶,同时部分茶园在采摘过程中使用机器收割代替人工采摘可能混入含PAs的杂草从而造成污染[6-8]。
2020年,欧盟发布相关条例规定PAs在茶叶和调味茶中的限量为150 µg/kg,该限量为21种PAs的总和[9-10]。随着欧盟法规颁布,茶叶中PAs的检测越来越受到关注。目前PAs的主要检测方法包括液相色谱法[11]、免疫吸附法[12]、液相色谱-质谱联用法[13-15]等,其中液相色谱法的检测灵敏度较低,无法对微量或痕量的目标物进行准确检测,适用于中草药这类PAs 含量较高的样品;免疫吸附法虽能够快速检测,但无法准确定量;而高效液相色谱-质谱联用法具有灵敏度高[16]、适用范围广、选择性强、操作方便等优点,是国际上普遍采用的分析方法[17-19]。目前,我国有关茶叶中PAs检测研究的报道较少,且文献报道的检测目标物未能涵盖欧盟法规要求的21种化合物[14]。我国作为茶叶生产与出口大国,亟需建立一种目标物能够涵盖欧盟限量标准的准确、高效、批量筛查茶叶中PAs的检测方法。
本文采用高效液相色谱-串联质谱(HPLC-MS/MS)法对促黑激素、石松胺、促黑激素N-氧化物、石松胺N-氧化物和千里光碱等欧盟限量标准中21种PAs进行检测,可为茶叶等植物源性产品中PAs的来源、组成及风险评估提供技术依据。
1 实验部分
1.1 仪器、试剂与材料
Infinity 1290 高效液相色谱-串联Agilent 6490 三重四极杆质谱仪(美国Agilent 公司)、Milli-Q 型超纯水系统、EZ-2 溶剂蒸发工作站(英国GeneVac 公司)、Vortex 3 涡旋混合仪(德国IKA 公司)、分析天平(Mettler Toledo公司)、高速冷冻离心机(德国Eppendorf公司)。
甲醇(色谱纯,Fisher公司);硫酸(优级纯,上海柯灵斯公司);甲酸(质谱级,Fisher公司);其他试剂均为分析纯;实验用水为GB/T 6682-2008[20]规定的一级水。21 种待测物标准品均购于上海源叶公司。
PTFE 微孔滤膜(13 mm×0.22 µm)、Bond Elut Plexa PCX 固相萃取小柱(200 mg/6 mL,安捷伦公司)、Waters Oasis MCX 固相萃取小柱(150 mg/6 mL,沃特世公司)、Waters Oasis HLB 固相萃取小柱(150 mg/6 mL,沃特世公司)。
1.2 标准溶液配制
标准储备溶液(1 000 mg/L):准确称取10 mg(精确至0.1 mg)各PAs 标准品,用甲醇溶解并定容至10 mL,得到质量浓度为1.0 mg/mL 的标准储备溶液,置于-18 ℃下低温避光保存,使用时根据需要混合稀释。
1.3 样品前处理
提取:称取 2.0 g(精确至0.01 g)试样置于50 mL 聚丙烯离心管中,加入20 mL 0.05 mol/L 硫酸,涡旋振荡10 min 后静置过夜,4 ℃下以10 000 r/min 离心5 min,移取10 mL 上清液至15 mL 聚丙烯离心管中。
净化:使用5 mL甲醇和5 mL 0.05 mol/L 硫酸活化PCX 固相萃取小柱,取10 mL样品上清液通过活化后的PCX 固相萃取小柱,并用5 mL 甲醇和5 mL 水淋洗,再用10 mL 5%氨水甲醇洗脱。收集全部洗脱液浓缩至近干,10%甲醇水定容至0.50 mL,涡旋振荡1 min,过0.22 µm滤膜后进样分析。
1.4 仪器条件
1.4.1 色谱条件色谱柱:Phenomenex Kinetex F5(150 mm×3.0 mm×2.6 µm);柱温:40 ℃;流动相:A 为甲醇,B 为0.1%甲酸水;流速:0.3 mL/min;进样量:2 µL。梯度洗脱程序:0~1 min,10%~15%A;1~6 min,15%~20% A;6~18 min,20%~50% A;18~24 min,50%~70% A;24~26 min,70%~80% A;26~26.2 min,80%~10% A;26.2~27 min,10% A。
1.4.2 质谱条件离子源:ESI(+);毛细管电压:3 000 V;鞘气温度:250 ℃;鞘气流速:11 L/min;干燥气温度:200 ℃;干燥气流速:14 L/min;雾化气压力:138 kPa(20 psi);检测方式:多反应监测(MRM)。各化合物的保留时间、母离子、子离子和碰撞能量见表1。
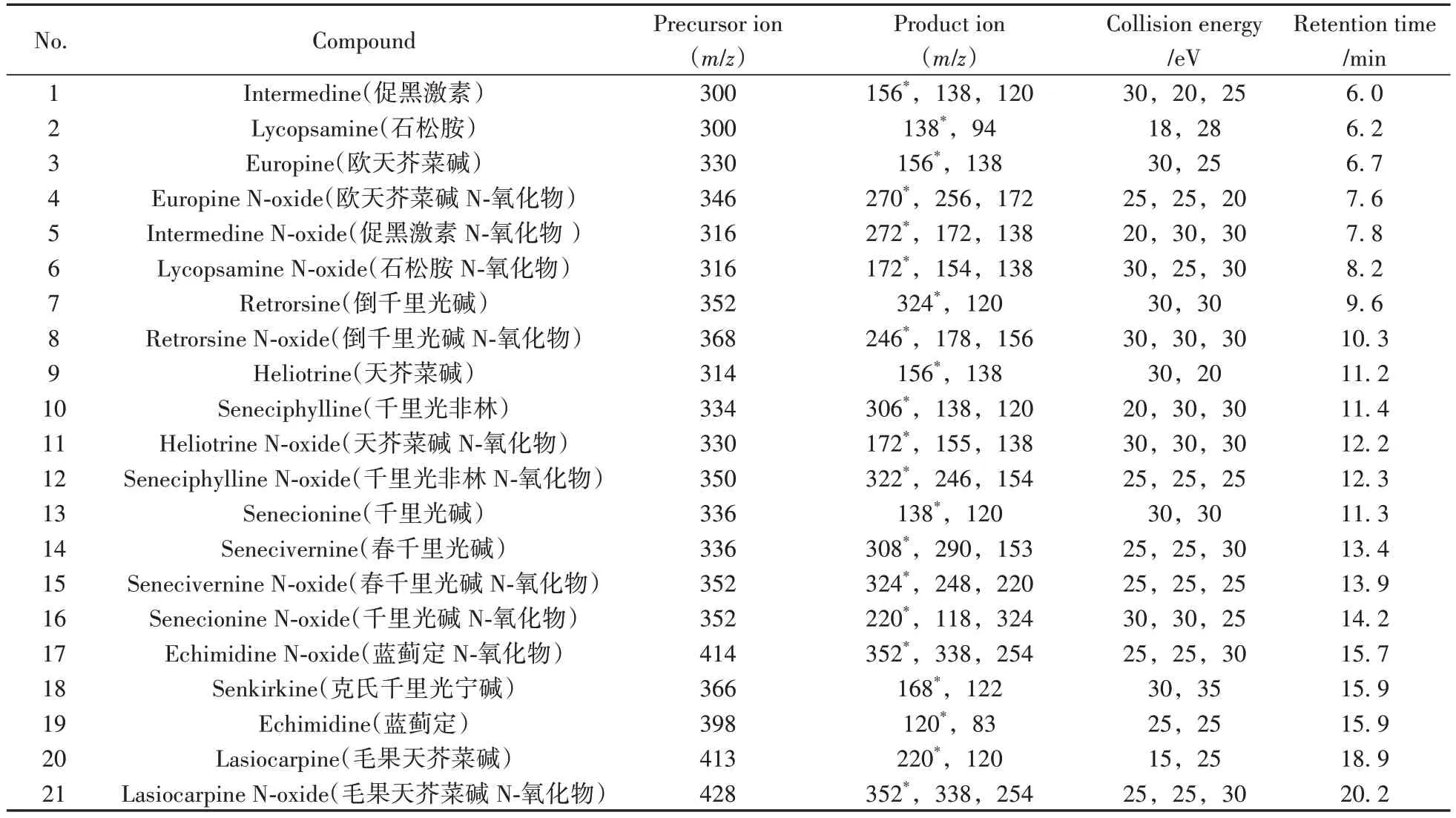
表1 21种吡咯里西啶生物碱的质谱参数与保留时间Table 1 MRM parameters and retention times of 21 pyrrolizidine alkaloids
2 结果与讨论
2.1 色谱条件优化
由于促黑激素与石松胺的质谱碎片一致,两者无法在质谱MRM模式下进行分离,需通过色谱分离后进行定量检测。国内外研究主要使用C18色谱柱对PAs 进行分离[13-14,17]。五氟苯基色谱柱(F5)为基于核-壳技术的五氟苯基丙基固定相色谱柱,对同分异构体的选择性较好,因此对比了Waters ACQUITY BEH C18柱(100 mm×2.1 mm×1.7 µm)与Phenomenex Kinetex F5 色谱柱(150 mm×3.0 mm×2.6 µm)对21种PAs的分离效果。结果表明,使用Waters ACQUITY BEH C18(100 mm×2.1 mm×1.7 µm)无法有效分离促黑激素与石松胺。Kinetex F5 色谱柱对促黑激素与石松胺同分异构体的分离效果更好,且其余19 种化合物均能实现基线分离。因此,本研究选择Phenomenex Kinetex F5 色谱柱,21 种PAs 的色谱图见图1。
2.2 前处理方法优化
2.2.1 提取溶剂PAs是一类还原性生物碱,其氧化形式(PANOs)也属于极性分子,易被极性有机溶剂或稀释后的酸化水溶液提取[15-16,21]。考虑到日常生活中人们的泡茶习惯,本实验选取1款实际绿茶样品,比较了0.05 mol/L 硫酸、60 ℃水、80 ℃水及沸水4 种提取溶剂对检测结果的影响。结果显示,上述溶剂检出的PAs 总量分别为85.4、55.6、64.1、60.3 µg/kg,0.05 mol/L硫酸的提取效率最高,这可能是由于硫酸水溶液提高了样品中PAs 的离子化效率。因此,本研究选用0.05 mol/L 硫酸作为提取溶剂。
2.2.2 净化方式国内外研究主要使用MCX 固相萃取小柱、PCX 固相萃取小柱和HLB 固相萃取小柱对样品进行净化处理[14-15,21]。本实验比较了Bond Elut Plexa PCX 固相萃取小柱(200 mg/6 mL)、Waters Oasis MCX 固相萃取小柱(150 mg/6 mL)和Waters Oasis HLB 固相萃取小柱(150 mg/6 mL)对绿茶加标样品的净化效果(见图2)。结果显示,21 种PAs 采用上述萃取柱净化的回收率分别为65.2%~107%、62.4%~105%和46.6%~105%,PCX柱与MCX柱的总体回收率接近,但千里光非林、千里光非林 N-氧化物、千里光碱与春千里光碱采用PCX 柱净化的回收率比MCX 柱高10%以上,故选择Bond Elut Plexa PCX柱作为前处理的净化柱。
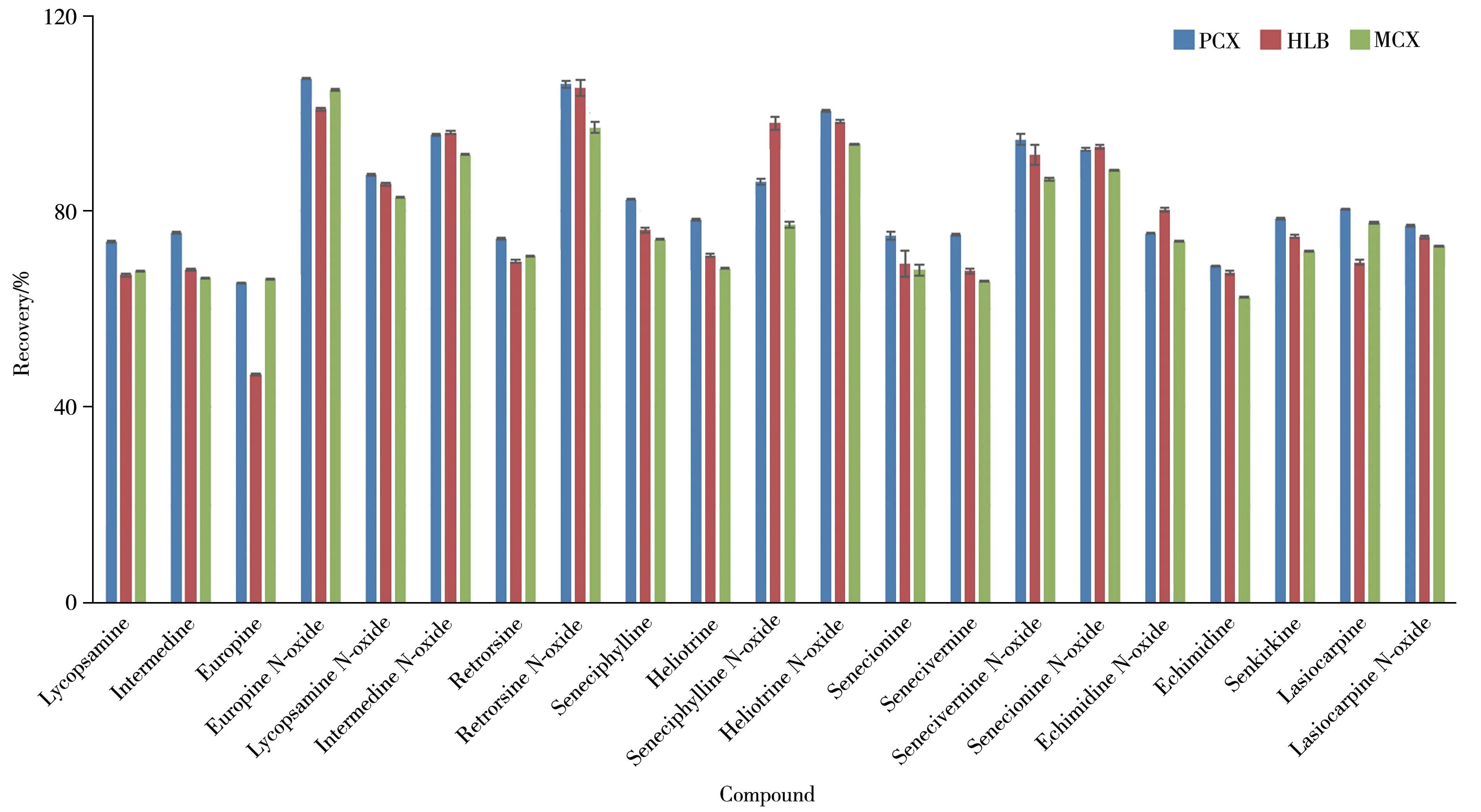
图2 不同SPE净化柱的回收率比较Fig.2 Comparison of recoveries of different SPE purification cartridges
2.2.3 SPE 洗脱条件经前期实验,本研究选择5%氨水甲醇作为洗脱溶剂,为了更好地平衡洗脱效率和洗脱体积,对洗脱体积(6~11 mL)进行了优化。结果显示,随着洗脱体积的增加,21 种PAs 的回收率总体呈增加趋势;10 mL 5%氨水甲醇的洗脱效果达到最佳,21 种PAs 的回收率为74.3%~98.6%,洗脱体积为11 mL与10 mL时目标物的回收率无较大差异。因此选择洗脱体积为10 mL。
2.3 方法评价
2.3.1 基质效应、线性关系与检出限本研究通过比较溶剂标准曲线与基质匹配标准曲线的斜率评估基质效应(ME)[22]。计算公式:ME =B/A× 100%(其中A为溶剂标准曲线斜率,B为基质匹配标准曲线斜率)。表2结果显示,21种PAs的基质效应为14.3%~153%,表明大部分化合物存在基质抑制效应,因此采用基质匹配标准曲线对目标物进行定量分析。
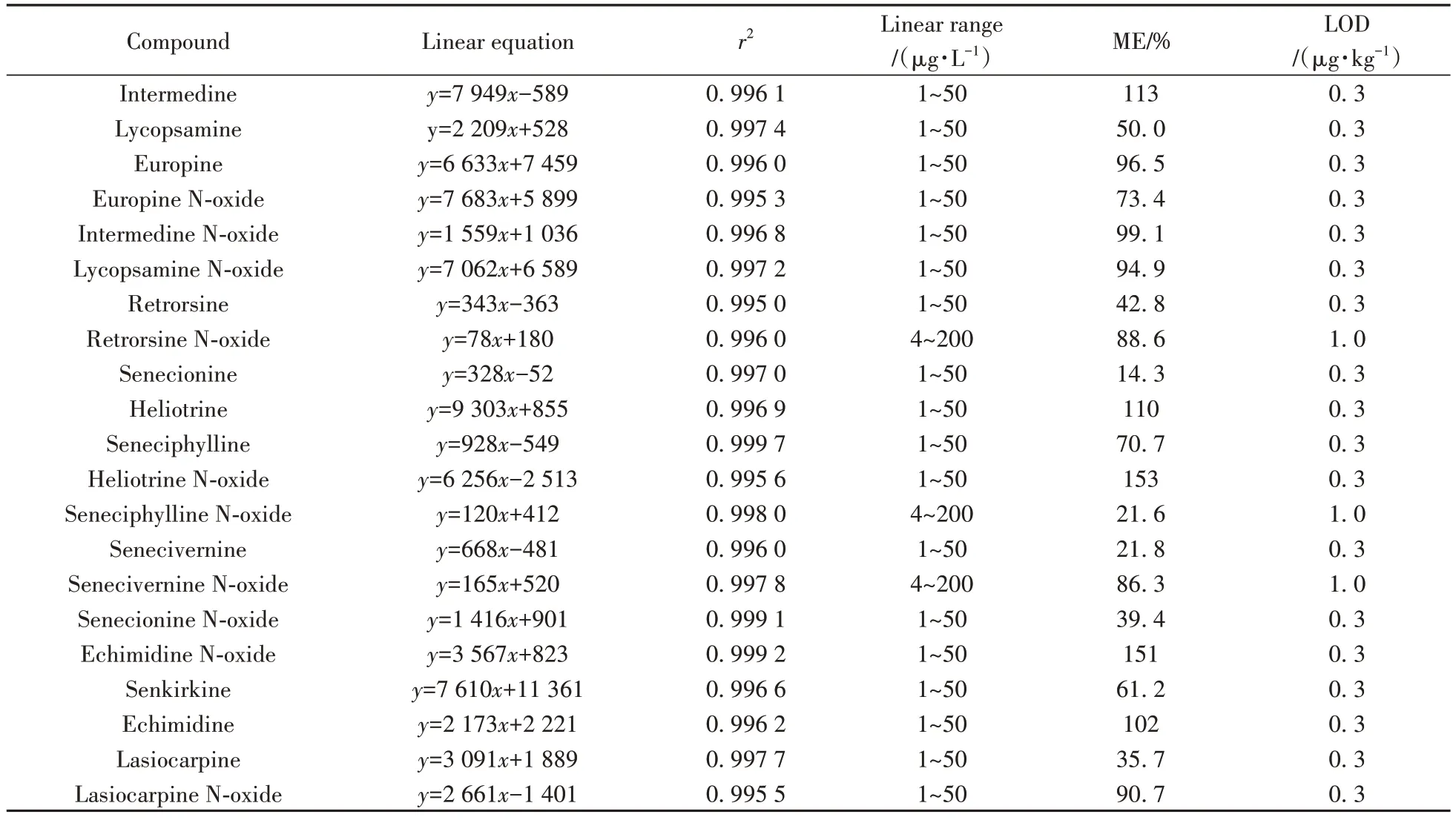
表2 目标物的线性关系、基质效应及检出限Table 2 Linear relations,matrix effects and LODs of the analytes
以空白茶叶为基质,经过样品前处理后得到基质空白溶液,配制标准曲线溶液,并采用本方法进行测定。结果表明,21种PAs在对应质量浓度范围内均显示良好线性关系(r2≥0.995 0),方法的检出限(LOD)为0.3~1.0 µg/kg(见表2)。
2.3.2 准确度与精密度以空白茶叶为基质配制低、中、高3个加标浓度样品,进行准确度与精密度验证,每个浓度重复6次(见表3)。结果显示,3个加标水平下目标物的回收率为72.1%~108%,相对标准偏差(RSD)为2.0%~9.8%。表明本方法的准确度和精密度较好,能满足目标物的分析要求。
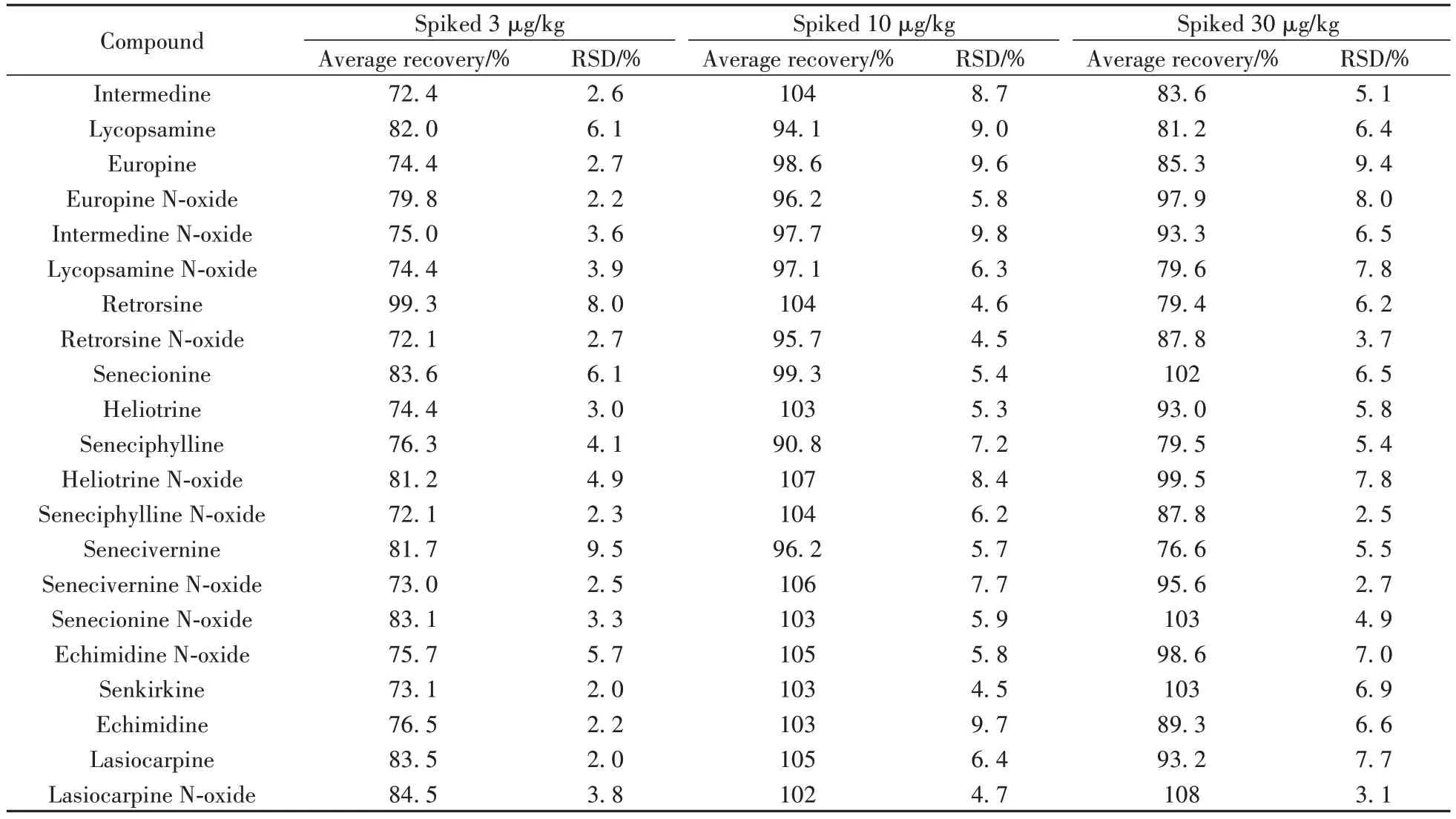
表3 目标物的平均回收率与相对标准偏差(n=6)Table 3 Average recoveries and relative standard deviations of the analytes(n=6)
2.4 实际样品测定
采用本方法对市售的60件茶叶样品进行检测,包括红茶、茉莉花茶、铁观音、大红袍、毛尖绿茶等,其中5 件样品检出PAs,总含量为1.8~85 µg/kg,结果均小于欧盟限量标准(150 µg/kg),具体见表4。
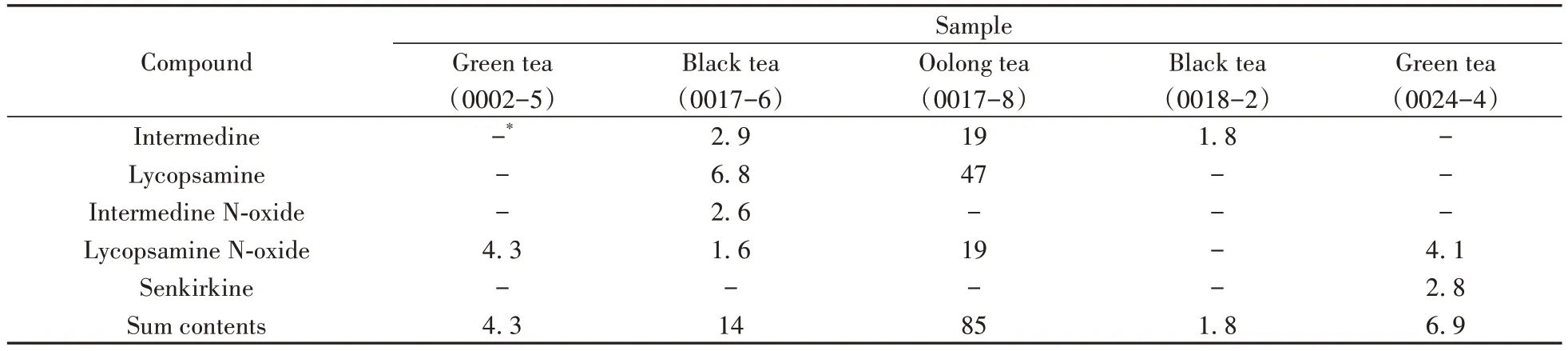
表4 样品中21种PAs的检出含量(µg/kg)Table 4 Detected contents of 21 PAs in the samples(µg/kg)
3 结 论
本研究建立了高效液相色谱-串联质谱(HPLC-MS/MS)同时检测茶叶中21种PAs的方法。该方法的准确度和精密度良好,通过对市售实际样品进行检测,证实了该方法的适用性。此方法涵盖了21 种PAs,与文献方法[14]相比,能够更加准确地确定样品中PAs 的总含量,检测灵敏度达到国际同等水平,为茶叶等植物源性产品中PAs的来源、组成及风险评估提供了技术依据。

