改进的QuEChERS/超高效液相色谱-串联质谱法测定蜂蜜中的丙烯酰胺
张琳昀,吉文亮,沈 菲,王鑫楠,钟 诚,朱 峰*
(1.江苏省疾病预防控制中心,江苏 南京 210009;2.沃特世科技(上海)有限公司,上海 200120)
丙烯酰胺(分子式为CH2CHCONH2)是一种白色晶体,亲电性强,易溶于水、三氯甲烷、乙醇及醚等溶剂中,室温下稳定,对生物体具有生殖毒性、神经毒性、免疫毒性、遗传毒性及潜在致癌性,于1994 年被国际癌症组织(IRAC)列为2A 类致癌物。近期有研究者发现丙烯酰胺会影响大脑脂质代谢引发炎症,导致焦虑和抑郁[1]。2002 年瑞典科学家首次在高温加热的淀粉类食品中发现了丙烯酰胺,氨基酸、还原糖和蛋白质在高温烹饪过程中会发生“美拉德反应”,产生副产物丙烯酰胺。大量研究表明,经高温加工的食物可能含有丙烯酰胺。我国原卫生部2005 年发布了《关于减少丙烯酰胺可能导致的健康危害公告》[2],该公告建议尽可能避免连续长时间或高温烹饪淀粉类食品。2017年,欧盟发布了《减少食品中丙烯酰胺含量的缓解措施和基准水平》指令(EU 2017/2158),该指令规定了不同食品中丙烯酰胺的基准水平(40 ~ 4 000 µg/kg)[3]。2021 年韩国发布了《食品中丙烯酰胺建议规格运营计划》,规定了各类食品中丙烯酰胺的建议限量(0.3 ~ 1 mg/kg)[4]。
蜂蜜是蜜蜂酿制的天然营养品,深受大众喜爱。蜂巢或蜂箱内的蜂蜜通常含有沙尘颗粒、结晶颗粒、蜜蜂残留肢体、蜂蜡、花粉等微粒,可通过控制加热提高蜂蜜的流动性,采用过滤等手段去除大部分杂质。蜂蜜由不同的糖组成,主要是果糖和葡萄糖,以及微量元素、氨基酸、维生素、黄酮类、有机酸类等物质。因此,蜂蜜在热加工过程中可能会发生“美拉德反应”产生丙烯酰胺。目前,有关食品中丙烯酰胺的测定研究,样品基质主要包括咖啡、薯片、面包、饼干、食糖、茶叶、婴幼儿辅食等[5-8],鲜有测定蜂蜜中丙烯酰胺的报道,因此建立蜂蜜中丙烯酰胺的测定方法具有重要意义。
食品中丙烯酰胺传统的测定方法有高效液相色谱法[9]、气相色谱-质谱法[10]、高效液相色谱-串联质谱法[11],新型的测定方法有阻抑还原光度法[12]、生物传感法[13]、数字图像比色法[14]、毛细管电泳法[15]。新型的检测技术多以薯片基质作为检测对象,虽快速但面临诸多挑战,如其他基质的适用性、定性定量的准确性、方法推广性等。传统分析方法中,高效液相色谱-串联质谱法适用于绝大多数食品基质中丙烯酰胺的测定,灵敏度高、准确性好,然而该方法多采用固相萃取柱净化,如《食品安全国家标准 食品中丙烯酰胺的测定》(GB 5009.204-2014)[16],不仅过程繁琐且成本较高。近年来,QuEChERS法因操作简单、快速、安全、成本低,在食品检测中被广泛使用。
由于蜂蜜的含水量低、粘稠性大,且含有大量的糖类和有机色素,其提取净化过程十分复杂。本研究基于改进的QuEChERS 净化方法,建立了蜂蜜中丙烯酰胺的超高效液相色谱-串联质谱测定方法。该方法简单、快速、稳定,可实现复杂的蜂蜜基质中丙烯酰胺的高效准确定量,从而为蜂蜜中丙烯酰胺的安全评价提供依据。
1 实验部分
1.1 仪器与试剂
Acquity Premier 超高效液相色谱仪、Xevo TQ Absolute 三重四极杆质谱仪(美国Waters 公司),ZORBAX RRHD Eclipse Plus C18色谱柱(3.0 mm×150 mm,1.8 µm,美国Agilent 公司),2-16 KL 冷冻离心机(德国Sigma 公司),Multi Reax 涡旋振荡器(德国Heidolph 公司),HSC-24B 氮吹仪(天津市恒奥科技发展有限公司)。
丙烯酰胺和13C3-丙烯酰胺标准品(纯度均≥98%,德国Dr.Ehrenstorfer 公司);甲酸(质谱纯,美国Fisher 公司);氯化钠、硫酸钠、无水硫酸镁、正己烷(分析纯,国药集团);乙腈、甲醇(色谱纯,德国Merck公司);石墨化炭黑(GCB)、十八烷基吸附剂(C18)、乙二胺-N-丙基硅烷(PSA)、强阳离子交换材料(SCX)(安普科技有限公司);0.22 µm水相微孔滤膜(天津市津腾实验设备有限公司)。
1.2 标准溶液的配制
准确称取丙烯酰胺和13C3-丙烯酰胺标准品各10 mg,用甲醇溶解并定容至100 mL,配成质量浓度为100 µg/mL 的标准储备液。移取丙烯酰胺和13C3-丙烯酰胺标准储备液1 mL,加甲醇稀释至10 mL,使丙烯酰胺和13C3-丙烯酰胺的质量浓度为10 µg/mL。临用时用超纯水将丙烯酰胺稀释成2.0~500 ng/mL的标准系列溶液,其中13C3-丙烯酰胺的质量浓度为50 ng/mL。
1.3 样品前处理
1.3.1 提 取准确称取2.0 g(精确至1 mg)混合均匀的蜂蜜样品于15 mL 离心管中,加入10 µg/mL的13C3-丙烯酰胺10 µL,静置15 min;先加入10 mL超纯水,涡旋振荡提取10 min;再加入10 mL乙腈,涡旋振荡提取10 min;随后在离心管中加入5 g 盐析剂(1 g 氯化钠和4 g 硫酸钠),涡旋振荡2 min 后置于冷冻离心机,在0 ℃下以10 000 r/min离心5 min。取上清液待净化。
1.3.2 净 化取2 mL 上清液于基质分散固相萃取净化管中(含200 mg SCX、20 mg GCB、150 mg C18、150 mg PSA、150 mg无水硫酸镁),涡旋振荡5 min 后置于冷冻离心机,在0 ℃下以10 000 r/min 离心5 min。取1 mL 上清液氮吹至近干,用0.2 mL 超纯水溶解提取物,过0.22 µm 水相微孔滤膜,待上机测定。
1.4 仪器条件
色谱柱:ZORBAX RRHD Eclipse Plus C18(3.0 mm×150 mm,1.8 µm);柱温:30 ℃;流动相:A 相为0.1%甲酸水溶液,B 相为甲醇;进样量:10 µL;流速:0.2 mL/min;梯度洗脱程序:0~2 min,2%B;2~4 min,2%~10% B;4~6 min,10% B;6~7 min,10%~95% B;7~8.5 min,95% B;8.5~8.6 min,95%~2% B;8.6~10 min,2% B。
检测方式:多反应离子监测(MRM);电离方式:电喷雾电离源正离子模式(ESI+);脱溶剂气温度:600 ℃;毛细管电压:2.5 kV;去溶剂流速:1 000 L/h;锥孔流速:150 L/h;雾化气压力:700 kPa;碰撞气流速:0.15 mL/min。
2 结果与讨论
2.1 质谱条件的优化
配制200 ng/mL的丙烯酰胺和13C3-丙烯酰胺,以5 µL/min的流速通过蠕动泵将丙烯酰胺及其同位素内标溶液直接注入质谱仪。在以往的研究中[17],丙烯酰胺在正离子模式下具有更好的响应,因此,本研究采用正离子扫描模式对丙烯酰胺及其同位素内标进行调谐优化。通过优化毛细管电压、脱溶剂气温度、去溶剂流速、锥孔电压、碰撞能等参数,确定了丙烯酰胺及其同位素内标的定性、定量离子,具体参数如表1所示。实验发现,丙烯酰胺m/z为27的碎片离子比m/z为44的碎片离子响应强,这与文献报道不一致[5,11,17],且多数文献未提供实际样本中丙烯酰胺定性离子对(m/z72>44)的提取离子色谱图。因此,本实验同时监测了丙烯酰胺的3对离子,以确定定量离子和定性离子。如图1所示,标准溶液和蜂蜜样品中丙烯酰胺离子对m/z72>55的响应均最强,这与文献结果一致[8],但m/z72>44的基线噪音明显高于m/z72>27,且在低含量本底的蜂蜜样本中m/z72>44 离子对无法提取到色谱峰。综上,本研究选用m/z72>55和m/z72>27分别作为丙烯酰胺的定量离子对和定性离子对。
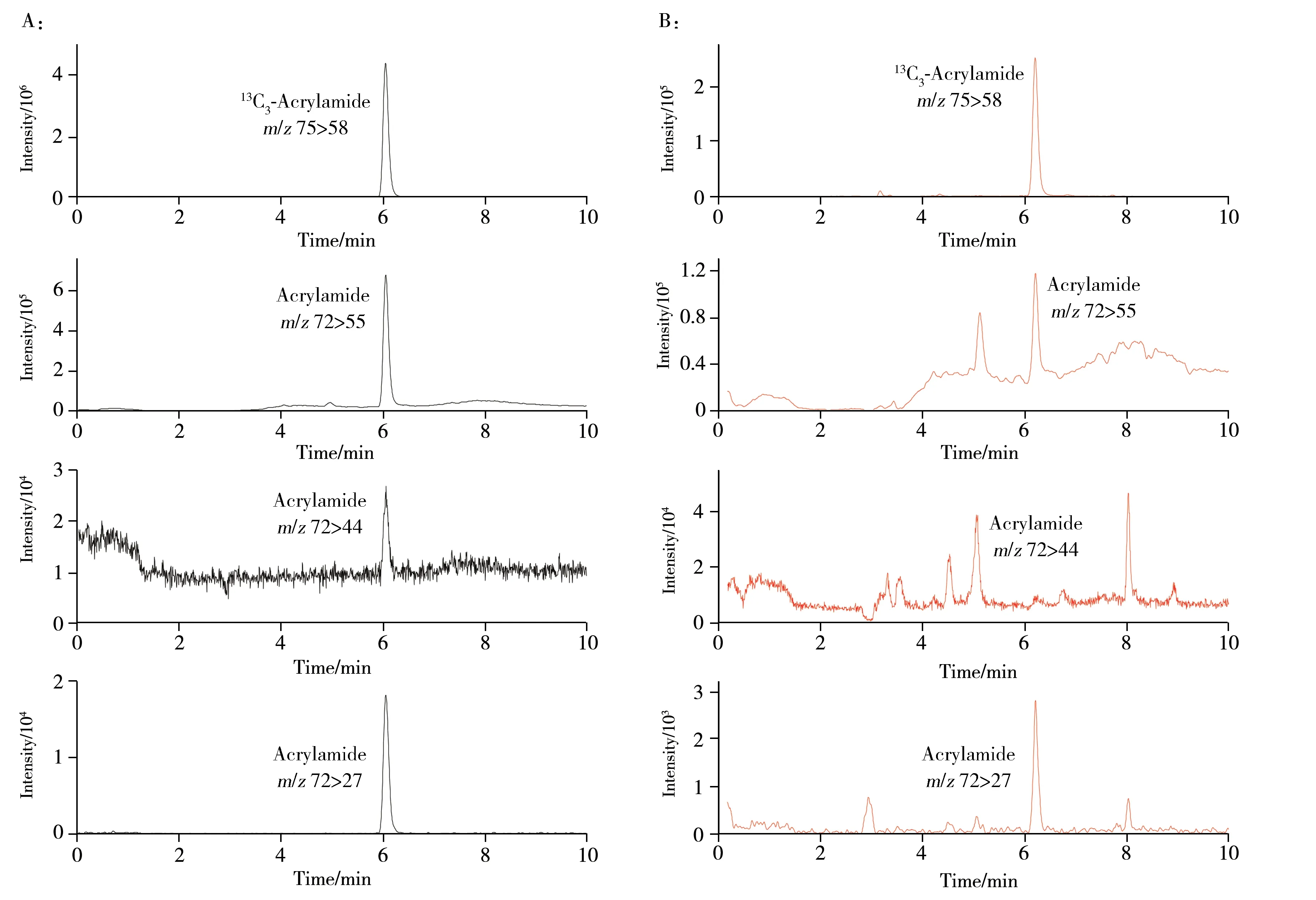
图1 标准溶液(A)和蜂蜜样品(B)中丙烯酰胺和13C3-丙烯酰胺的提取离子色谱图Fig.1 Extracted ion chromatograms of acrylamide and 13C3-acrylamide in standard solution(A) and honey sample(B)

表1 丙烯酰胺及其同位素内标的质谱参数Table 1 Mass spectrometric parameters of acrylamide and 13C3-acrylamide
2.2 色谱条件的优化
通常酸能增强ESI+模式下目标物的响应强度,因此本实验采用0.1%甲酸水溶液-甲醇作为流动相进行梯度洗脱。丙烯酰胺辛醇/水分配系数的对数值(logKow)为-0.67,表现为强极性。因此,丙烯酰胺在常规C18填料色谱柱上的保留较弱,其保留时间大多小于3 min[8,11]。由于丙烯酰胺属于小分子极性化合物,受质谱低质量端噪音的干扰大,且蜂蜜样品基质复杂,一些小分子化合物不能完全被去除。实验表明,丙烯酰胺的提取离子色谱图上存在干扰峰,影响定性和定量结果的准确性。因此考察了Atlantis dC18(2.1 mm×150 mm,5 µm)、ACQUITY HSS T3(2.1 mm×100 mm,1.8 µm)、ZORBAX RRHD Eclipse Plus C18(3.0 mm×150 mm,1.8 µm)3 种色谱柱对丙烯酰胺的保留效果,发现前两种色谱柱对丙烯酰胺的保留效果较差(均小于3 min),干扰峰与目标峰不能完全基线分离;而丙烯酰胺在ZORBAX RRHD Eclipse Plus C18上的保留时间在6 min左右,因此选择该色谱柱进行分离。
柱温会影响目标物在色谱柱上的吸附/解吸附过程,进而影响分离度,因此比较了不同柱温(20、25、30、40 ℃)下丙烯酰胺的色谱保留情况。实验发现温度对丙烯酰胺的色谱峰峰形无显著影响,上述温度下丙烯酰胺的保留时间分别为6.43、6.24、6.03、5.67 min。柱温为40 ℃时,丙烯酰胺目标峰与干扰峰未完全分离,当温度≤30 ℃时,干扰峰与目标峰完全基线分离,因此选择柱温为30 ℃。
2.3 提取方法的选择
丙烯酰胺的极性强,易溶于水和乙腈。采用体积比为1∶1 的水和乙腈溶液稀释丙烯酰胺标准品,加入盐析剂,结果表明97%的丙烯酰胺进入了乙腈层,表明丙烯酰胺可以采用QuEChERS 法提取,即采用盐析法将目标分析物从水相层转入乙腈层,提取液供进一步净化处理。由于蜂蜜含水量较低、黏性大,无法直接采用有机溶剂提取,本研究首先加入水将蜂蜜溶解分散,再加入乙腈沉淀蛋白,并与水形成混合提取溶剂提取丙烯酰胺;加入盐析剂使水和乙腈分层,采用冷冻离心的方式,使蛋白沉淀不易进入乙腈层,部分水溶性杂质可留在水层,丙烯酰胺则进入乙腈层,起到初步分离净化的目的,上层乙腈提取液供QuEChERS净化处理。
2.4 净化方法的优化
QuEChERS 法常用的净化填料为GCB、C18、PSA,并加入少量无水硫酸镁除水。其中,GCB 可去除色素等非极性干扰物;C18可去除脂、固醇等非极性干扰物;PSA 可去除糖类、有机酸、色素等极性干扰物。本研究对QuEChERS法作了改进,增加一种强阳离子交换材料,以去除碱性化合物。比较了4种净化填料(SCX、GCB、C18、PSA)用量对蜂蜜样品中丙烯酰胺的净化效果。
2.4.1 SCX 用量的优化保持净化填料GCB(20 mg)、C18(150 mg)、PSA(150 mg)、无水MgSO4(150 mg)用量不变,考察了SCX不同用量(50、100、150、200 mg)对基质干扰去除的影响。如图2所示,当SCX 用量为50 mg 时,基质干扰严重,丙烯酰胺及其同位素内标的色谱峰无法被观察到。随着SCX 的用量增加,丙烯酰胺及其同位素内标的色谱峰能够被观察到。SCX 的用量为100 mg 和150 mg 时,13C3-丙烯酰胺提取离子色谱图中的杂质峰较多且强度高,丙烯酰胺的两对提取离子色谱峰(m/z72>55和72>27)受杂质峰干扰严重,峰形较差。SCX 的用量为200 mg 时,丙烯酰胺同位素提取离子色谱图中的杂质峰降低明显,峰形以及相对峰高得到了明显提高,丙烯酰胺的两对提取离子峰的峰形明显改善。综上所述,加入SCX填料能有效去除蜂蜜样品中杂质对目标峰的干扰,其最佳用量为200 mg。
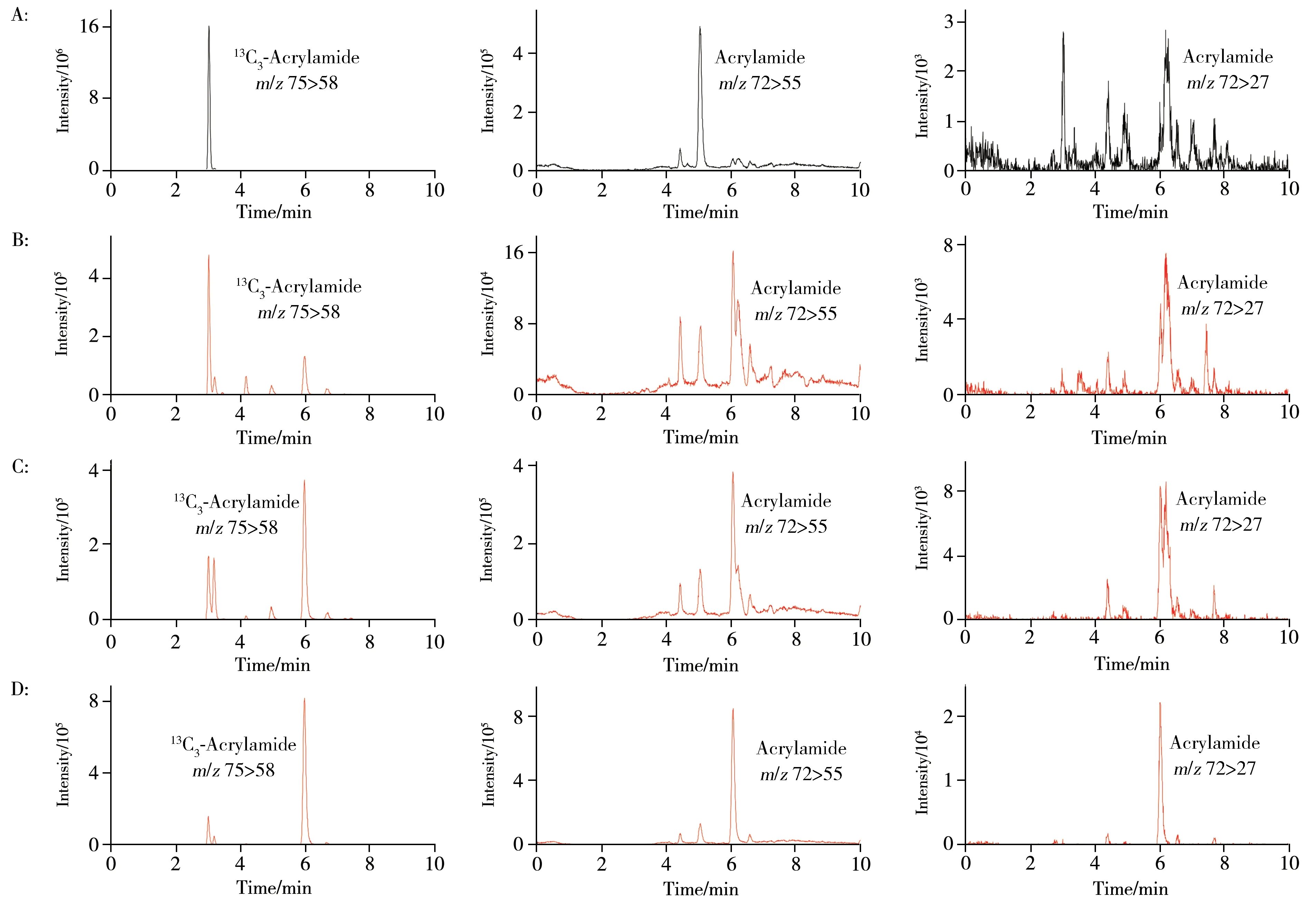
图2 SCX用量对丙烯酰胺和13C3-丙烯酰胺提取离子色谱图的影响Fig.2 Influences of different SCX amounts on the extracted ion chromatograms of acrylamide and 13C3-acrylamide SCX amount(A~D):50,100,150,200 mg
2.4.2 GCB 用量的优化保持净化填料SCX(200 mg)、C18(150 mg)、PSA(150 mg)、无水MgSO4(150 mg)用量不变,考察了GCB 用量(10、20、50、100 mg)对基质干扰去除的影响。结果表明,GCB 的用量增加不影响丙烯酰胺及其同位素内标的峰形,考虑到不同蜂蜜样本的色素含量有差异,本研究选择GCB用量为20 mg。
2.4.3 C18与PSA 用量的优化保持净化填料SCX(200 mg)、GCB(20 mg)、无水MgSO4(150 mg)用量不变,考察了C18和PSA 用量(C18和PSA 各50、100、150、200 mg)对基质干扰去除的影响。结果显示,C18和PSA用量均为50 mg或100 mg时,虽然杂质对13C3-丙烯酰胺的干扰影响最小,当用量为150 mg时,丙烯酰胺的两对提取离子(m/z72>55和72>27)色谱峰形及干扰峰得到明显改善,当PSA 和C18用量均增至200 mg 时,丙烯酰胺的两对提取离子色谱峰的峰形变差。综合考虑,选择PSA 和C18的用量均为150 mg,各提取离子的色谱峰峰形最佳、杂质干扰影响小。
综上所述,最终选用SCX(200 mg)、GCB(20 mg)、C18(150 mg)、PSA(150 mg)、无水MgSO4(150 mg)作为净化填料。
2.5 基质效应
基质效应是由于待分析样品溶液中的杂质在离子电离时与目标分析物产生竞争或改变喷雾液滴的表面张力和粘度,从而影响目标化合物的电离程度,通常表现为基质抑制或基质增强效应。由于丙烯酰胺在蜂蜜样品中普遍存在,因此本实验采用13C3-丙烯酰胺考察基质效应。按照“1.3”对样品进行前处理(不加入同位素内标),获得蜂蜜基质溶液,分别用该基质溶液和纯水将13C3-丙烯酰胺逐级稀释成2.0 ~ 100 ng/mL 的同位素标准系列溶液,分别将基质溶液和纯水配制的两组13C3-丙烯酰胺同位素标准系列溶液按照浓度从低到高依次进样,获得标准曲线。基质效应(ME)计算公式如下:ME(%)=k1/k2×100,其中k1和k2分别为13C3-丙烯酰胺的基质曲线和纯溶剂曲线的斜率。当ME 为100%时,表明无基质效应;当ME为<100%或>100%时,分别表现为基质抑制效应或基质增强效应。本实验的ME为77.4%,表明存在基质抑制效应。由于前处理过程中丙烯酰胺存在绝对损失,实验采用13C3-丙烯酰胺消除前处理过程中目标分析物的绝对损失以及基质抑制效应的影响。
2.6 方法学数据的考察
用超纯水将丙烯酰胺稀释成2.0 ~ 500 ng/mL 的标准系列溶液,其中13C3-丙烯酰胺的质量浓度为50 ng/mL,采用本方法进行测定。结果显示,丙烯酰胺在2.0 ~ 500 ng/mL 范围内线性关系良好,相关系数(r2)为0.999 7。将低本底蜂蜜样品按本方法进行样品前处理和测定,获得丙烯酰胺的本底值以及信噪比(S/N)值,按照S/N分别为3 和10 计算并获得丙烯酰胺的检出限(LOD)和定量下限(LOQ)分别为0.42 µg/kg和1.38 µg/kg。
对低本底蜂蜜样品(2.5 µg/kg),按照低、中、高(2、10、100 µg/kg)3个水平进行加标实验,每个浓度水平平行测定6 次。由表2 可知,丙烯酰胺在3 个加标水平下的平均回收率为89.2% ~ 96.3%,相对标准偏差(RSD)为2.2% ~ 4.2%。

表2 丙烯酰胺的回收率与相对标准偏差(n=6)Table 2 Recoveries and relative standard deviations of acrylamide(n=6)
2.7 实际样品检测
在江苏省13 个地市的超市、零售店以及网店购买30 份蜂蜜,从产地上看,其中29 份样品产自我国浙江、江苏、广西、上海、河北、辽宁、福建、安徽,1份样品产自新西兰;根据蜜源植物可分为:洋槐蜂蜜、枣花蜂蜜、紫云英蜂蜜、白玉枇杷蜂蜜和油菜花蜂蜜。采用本方法对30 份蜂蜜进行测定,丙烯酰胺的检出率为100%,含量为2.5~40.4 µg/kg,实际样品的色谱图见图1B。由于原料蜜除杂过程一般需加热,导致30 份蜂蜜样品均检出丙烯酰胺,但该热加工工艺的温度一般较低(40~65 ℃),所以蜂蜜中丙烯酰胺的含量整体较低,最高仅40.4 µg/kg。欧盟EU 2017/2158 指令规定婴幼儿食品中丙烯酰胺的基准值为40 µg/kg[3],本研究的测定结果显示,蜂蜜样品中丙烯酰胺含量处于较低水平,但仍需给予关注。
3 结 论
本研究在传统QuEChERS 法基础上增加一种强阳离子交换材料作为净化材料,基于改进的QuEChERS 法,并结合超高效液相色谱-串联质谱建立了蜂蜜样品中丙烯酰胺的测定方法。该方法简单、快速、灵敏度高、准确性好。经过优化后的净化材料能显著降低蜂蜜中杂质的干扰,同时选用分离效果更为高效的色谱柱,进一步减少了杂质对目标峰的干扰,确保定量结果准确可靠。该方法的建立可弥补蜂蜜中丙烯酰胺相关检测方法的缺失,可为蜂蜜中丙烯酰胺的暴露评估提供技术支撑,从而保障广大消费者“舌尖上的安全”。

