卵巢癌合并副肿瘤肾病综合征1例
高本雪 李绵利 耿海涛 孙霖
滨州医学院附属医院肿瘤科,滨州 256603
据统计,1994—1999年至2016—2018年间,全球女性的卵巢癌病死率下降到了10%,但卵巢癌仍是目前病死率最高的妇科恶性肿瘤,然而其发生肾脏副瘤综合征的病例并不多见。恶性肿瘤相关性肾脏疾病,在广义上,是指由于肿瘤直接侵犯肾脏、免疫机制影响及高尿酸血症、低钙或高钙血症等肿瘤代谢异常及肿瘤治疗药物所引起的肾损害。我们通常所说的恶性肿瘤相关性肾脏疾病主要是指由免疫机制所致的肾脏损害,是表现在肾脏的副瘤综合征,即副肿瘤肾病综合征(paraneoplastic nephrotic syndrome,PNS)。
在1966年Lee等[1]首次提出肾外肿瘤与肾病综合征之间的关联之后,越来越多的临床工作者开始对这种较常见的继发性肾病综合征进行报道及研究。在这些病例报道中,以肺癌[2-3]、结肠癌[4]及淋巴瘤[5]等实体瘤最常见,在这些病例中,不乏有在应用类固醇药物后疗效不佳或出现耐药后,进一步检查确诊恶性肿瘤的情况。而对于恶性肿瘤相关肾脏疾病的病理类型以膜性肾病(membranous nephropathy,MN)最为常见[6]。就这些报道来看,卵巢癌合并肾病综合征的病例并不多见。而在已有的PNS相关病例报道及临床研究中,我们可以得出:与妇科肿瘤相关的副肿瘤综合征涉及神经[7]、眼科[8-9]、皮肤[10]、风湿病[11]、内分泌[12]、血液和肾脏[13]系统。这些系统疾病的症状可以在癌症诊断前、诊断时或诊断后表现出来,也可能在癌症复发时发生[14]。本文通过分享卵巢癌合并肾病综合征患者的临床表现及体征、影像及病理检查、诊断及治疗的特点进行讨论总结,望能为副肿瘤综合征患者的鉴别及诊疗提供更多线索。
病例资料
1.一般资料
该患者为77岁的老年女性,因“血尿1 d”于2022-01入住滨州医学院附属医院肾内科。患者15年前有“急性肾盂肾炎”病史,自述已治愈。15年前曾因“胆囊结石”行胆囊切除术。家族史无特殊。于2021-07查体发现尿常规异常,偶有眼睑、双下肢水肿,尿中可见细腻不易消散的泡沫,伴有夜尿增多,就诊于外院,完善尿常规:尿蛋白3+,尿潜血(+-);生化:白蛋白31.8 g/L,钙2.07 mmol/L,谷丙转氨酶11 U/L,谷草转氨酶17 U/L,肌酐48.2 µmol/L,尿酸213.3 µmol/L,钾3.49 mmol/L;类风湿因子92 IU/ml;癌胚抗原(CEA)6.51 µg/L,癌抗原125(cancer antigen 125,CA125)102.87 U/ml;胸腹+盆腔CT:1.胆囊术后改变,2.胸骨柄骨质密度增高,3.腹膜后增大淋巴结,4.肠系膜脂膜炎,5.右肺下叶磨玻璃结节,6.双肺微小结节;正电子发射计算机断层显像(PET-CT)提示:中腹部肠系膜区、腹主动脉左侧旁及左侧髂血管旁多发增大淋巴结伴糖代谢异常增高,不除外恶变可能。诊断为:1.慢性肾小球肾炎,2.胆囊术后,3.腹部诊断性影像学异常。患者1 d前出现肉眼血尿,伴有膀胱刺激征,排尿次数增多及腰痛。
2.治疗过程
入院后完善查体及检查。查体:体温36.0 ℃,脉搏117次/min,呼吸频率22次/min,血压121/76 mmHg(1 mmHg=0.133 kPa),双下肢有轻度凹陷性水肿。主要实验室及影像学检查如下。尿肌酐25 936.27 µmol/L,尿微量白蛋白27 459.55 mg/L,尿微比尿肌酐9 360.25 mg/g;泌尿系彩超:示膀胱炎症样改变。PET-CT(图1):1.左附件区肿块伴氟代脱氧葡萄糖(FDG)高代谢(2.9 cm×2.4 cm);2.腹腔肠系膜间隙、腹主动脉左旁、左髂血管走行区多发FDG高代谢淋巴结(2.5 cm×1.8 cm)。腹膜后淋巴结穿刺病理(图2):查见转移性低分化腺癌,结合免疫组化标志物考虑卵巢高级别浆液性癌转移可能大,建议临床进一步检查。免疫组织化学染色:CK7+,CK20-,Villin-,PAX8-,CA125+,CA19-9局灶+,P53弥漫强+,WT-1-,ER-,PR-,CDX2-,SATB2-,Ki-67阳性率约80%。肾脏穿刺活检(图3):1.MN Ⅰ期伴局灶球性硬化,2.亚急性肾小管间质肾炎。综上,结合病理考虑卵巢来源恶性肿瘤,卵巢癌伴腹、盆腔淋巴结转移可能。盆腔少许积液。患者卵巢癌诊断明确,考虑患者为PNS,首先针对肿瘤进一步治疗,转入本科后,完善血常规及生化等相关指标检查,排除化疗禁忌,于2022-02-22开始给予紫杉醇联合顺铂(TC)方案(具体剂量:紫杉醇180 mg d1,顺铂400 mg d1)全身化疗1个周期,后于当地医院行全身化疗3个周期,于2022-06-06再次就诊于本科,并完善相关影像学检查(图4)。

图1 正电子发射计算机断层显像(PET-CT)示:1.左附件区肿块伴氟代脱氧葡萄糖(FDG)高代谢(2.9 cm×2.4 cm);2.腹腔肠系膜间隙、腹主动脉左旁、左髂血管走行区多发FDG高代谢淋巴结(2.5 cm×1.8 cm)

图2 腹膜后淋巴结穿刺病理图(镜下HE染色,10×10)

图3 肾脏穿刺病理图。A:HE染色,100×;B:免疫荧光染色,200×
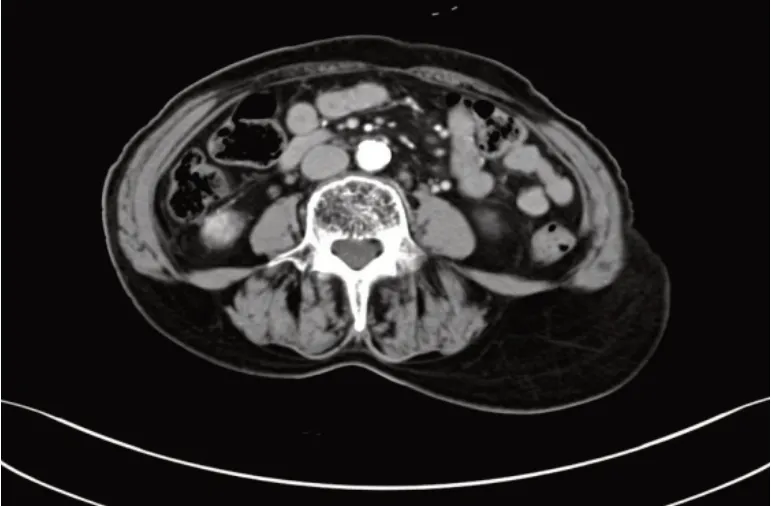
图4 新辅助化疗后复查腹部及盆腔CT:腹膜后、肠系膜根部稍大淋巴结,盆腔内稍大淋巴结
3.治疗结果与转归
患者行4次TC方案化疗后复查CT示:胆囊术后。双肾形态欠规则,强化欠均匀。腹膜后、肠系膜根部稍大淋巴结。膀胱炎症样改变。盆腔内稍大淋巴结。临床疗效评价为部分缓解(PR),遂转入妇科,排除手术禁忌后,于2022-06-17行经腹筋膜外全子宫+双附件切除术+腹膜后淋巴结清扫术+大网膜、阑尾切除术,术后恢复可。术后病理见图5、6。全子宫+双附件:1.左侧输卵管伞端查见残存癌,肿物长径约0.8 cm;宫体、宫颈、双侧卵巢及右侧输卵管均未查见癌。2.绝经后子宫内膜并子宫内膜息肉,慢性子宫颈炎伴腺体鳞化,双侧卵巢及右侧输卵管未见特殊。1.标记左侧盆腔淋巴结(0/8)及右侧盆腔淋巴结(0/14)内可见钙化,均未查见转移癌。2.送检大网膜组织内未查见转移癌。3.慢性阑尾炎。后复查CT(图7)示病情稳定。继续行术后辅助化疗4个周期,方案剂量同前,期间复查CEA、CA125、CA153、人附睾蛋白4(human epididymis protein 4,HE4)等肿瘤标志物进行性降低并稳定在正常值范围内,末次化疗于2022-09结束。

图5 卵巢术后病理图(镜下HE染色,10×10)
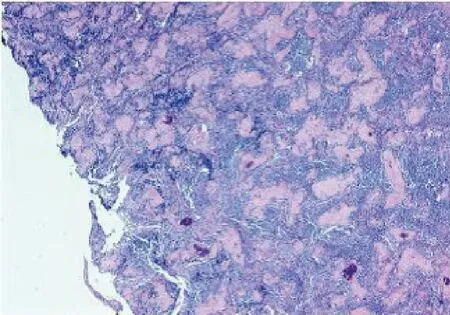
图6 淋巴结术后病理图(镜下HE染色,4×10)

图7 手术后复查盆腔CT:子宫及附件切除术后;盆腔内双侧液性低密度,左侧为主——考虑淋巴囊肿可能;左侧腹股沟区稍大淋巴结,膀胱壁略厚
讨 论
在我国,卵巢癌年发病率居女性生殖系统肿瘤第3位,且其病死率位于女性生殖道恶性肿瘤之首。大多数患者明确诊断时已为晚期,Ⅲ期患者的5年生存率为27%,Ⅳ期患者为仅13%。据临床数据统计,约20%的肿瘤患者会发生副肿瘤综合征,其中有10%~20%的癌症患者在发病前或发病时会出现副肿瘤综合征,其中尤以肺癌、乳腺癌、卵巢癌多见。如果能够注意到副肿瘤综合征,并进一步进行检查,可及时发现肿瘤,做到早诊早治,因此,正确认识副肿瘤综合征对恶性肿瘤的诊断及治疗有重要意义。卵巢癌合并副肿瘤综合征并不十分罕见,但由于卵巢癌起病的隐匿性,或由于副肿瘤综合征症状的掩盖,诊断时可能会被忽略,从而延误治疗。有研究提出,通常在癌症诊断前后的6个月内肾病蛋白尿的症状出现,要考虑副肿瘤综合征的可能[15]。当然,最终的诊断还需根据病理结果及疗效综合判断。PNS相对来说较为罕见,其临床表现、病理生理机制、治疗和预后取决于相关恶性肿瘤的类型。与实体瘤相关的肾病综合征的病理类型以MN最为常见,与霍奇金淋巴瘤相关的则以肾小球微小病变、膜增生性肾炎等为主[16]。
1.临床表现
卵巢癌患者早期大多没有特异症状,本报道病例首先以“血尿”就诊,查体见双下肢轻度凹陷性水肿,无其他特异性表现。多数研究报道,卵巢癌合并肾病综合征的患者在临床表现上以肾病综合征为主,即大量蛋白尿、低蛋白血症、高度水肿、高脂血症等,上述表现在确诊卵巢癌后应考虑两病间的关联性。
2.影像学表现
卵巢肿瘤根据组织病理学特征可分为上皮细胞肿瘤、生殖细胞肿瘤、性索间质肿瘤和转移性肿瘤。其中最常见的类型为上皮细胞肿瘤,在上皮细胞肿瘤中最常见的为高级别浆液性癌。尽管它们的影像学表现通常是非特异性的,但其与大体病理表现非常相似,影像学与病理的相关性有助于更深入地了解卵巢癌亚型[17]。在影像学上,高级别通常表现为囊性肿块及数量不定的固体组织,有些肿瘤表现为整个固体包块。并且,常见有乳头状突出,在CT上通常表现为强烈增强。高达58%的病例为双侧转移,在诊断时通常为晚期疾病,包括腹膜转移[18]。在少数病例中,CT上可以看到肿瘤实性成分或乳头状突出物的高度衰减,组织学分析与沙砾体钙化相对应[19]。
3.病理诊断
患者肾脏穿刺病理免疫组化示免疫球蛋白G(IgG)沿肾小球毛细血管袢呈弥漫性强颗粒状染色,提示MN;同时腹膜后淋巴结及卵巢癌术后病理支持卵巢浆液性癌诊断。目前公认的PNS诊断标准如下:(1)肿瘤完全手术切除后的临床和组织学缓解,或化疗引起的疾病完全缓解,与肿瘤复发相关的肾脏复发;(2)两种疾病之间的病理联系,包括在免疫沉积物中检测到肿瘤抗原和抗肿瘤抗体。此外,如本例患者,在诊断为恶性肿瘤前或后6个月出现肾病蛋白尿,则两者极有可能存在因果关系。
4.治疗及预后
目前,卵巢癌治疗的主要手段仍是手术和化疗,本例患者为卵巢癌合并MN,根据中国临床肿瘤学会《卵巢癌诊疗指南(2021年版)》[20],给予患者含铂方案新辅助化疗4个周期后再次进行评估手术可能。目前,患者已完成手术治疗及术后辅助化疗。住院期间未针对肾病综合征进行特殊治疗,目前,患者无蛋白尿、肉眼血尿及水肿等表现,肾病综合征的症状较前减轻,提示患者的肾病综合征是与卵巢癌有关的副肿瘤综合征。
有研究提出,恶性肿瘤相关性肾病患者的肾小球有更多的炎性细胞浸润,其机制可能是含有肿瘤相关抗原的免疫复合物的沉积引发了促炎分子的释放[21],有基础实验表明,肺癌细胞的分泌蛋白能够诱导肾炎以及肾小球结构及功能的丧失,加快肾脏的病理进程[22]。目前,PNS与肿瘤合并原发性肾病综合征的鉴别主要依靠在干预肿瘤期间,对肾病综合征的进展情况的监测。展开来说,以肾病综合征起病的病例,主要的临床表现为低蛋白血症及大量蛋白尿,对于PNS的治疗,在控制原发肿瘤有效之后,肾病综合征常得以缓解,若肿瘤复发,肾病综合征的症状则会再次出现[13];对于肿瘤合并原发性肾病综合征的治疗,控制原发肿瘤有效之后,肾病综合征的症状通常无法明显缓解,提示二者之间并无特殊联系。因此,在肿瘤的诊疗过程中,应把握两者在临床表现及病理方面的联系,避免误诊,对肿瘤患者进行更早的干预,尤其是类似于卵巢癌发病较为隐匿的肿瘤,副肿瘤综合征或许能成为部分病例确诊的第一站“哨兵”。目前,我们对患者的随访时间尚短,还无法全面解读此病例。随着未来对恶性肿瘤相关副肿瘤综合征的深入研究,可能会更加明确地阐释恶性肿瘤相关肾病综合征的发病机制,改善患者的预后。
作者贡献声明高本雪:实施研究,采集数据,分析/解释数据,起草文章;李绵利:对文章的知识性内容作批评性审阅,获取研究经费,指导,支持性贡献;耿海涛:采集数据,对文章的知识性内容作批评性审阅,指导;孙霖:分析/解释数据,对文章的知识性内容作批评性审阅,行政、技术或材料支持,指导

