牛磺酸通过调控AKT/NF-κB通路改善脓毒症小鼠肝脏损伤的保护作用
胡玉莲 安佰丽 刘超 高慧婕
1日照市人民医院,日照 276826;2济宁医学院药学院,日照 276826
炎症是机体的一种防御反应,主要表现为红、肿、热、痛、功能障碍等,一旦得不到有效控制,将会导致严重的病理反应,例如脓毒症、自身免疫病等[1]。脓毒症可引起严重的炎症性组织损伤,主要是由于白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α、IL-1β等促炎性因子过量产生所致[2-3]。在过去十几年中,由脓毒症导致的病死率居高不下,消耗了巨大的医疗资源[4]。肝脏是调控免疫和炎性反应的主要器官,脓毒症早期即可由于肝细胞缺血、缺氧导致肝损伤,发生严重炎性反应和过度氧化应激[5]。肝功能损伤会严重影响脓毒症的预后,可作为引发多器官功能衰竭和死亡的重要预测因子[6]。因此,寻找有效靶点,防治脓毒症所致肝损伤具有重要临床意义。
牛磺酸(taurine)化学名称是2-氨基乙磺酸,化学结构式为H2NCH2CH2SO3H。牛磺酸既是一种具有广泛生理、药理作用的中药有效成分,是名贵中药“牛黄”的有效成分之一,又是动物体内必需营养元素,参与动物机体的细胞体积调节、渗透压调节等重要生理过程,并具有抗氧化和抗炎活性,对动物机体的稳态具有重要意义[7-9]。因此,牛磺酸抗炎、抗氧化以及缓解疾病的功效成为近些年的研究热点。
脂多糖(lipopolysaccharide,LPS)是革兰阴性菌壁的主要成分,可刺激宿主在脓毒性过程中释放多种炎症介质,可用来建立脓毒症经典模型[10]。本次研究采用LPS构建脓毒症小鼠模型,探讨牛磺酸对由LPS所致脓毒症肝损伤小鼠的抗炎、抗氧化活性及其分子机制,为牛磺酸治疗脓毒症肝损伤应用于临床提供有效实验依据。
材料与方法
1.实验试剂
牛磺酸购自上海叶源生物科技有限公司(S20155-25g),4%的多聚甲醛购自Biodharp Life Science(BL539A),Mouse IL-10 ELISA(酶联免疫吸附试验)Kit、Mouse IL-1β ELISA Kit、Mouse IL-6 ELISA Kit购自武汉基因美生物科技有限公司,RIPA裂解液、SDS-PAGE凝胶快速配制试剂盒、BCA蛋白浓度测定试剂盒、ECL化学发光试剂盒、SDS-PAGE电泳液(Tris-Gly,Powder)均购自Beyotime Biotechnology,HiScript ⅢRT SuperMix for qPCR(+gDNA wiper)(R323-01)、SYBR Green Master Mix(Q111-02)购自南京诺唯赞生物科技有限公司,Tubulin抗体(AT819)、辣根过氧化物酶标记山羊抗小鼠免疫球蛋白G(IgG)(H+L)(A0216)购自Beyotime Biotechnology,核因子(NF)-κB抗体(66535-1)、蛋白激酶B(AKT)抗体(60203-2)均购自Proteintech,核因子κB抑制蛋白(IκB)-α抗体(AI096)购自Beyotime Biotechnology。
2.实验动物
50只ICR雄性小鼠,4~5周龄,体质量18~22 g,购自济南朋悦实验动物繁育有限公司,许可证号:SCXK(鲁)2022 0006。小鼠自由摄食饮水,室温(23.00±1.00)℃,昼夜循环12 h。本次实验动物符合伦理学标准,经过济宁医学院实验动物伦理委员会批准。
3.实验方法
3.1.实验动物分组及处理 本研究于2022年2月至7月进行。小鼠适应性喂养1周,随机分为5组:空白对照组(Control组)、LPS造模组(LPS组)、牛磺酸低剂量组(L+L组)、牛磺酸中剂量组(L+M组)、牛磺酸高剂量组(L+H组)。牛磺酸腹腔注射给药,L+L组(100 mg/kg)0.2 ml/d,L+M组(200 mg/kg)0.2 ml/d,L+H组(400 mg/kg)0.2 ml/d,Control组与LPS组每天注射等体积生理盐水。实验第7天,Control组注射生理盐水,LPS组与牛磺酸用药组均注射LPS(10 mg/kg)。6 h后眼球取血,室温静置30 min后,以3 500 r/min离心15 min(离心半径85 mm),取上清液-80 ℃保存;摘取肝脏、肾脏和肺脏。
3.2.脏器指数计算 精密天平称量肝脏、肾脏和肺脏,计算脏器指数:肝脏(肾脏、肺脏)指数=肝脏(肾脏、肺脏)质量/小鼠体质量×100%。
3.3.小鼠肝脏组织苏木精-伊红(HE)染色 小鼠肝脏用10%福尔马林固定,石蜡包埋,并切成4 µm矢状切片。脱蜡处理(20 min/次,共3次)。将切片依次置于100%、100%、95%、80%、70%的乙醇中梯度脱水。HE染色。乙醇中梯度脱水后置于新鲜二甲苯溶液中浸泡(5 min/次,共2次)。中性树脂封片,镜下观察。
3.4.小鼠全血血常规指标检测 取小鼠全血,按照动物血液细胞分析仪的要求上机检测。
3.5.测定小鼠肝组织丙二醛(MDA)含量和超氧化物歧化酶(SOD)活力 使用生理盐水冲洗0.5 g肝脏组织,制备10%组织匀浆。根据说明书进行取样操作。采用多功能酶标仪分别在412 nm、550 nm和532 nm处检测SOD和MDA的吸光度值,并根据公式计算活性和含量。
3.6.小鼠血清中IL-1β、IL-6和IL-10含量的测定 按照ELISA试剂盒使用说明书操作,使用酶标仪在给定的波长下测定加样后的酶标板各孔的吸光度。按照给定公式计算IL-1β、IL-6和IL-10的浓度。
3.7.Western blot测定小鼠肝脏NF-κB、IκB和AKT的表达 使用RIPA裂解液裂解组织,使用前加入蛋白酶抑制剂、磷酸酶抑制剂混匀。BCA检测蛋白浓度。SDS-PAGE电泳,PVDF膜转膜。封闭液震荡封闭2 h。封闭完成后去除封闭液加入一抗(NF-κB 1∶1 000、AKT 1∶2 000和IκB 1∶1 000),室温下摇洗孵育2 h后过夜。次日Western洗涤液洗涤3次,每次摇洗10 min。加入二抗(山羊抗小鼠IgG 1∶2 000)孵育后洗涤。ECL显色,将PVDF膜放入多功能成像仪中检测。
3.8.免疫组化检测小鼠肝脏组织中NF-κB的表达 切片脱蜡后浸入二甲苯中3次,每次10 min,而后浸入到无水乙醇中3次,每次5 min;滴加3%过氧化氢(H2O2),室温处理8 min,蒸馏水清洗3次。热抗原修复后,滴加封闭液,室温封闭20 min,滴加NF-κB一抗4 ℃过夜。PBS清洗3次,滴加稀释好的二抗,常温孵育30 min。PBS清洗,后滴加链霉亲和素工作液,室温孵育30 min。DAB显色。苏木素轻度复染,脱水,透明,封片。
4.统计学分析
计量资料均符合正态分布,采用均数±标准差来表示,采用t检验或单因素方差分析进行组间比较。所有数据使用Prism 9.3.1统计软件进行分析,P<0.05差异有统计学意义。
结果
1.牛磺酸对LPS脓毒症小鼠脏器指数的影响(图1)
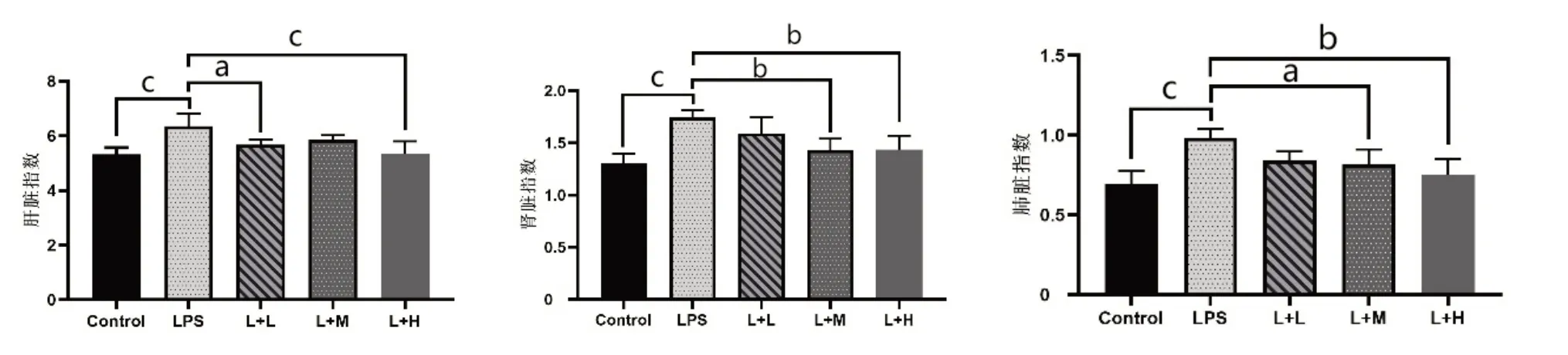
图1 牛磺酸对脓毒症小鼠脏器指数的影响
与Control组相比,LPS组小鼠肝脏指数、肾脏指数以及肺脏指数均显著升高(均P<0.001),LPS脓毒症模型制备成功。与LPS组相比,牛磺酸用药组(L+L组和L+H组)的肝脏指数降低(P<0.05,P<0.001),L+M组肝脏指数呈下降趋势,但差异无统计学意义(P>0.05)。与LPS组相比,L+M组和L+H组的肾脏和肺脏指数降低(P<0.05,P<0.01),L+L组肾脏和肝脏指数呈下降趋势,但差异均无统计学意义(均P>0.05)。从脏器指数水平显示出牛磺酸对肝脏、肾脏和肺脏均具有一定的抗炎保护作用。
2.牛磺酸对小鼠肝脏组织形态的影响(图2)
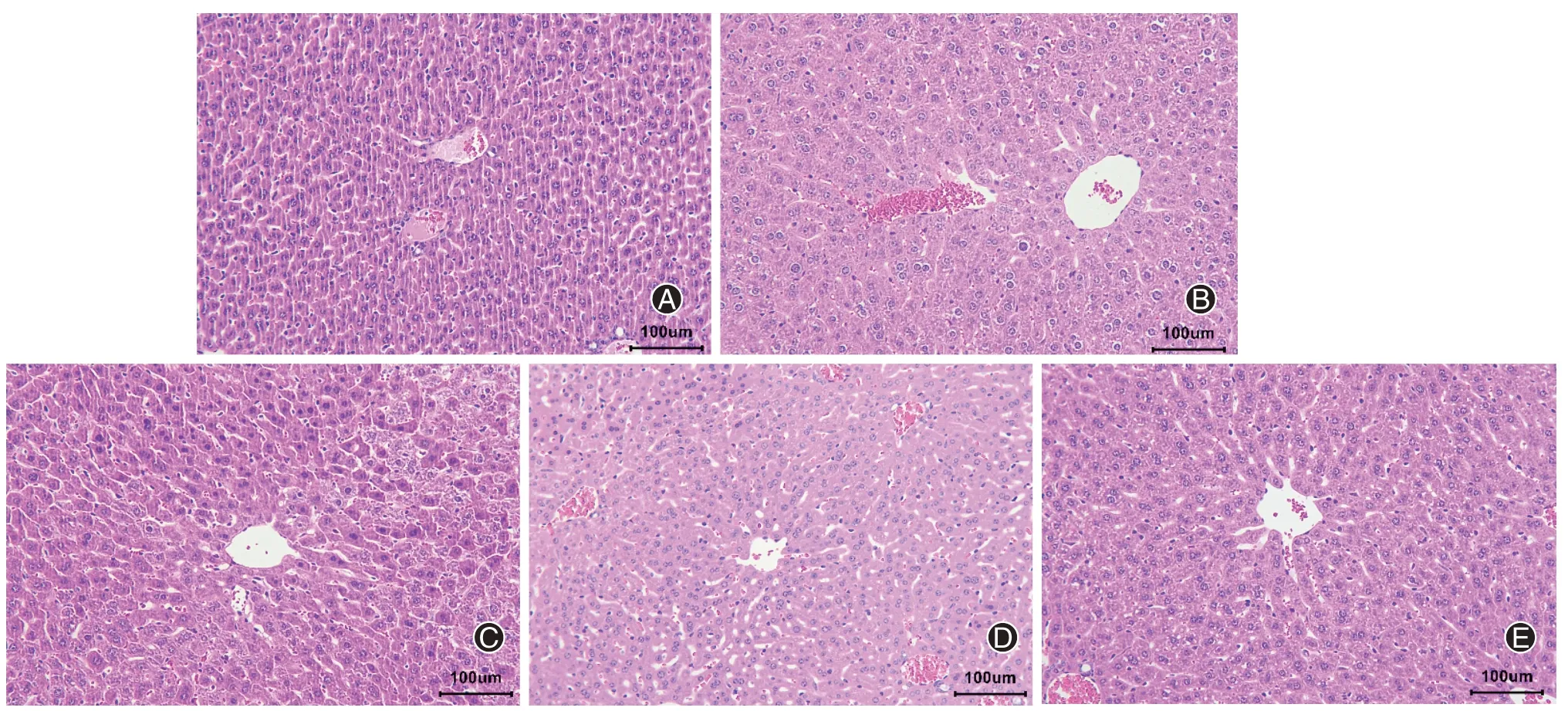
图2 牛磺酸对脓毒症小鼠肝脏组织形态的影响(A.Control组;B.LPS组;C.L+L组;D.L+M组;E.L+H组)(HE染色 ×100)
HE染色结果显示,LPS组小鼠肝组织产生明显损伤,肝脏结构混乱,肝索紊乱,肝细胞排列混乱,大小不一,出现炎性细胞浸润,牛磺酸用药组(L+L组、L+M组和L+H组)小鼠肝脏组织均呈现一定程度的恢复,肝组织排列较为清晰。
3.牛磺酸对LPS脓毒症小鼠血常规指标影响(图3)

图3 牛磺酸对脓毒症小鼠血常规的影响
与Control组相比,LPS组白细胞计数和粒细胞比率均显著升高(均P<0.001),淋巴细胞比率显著降低(P<0.001)。与LPS组相比,牛磺酸用药组(L+L组、L+M组和L+H组)的白细胞计数和粒细胞比率显著降低(P<0.05,P<0.001),淋巴细胞比率均显著升高(均P<0.001),显示牛磺酸可有效改善LPS造成的淋巴细胞比率与粒细胞比率的异常,且呈现明显的浓度依赖性,高浓度牛磺酸用药L+H组效果最佳。
4.牛磺酸对LPS脓毒症小鼠SOD和MDA的影响(图4)

图4 牛磺酸对脓毒症小鼠SOD(A)和MDA(B)的影响
与Control组相比,LPS组SOD活力显著下降(P<0.05);与LPS组比,L+M组SOD活力升高(P<0.01),L+L组、L+H组SOD活力有升高趋势,但差异均无统计学意义(均P>0.05)。与Control组相比,LPS组MDA含量显著增高(P<0.01);与LPS组相比较,L+L组、L+M组MDA含量降低(均P<0.05),L+H组MDA含量有下降趋势,但差异无统计学意义(P>0.05)。
5.牛磺酸对LPS脓毒症小鼠血清中IL-1β、IL-6和IL-10的表达影响(图5)
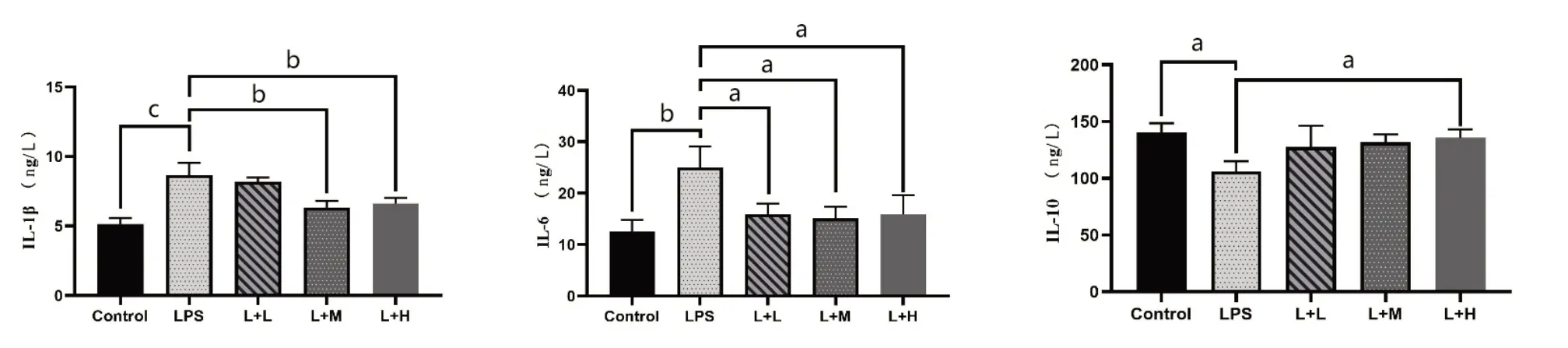
图5 牛磺酸对脓毒症小鼠IL-1β(A)、IL-6(B)和IL-10(C)的影响
与Control组相比,LPS组IL-1β、IL-6含量显著升高(P<0.01,P<0.001),IL-10含量下降(P<0.05)。与LPS组比,L+M组和L+H组的IL-1β含量降低(均P<0.01),L+L组IL-1β含量有下降趋势,但差异无统计学意义(P>0.05);牛磺酸用药组(L+L组、L+M组和L+H组)IL-6含量降低(均P<0.05);L+H组IL-10含量升高(P<0.05),L+L组、L+M组IL-10含量有上升趋势,但差异均无统计学意义(均P>0.05)。
6.牛磺酸对LPS脓毒症小鼠肝脏组织中NF-κB、IκB和AKT表达的影响
与Control组相比较,LPS组的NF-κB、AKT表达增多,IκB的表达减少。与LPS组相比,L+H组NF-κB、AKT表达降低,IκB的表达升高,见图6。与Control组相比,LPS组小鼠肝脏组织棕褐色明显增多,NF-κB表达升高;L+H组小鼠肝脏棕褐色颗粒表达下降,NF-κB原位表达降低,见图7。

图6 牛磺酸对脓毒症小鼠肝脏NF-κB、IκB和AKT表达的影响
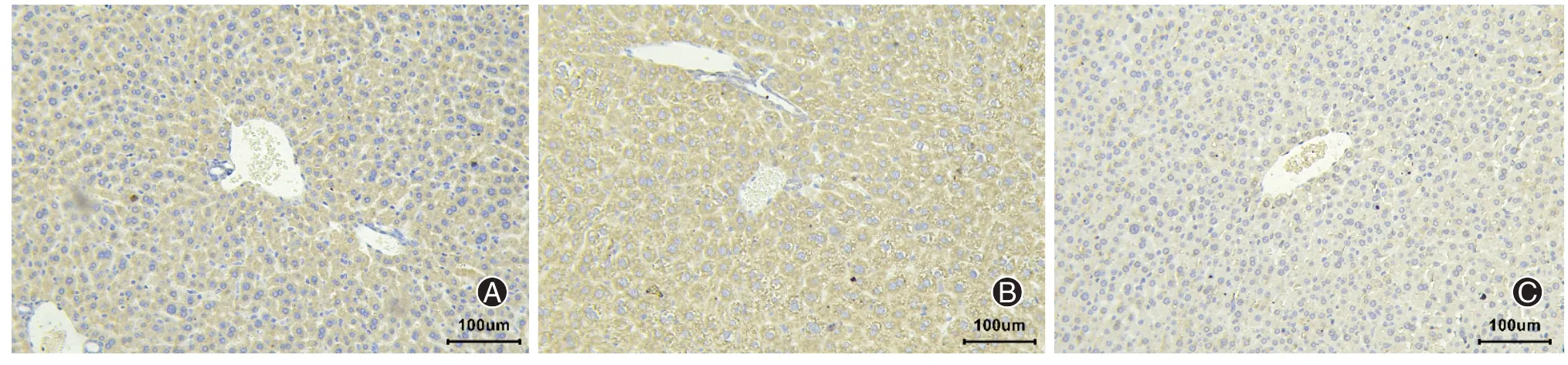
图7 牛磺酸对脓毒症小鼠肝脏的NF-κB表达的影响(A.Control组;B.LPS组;C.L+H组)(免疫组化法 ×100)
讨论
牛磺酸药用价值广泛,具有镇静催眠、镇咳祛痰平喘、抗炎、抗过敏、抗氧化、抗肿瘤、抗辐射等多项药理活性[7-9],中国药典二部将其归为镇静消炎类药物。牛磺酸主要通过抗氧化和抗炎活性发挥对细胞的保护作用,对机体稳态的维持具有重要意义[11-12]。针对炎症性损伤,牛磺酸能够促进中性粒细胞和巨噬细胞的吞噬活力,提升机体天然免疫应答[14]。牛磺酸被认为是一种极具前途的抗炎药物,但目前有关牛磺酸发挥抗炎活性防治脓毒症致肝损伤的作用机制尚未明确。
本实验采用10 mg/kg LPS制备脓毒症模型,结果显示模型组小鼠肝脏、肾脏和肺脏指数均显著升高,同时血清中炎症性细胞因子IL-1β、IL-6的表达显著增加,脓毒症致肝损伤模型制备成功。而牛磺酸干预能够有效降低小鼠肝脏、肾脏和肺脏指数,减少IL-1β、IL-6的产生,降低机体炎性反应,对脓毒症产生了良好缓解作用。氧化应激与炎症息息相关,有研究证明,外源性抗氧化剂可以对炎症起到一定治疗作用[15]。SOD是一种含有金属的参与氧化代谢的酶,是清除机体内有害自由基的重要物质[16]。MDA是膜脂过氧化的重要产物之一,可改变膜的通透性,进而产生一系列生理生化反应[17]。本次研究发现,模型组小鼠肝脏组织SOD活力下降而MDA含量上升,显示脓毒症小鼠肝脏抗氧化活性降低。而牛磺酸干预可提升脓毒症小鼠肝脏SOD活力,降低MDA含量,表明牛磺酸可有效提高肝损伤小鼠的抗氧化活性。
外周血白细胞计数和中性粒细胞比例升高,淋巴细胞比率相对偏低,多见于各种细菌感染,特别是各种化脓性球菌,如金黄色葡萄球菌、溶血性链球菌感染。本次实验显示脓毒症模型小鼠外周血淋巴细胞比率显著下降,白细胞计数和粒细胞比率明显上升,而牛磺酸干预后,这一现象得到了明显的纠正,说明牛磺酸可明显提升机体产生淋巴细胞的能力,降低炎症性粒细胞的产生,对机体免疫系统产生良好调节作用。IL-10是一类由活化的单核细胞、T细胞、B细胞等分泌的高活性多功能多肽分子,又称细胞因子合成抑制因子[18]。IL-10参与Th1向Th2的转化,同时受到IL-6调节,维持机体免疫稳态,对炎性反应起到负向调控作用。此次研究显示,牛磺酸干预可显著提高IL-10的表达,降低机体炎性反应。
AKT属于丝/苏氨酸蛋白激酶,是重要的促生存激酶,参与细胞的生长与存活[19]。AKT的磷酸化可以激活下游的NF-κB,从而启动IL-6、TNF-α等炎症性细胞因子的产生[20-21]。NF-κB正常形态下以非活性状态与IκB结合,当细胞受到LPS或促炎因子的刺激的时候,IκB降解并释放NF-κB,NF-κB便可以由细胞质进入细胞核中,调节多种促炎细胞因子表达[22]。IL-6是NF-κB的靶标基因,有研究发现,LPS在体内可以通过髓分化因子88途径活化NF-κB导致IL-6等炎症因子释放,IL-6含量升高,机体发生炎性反应[23]。同样作为促炎性细胞因子,IL-1β可以通过泛素-蛋白酶体系统导致IκB降解,释放的NF-κB转移到细胞核中,激活靶基因的转录[24-25]。本次研究发现,牛磺酸干预后LPS炎症小鼠肝脏AKT、NF-κB的蛋白表达均显著降低,同时IκB表达上升,同时检测血清中下游炎症性细胞因子IL-6和IL-1β的表达下降,提示牛磺酸有可能是通过抑制AKT/NF-κB通路,促使更多的IκB与NF-κB结合从而抑制了下游炎症因子的释放,缓解脓毒症小鼠肝脏的过度炎症状态。
综上所述,牛磺酸有效减轻LPS所致脓毒症肝损伤小鼠的炎性反应,提升肝脏抗氧化活性。牛磺酸可能通过抑制炎症AKT/NF-κB信号通路,降低下游炎症因子IL-6和IL-1β表达,从而达到抑制肝脏过度炎症的良好效果。本研究为牛磺酸作为抗炎活性药物的开发和利用提供可靠实验依据。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明胡玉莲:酝酿和设计实验,采集数据,分析/解释数据,起草文章,对文章的知识性内容作批评性审阅;安佰丽:采集数据,支持性贡献;刘超:统计分析,行政、技术或材料支持,支持性贡献;高慧婕:酝酿和设计实验,实施研究,分析/解释数据,对文章的知识性内容作批评性审阅

