水分亏缺对马铃薯叶片表皮结构、光合特性及产量的影响
邢媛 张锐 周进华 白磊 郭华春 李俊

摘要:马铃薯在块茎形成期对土壤水分亏缺较为敏感,叶片作为主要的蒸腾和光合器官对土壤水分亏缺响应更为积极,分析这一时期马铃薯叶片表观特征和光合参数可为耐旱品种筛选与耐旱机制解析提供新的思路。采用前期已筛选的对水分胁迫耐受性具有显著差异的3个马铃薯品种(系)为材料,采用人工控水法模拟干旱条件,设置T1[中度干旱,土壤相对湿度为(45±5)%]、T2[轻度干旱,土壤相对湿度为(55±5)%]和 CK[正常供水,土壤相对湿度为(75±5)%]3个处理,比较不同品种(系)间叶片表皮毛与气孔特征、光合色素含量与光合参数、脱落酸含量等指标对干旱胁迫的响应差异。结果表明,各品种(系)的叶片表皮毛数量和气孔密度对轻度干旱(T2)响应较一致,表皮毛数量均呈增多趋势,气孔口径和开度均减小;中度干旱(T1)胁迫下,干旱敏感型品种滇薯1418表皮毛总数、气孔密度显著增加,而叶片净光合速率(Pn)、气孔导度(Gs)显著降低。中间型品种青薯9号的表皮毛数量与气孔密度比受水分胁迫影响较小,其气孔在中度干旱胁迫(T1)下多保持开启状态。耐旱品系 3S-120的光合色素含量、叶片净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr)受胁迫影响均比青薯9号小,其脱落酸(ABA)含量随着干旱程度加深增幅最大。研究结果显示土壤水分胁迫程度不同,马铃薯品种(系)间采取的响应策略均有差异:通过叶片表皮结构的调整可适应轻度干旱胁迫,随胁迫程度加剧,干旱敏感型的材料通过调节叶片表皮毛总数、气孔密度来抵御干旱胁迫;而耐旱材料则动员脱落酸调控气孔增加其干旱耐受性,緩解水分亏缺对光合作用的影响,研究结果可为解析马铃薯耐旱机制和选育耐旱品种提供部分理论依据。
关键词:马铃薯;干旱;叶片表皮;光合特性;脱落酸
中图分类号:S532.01文献标志码:A文章编号:1002-1302(2023)17-0111-11
水分是农作物种植不可或缺的因素之一,如今全球气候变化愈加复杂化,灾害性天气出现频率增加,其中以气象性干旱为主引起的自然灾害已成为制约我国农业生产发展的关键因素[1]。水分亏缺造成的干旱已经成为限制农作物产量和威胁粮食安全的主要非生物胁迫之一[2],在导致农作物减产的所有胁迫中占据首位[3]。植物的固着生活特性使其在长期演化过程中形成了对土壤水分变化的适应机制,在干旱胁迫情况下,植物通过形态、生理生化、细胞和分子响应等缓解土壤水分亏缺引起的负面效应,如改善根系和叶片结构、渗透调节、相对含水量和激素介导的气孔调节等[4-6],这些机制的深入研究将有利于作物耐旱品种的选育和生产栽培。
马铃薯(Solanum tuberosum L.)是我国主要的粮食作物之一,因其具有较强的环境适应性,在中国的东北、西北及西南地区广泛种植,马铃薯对干旱的耐受性研究一直都是热点之一[7-8]。目前马铃薯的耐旱性评价指标一般集中在叶片生理、光合生理、 内源激素和产量指标等方面,通过确立可靠的形态生理指标体系为耐旱品种的选育提供依据[9-10]。而叶片作为与环境直接接触的主要器官,是光合作用与蒸腾作用的主要场所,其结构特征最易受到环境条件的影响,特别是表皮结构。马铃薯与其他茄科植物一样,叶片表面着生有一层浓密的毛状体[11],毛状体按照有无分泌功能,分为具有分泌能力的腺毛和不具分泌能力的非腺毛。目前,对马铃薯叶片腺毛与非腺毛的研究主要集中在其物理特性及化学防御方面,如腺毛合成和贮存分泌的次生代谢物质能显著增强 UV-B 辐射的吸收能力[12-13];而非腺毛则具有抗虫、抗病原菌等功能[14-17]。此外,叶片的显微形态结构、解剖结构对不同生长环境的适应性变化[18]已受到很多学者的关注,如气孔密度[19]、气孔形态特征[20]、毛状体数量、毛状体与气孔的比值(T/S)[11]等表皮解剖的综合参数可作为评价植物耐旱性的重要指标。马胜等研究了干旱胁迫对马铃薯根尖和叶片超微结构、叶片解剖结构的影响[18,21-22],但目前基于扫描电镜观察叶片毛状体、气孔等指标对不同马铃薯品种(系)的耐旱性评价还未见相关文献报道。
脱落酸(abscisic acid,ABA)也参与了干旱胁迫下作物的自身调节过程,对叶片蒸腾起主要作用[23]。综合叶片表皮结构、光合特性、脱落酸含量与产量对马铃薯不同品种进行耐旱性的分析研究还未见相关文献报道。因此,本试验对干旱胁迫条件下3个马铃薯材料的叶片表皮毛特征、气孔特征、光合特性、光合色素含量、脱落酸含量等多项指标进行研究,探索不同干旱耐受性的马铃薯材料对干旱胁迫的响应差异,以期为解析马铃薯耐旱性、培育其耐旱品种提供种质资源和理论依据。
1 材料与方法
1.1 试验材料
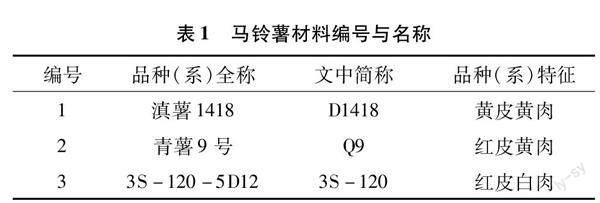
试验材料分别为干旱敏感型品种滇薯1418和耐旱中间型品种青薯9号[24-25]以及云南农业大学薯类作物研究所自有的耐旱型马铃薯品系3S-120-5D12(表1),材料均由云南农业大学薯类作物研究所提供。
1.2 试验设计
试验于2021年3—7月在云南农业大学后山室内教学实习农场进行。试验用盆规格(盆上口直径×盆深)为27.5 cm×24 cm,共90盆,每个品种设置3个处理,每个处理重复10次。土质为有机质混合土,基质土与普通土比例为2 ∶1,播种时一次性施入全生育期所需复合肥(N、P2O6、K2O含量分别为15%、5%、20%) 。试验中干旱胁迫的程度根据GB/T 32136—2015《农业干旱等级》设置T1:中度干旱[土壤相对湿度为(45±5)%]、T2:轻度干旱[土壤相对湿度为(55±5)%]2个处理,以全生育期正常供水处理为对照[土壤相对湿度为(75±5)%],采用人工称质量控水法,马铃薯幼苗期3叶1心时开始进行干旱控制,每间隔3 d随机称1次每个处理组的5盆,通过补水量公式计算出浇水量,保持处理组浇水量一致,维持干旱状态。
控制水分的标准及方法:参考云文丽等的方法,计算田间持水量和土壤相对湿度[26-27],用所换算出的补水量公式进行补水,使土壤湿度稳定在各级范围内。
补水量=[干土质量(含盆)/(1-田间持水量)×土壤相对湿度]-湿土质量(含盆) 。
1.3 试验方法
1.3.1 扫描电镜观察马铃薯叶片表皮毛特征 取样与冷冻:在块茎形成期取样,所测叶片为已测定过光合特性的叶片(倒4叶的顶小叶),擦去选取叶片表皮灰尘,为保证样本新鲜,所有叶片均现采现测,所用扫描电镜是中国科学院昆明植物研究所的蔡司Sigma 300场发射扫描电镜。2 min内切片摆放整齐、负染色剂染色、液氮冷冻、放入电镜观察区。
观察:调节电镜参数、放大倍数,观察在70倍与 500倍放大倍数下不同马铃薯品种(系)不同处理的表皮毛、气孔特征及参数的变化。计数:随机取5个视野拍照,取腺毛、非腺毛、气孔数平均值除以图片面积,即为腺毛、非腺毛、气孔的密度(个/mm2),其中,叶脉上和非叶脉上的腺毛、非腺毛数分别计数。测量的气孔长度是肾形体的气孔器长度,保卫细胞纵轴长是肾形体的保卫细胞的最长值,保卫细胞纵轴宽是肾形体的保卫细胞的最宽值,每个样本同倍数下观察2个视野,取平均值[28]。
1.3.2 马铃薯叶片光合参数和光合色素的测定 采用美国LI-COR公司LI-6400便携式光合测定系统,在晴天08:30—11:30,对处于块茎形成期的3个马铃薯品种(系)的植株倒4叶的顶叶进行光合参数测定,包括净光合速率、蒸腾速率、气孔导度和细胞间隙CO2濃度等。并将所测试的叶片摘下,装入自封袋,带回实验室用于光合色素含量分析,利用分光光度法测定叶绿素a、叶绿素b和类胡萝卜素的含量[29]。
1.3.3 马铃薯叶片脱落酸含量的测定 在马铃薯块茎形成期,随机取倒4叶的小叶,液氮速冻后储存于 -80 ℃ 冰箱里,样品寄送至苏州格锐思生物科技有限公司,采用液相色谱法测定ABA含量。
1.3.4 成熟期产量测定 于成熟期收获测定最终产量,并对各马铃薯品种(系)的平均单株块茎质量进行测定。
1.4 统计与分析
使用Microsoft Excel 2021完成试验数据分类统计,并使用SPSS数据处理系统完成单因素方差分析(ANOVA),随后对F值显著的指标使用Fisher判别法进行处理间两两比较。
2 结果与分析
2.1 不同干旱水平对马铃薯叶片表皮毛特征的影响
由图1可知,在CK中,3个材料的表皮毛密度无明显差异,但在T1处理下,滇薯1418的表皮毛数量均比其他2个材料的表皮毛数量多,在T2处理下,3个材料的表皮毛数量均比T1处理、CK中有所增加。
由表2可知,按表皮毛分布位置的不同进行分析:在T1、T2处理下,非叶脉上的腺毛数量均比叶脉上的腺毛数量多。随着干旱程度的加深 (T2至T1),3个材料的腺毛数量(叶脉、非叶脉)均减少。T2处理下,非叶脉上的腺毛数量与CK相比均增加, 其中,滇薯1418在T2处理后,非叶脉上的腺毛数量要比CK显著增加。同理,在T1、T2处理下,非叶脉上的非腺毛数量均比叶脉上的非腺毛数量多。随着干旱程度的加深(T2至T1),3个材料的非腺毛数量(叶脉、非叶脉)均减少。T2处理下,叶脉上与非叶脉上的非腺毛数量与CK相比均增加,其中,滇薯1418与3S-120在T2处理后,非腺毛数(叶脉、非叶脉)均比CK显著增加。
以不同材料的表皮毛总数进行分析:青薯9号的腺毛总数在T2处理下与CK相比数量增加但差异不显著,T1与T2处理相比显著减少,非腺毛总数T2处理下与CK相比增加但差异不显著,T1与T2处理相比显著减少;3S-120的腺毛总数在T1处理下与CK相比显著减少,在T2处理下与CK相比减少但差异不显著,非腺毛总数在T2处理下与CK相比显著增加,在T1处理下与CK相比减少但差异不显著。与前2个材料不同,滇薯1418的腺毛总数在T1处理后与CK相比基本不变,T2处理与CK相比显著增加,非腺毛总数在T1、T2处理后与CK相比均呈显著增加。说明在应对轻度干旱胁迫(T2)时,各马铃薯材料均以增加叶片腺毛总数、非腺毛总数来加强抵御干旱胁迫的能力,其中3S-120的非腺毛总数在T2处理下显著增加,说明其受干旱胁迫的影响比青薯9号显著;但在应对中度干旱胁迫(T1)时,只有干旱敏感型材料滇薯1418 增加了自身的非腺毛总数以抵御干旱。
2.2 不同干旱水平对马铃薯叶片气孔特征的影响
由图2可知,3个马铃薯材料的气孔在水分充足的CK组均处于闭合状态,而随着干旱胁迫程度的加深,不同材料的气孔启闭程度不同。其中青薯9号的气孔随着干旱程度的加深,由闭合状态逐渐变为打开状态(图2-F1);在T1与T2处理下,耐旱性品系3S-120叶片下表皮细胞保水性较好,未呈现其他2个材料缺水皱缩的现象。
由表3可知,3个品种(系)的气孔密度随着干旱程度的加深(CK至T2至T1)呈现先增大后减小的趋势,并且3个材料的气孔密度在T2处理下与CK相比均显著增加,T1与T2相比均显著减少,其中,滇薯1418的气孔密度在T1处理下与CK相比增多但差异不显著。说明T2处理使各材料增加叶片气孔密度以应对干旱胁迫,而应对中度干旱胁迫时,只有干旱敏感型材料滇薯1418增加了气孔密度以应对干旱。
3S-120的腺毛总数与气孔密度比(G/S) T1与T2相比减少但差异不显著,在 T1处理下与CK相比显著减少;滇薯1418与青薯9号的G/ST1与T2相比显著减少。说明3S-120的G/S受干旱胁迫影响最小。滇薯1418的非腺毛总数与气孔密度比(N/S)T1与CK相比显著增加,3S-120的N/S T2与CK相比显著增加,而青薯9号的各处理差异并不显著。说明干旱敏感型材料滇薯1418以增加腺毛总数、非腺毛总数、气孔密度来抵御干旱胁迫,而干旱耐受型材料青薯9号的N/S相对于3S-120受到干旱胁迫的影响更小。
青薯9号的气孔长度在T2处理后与CK相比显著减小,减幅为41.7%。3S-120的保卫细胞纵轴长在T1处理后与CK相比显著减少(P<0.05),减幅为14.3%,而各材料的保卫细胞横轴长在3个不同处理下并无明显差异。说明青薯9号的气孔长度对轻度干旱(T2)较为敏感,3S-120的保卫细胞纵轴长受中度干旱(T1)的影响显著。
2.3 不同干旱处理对马铃薯叶片光合特性的影响
从图3可以看出,T1、T2处理下3个马铃薯品种(系)块茎形成期叶片的净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr)与CK相比存在显著差异。分品种(系)分干旱梯度比较,滇薯1418 的叶片净光合速率T1与 T2相比显著降低62.9%,3S-120和青薯9号在T1与T2处理间均无明显差异,但T1相比CK均有显著减小,分别比CK降低了76.5%、81.3%。说明随着干旱胁迫程度的加深,各材料的叶片净光合速率均会降低,其中,滇薯1418的净光合速率受干旱胁迫影响最显著,T1与CK相比,3S-120 的降幅低于青薯9号,说明干旱胁迫下 3S-120 的叶片净光合速率更大。
滇薯1418的叶片气孔导度T1处理相比对照降低87.5%,T2处理相比对照降低82.5%,3S-120和青薯9号在T1、T2处理下相比对照组均无明显差异,但也呈随着干旱加深(T2至T1)气孔导度呈逐渐下降的趋势。说明随着干旱胁迫程度的加深,各材料的叶片气孔导度均会降低,其中,滇薯1418的气孔导度受干旱胁迫影响最大,而3S-120的气孔导度比青薯9号受干旱胁迫的影响更小。
叶片的胞间二氧化碳浓度在3个品种(系)的T1与T2处理间均有显著差异。滇薯1418的胞间二氧化碳浓度在T1处理下相比T2显著增加20.2%,相比CK显著增加10.9%;青薯9号的胞间二氧化碳浓度在T1处理下相比于T2显著增加18.7%,相比CK显著增加9.7%,3S-120的胞间二氧化碳浓度在T1处理下相比于T2显著增加15.1%,相比CK增加7.1%。说明随着干旱胁迫程度的加深,各材料的叶片胞间二氧化碳浓度均增加,其中,T1与T2、CK相比,滇薯1418的增幅均为最大,说明滇薯1418的胞间二氧化碳浓度受干旱胁迫影响较大,3S-120的胞间二氧化碳浓度受干旱胁迫的影响较小。
叶片的蒸腾速率在3个品种(系)的T1、T2处理与CK相比均有显著差异,而T1与T2间均无显著差异。滇薯1418的叶片蒸腾速率在T1处理下相比于CK降低94.0%,T2处理下相比于CK降低88.1%,青薯9号的叶片蒸腾速率在T1处理下相比于CK降低90.3%,T2处理下相比于CK降低76.0%,3S-120的叶片蒸腾速率在T1处理下相比于对照降低87.4%,T2处理下相比于对照降低68.6%。说明随着干旱胁迫程度的加深,各材料的叶片蒸腾速率均减少,其中,降幅最小的是 3S-120,说明其叶片的蒸腾速率受干旱胁迫影响最小。
2.4 不同干旱处理对马铃薯叶片光合色素的影响
各材料的叶绿素a含量、叶绿素b 含量、类胡萝卜素含量、总叶绿素含量均随着干旱程度的加深(T2至T1处理)而下降(图4)。分品种(系)分析,叶绿素a含量在3个品种(系)中的T1、T2处理相比CK均降低但无明显差异,青薯9号的叶绿素b含量在T1、T2处理和对照间有显著差异,T1处理比对照组降低31.2%,T2处理比对照组降低12.5%;3S-120与滇薯1418 T1、T2处理叶绿素b含量均降低但与CK差异不显著。滇薯1418的类胡萝卜素含量在T1、T2处理下和对照间有显著差异,T1比对照组降低44.4%,T2比对照组降低18.7%,3S-120 与青薯9号的类胡萝卜素含量处理组相比对照组均降低但无明显差异。滇薯1418的总叶绿素含量在T1、T2处理下和对照间有显著差异,T1比对照组降低24.1%,T2比对照组降低8.6%。3S-120 与青薯9号的总叶绿素含量处理组相比对照组均降低但无明显差异。说明随着干旱胁迫会使各材料的叶绿素a含量、叶绿素b 含量、类胡萝卜素含量、总叶绿素含量均下降,其中,滇薯1418的类胡萝卜素含量和总叶绿素含量均有显著下降,说明其受干旱胁迫影响最显著;青薯9号的叶绿素b含量在T1、T2处理下与CK相比均有显著下降,而 3S-120 的各光合色素的含量虽下降但无显著差异,说明 3S-120 的各光合色素含量受到干旱胁迫的影响均比青薯9号小。
2.5 不同干旱水平下的马铃薯叶片脱落酸的作用及相关性分析
由图5可知,在3个品种(系)中的脱落酸含量均随着干旱程度的加深而逐渐增多,滇薯1418的脱落酸含量在T1处理下相比于T2显著增加236%,相比CK显著增加435%,青薯9号的ABA含量在T1处理下相比于T2显著增加172%,相比CK显著增加382%,3S-120的ABA含量在T1处理下相比于T2显著增加102%,相比CK显著增加480%。说明各材料为了抵御干旱胁迫而使自身脱落酸含量增多,其中T1与CK相比下,3S-120的脱落酸含量增幅最大,说明其对干旱的抵御能力相对较强。
由表4、表5可知,T1处理下,ABA含量与腺毛总数、气孔密度存在显著负相关关系,相关系数分别为-0.777和-0.790,与非腺毛总数存在极显著负相关关系,相关系数为-0.819,同時,非腺毛总数与气孔密度也存在极显著的正相关关系,相关系数为0.823。T2处理下,ABA含量与腺毛总数存在极显著负相关关系,相关系数为-0.828,同时,净光合速率(Pn)与非腺毛总数存在显著正相关关系,相关系数为0.751。说明当马铃薯腺毛总数、气孔密度、 非腺毛总数增加时,叶片的ABA含量会降低,同时,当非腺毛总数提升时,净光合速率(Pn)也提升,可改善马铃薯的养分吸收与累积。
2.6 干旱胁迫对不同马铃薯品种(系)产量的影响
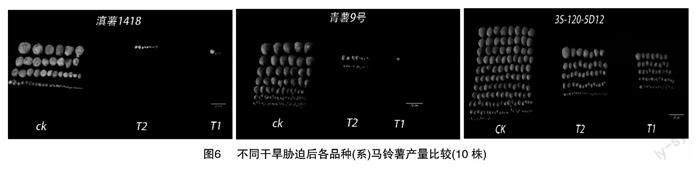
由图6与表6可知,3份马铃薯材料的平均单株块茎质量随干旱程度的加深而减少(T2至T1),其中,在T1、T2处理下与CK相比,3份马铃薯材料的平均单株块茎质量均显著下降,说明干旱胁迫对3份马铃薯材料的平均单株块茎质量均有显著影响。不同的干旱处理下,3S-120的平均单株块茎质量均为最高,在T1、T2处理下与CK相比,降幅也均最低 (86.0%、62.1%),滇薯1418的平均单株块茎质量均为最低,T1、T2与CK相比,下降幅度均最高(97.9%、94.3%)。
3 討论与结论
3.1 不同干旱水平对马铃薯叶片表皮毛特征和气孔的影响
植物表皮毛在植物适应生物和非生物胁迫过程中起着重要的作用,如提高植物的抗性、减少水分流失、增强耐极端温度的能力[30]。本研究中在轻度干旱胁迫(T2)下,各马铃薯材料均以增加叶片腺毛总数、非腺毛总数来加强抵御干旱胁迫的能力,其机制可能是增加的表皮毛密度可以增加气孔扩散的阻力,减少叶片水分的丧失,与部分耐旱植物叶片布满绒毛的机制相似。在应对中度干旱胁迫(T1)时,只有干旱敏感型材料滇薯1418增加了自身的非腺毛总数以抵御干旱,猜测马铃薯通过增加表皮毛数量能一定程度上避免自身受到干旱胁迫的伤害。
气孔可以调节气体交换,能直接对植株叶片的水分状态起控制作用[11]。气孔密度与气孔大小对许多物种耐旱性的影响已被广泛研究[31-32]。前人研究表明,在水分亏缺条件下,低气孔密度和改善的耐旱性能之间存在联系[33-34],也有证据表明植物在水分亏缺条件下会调整气孔密度[33],使植物的气孔密度降低,已经在小麦中得到验证[35],相比之下,对于菜豆和羊草[36],气孔密度在干旱条件下会增加。这些相互矛盾的观察结果表明,水分亏缺对气孔密度的影响在不同物种之间存在差异,应该根据具体情况进行研究。在本研究中,不同品种(系)间气孔的长度没有显著差异,因此计算了腺毛总数与气孔密度比(G/S)、非腺毛总数与气孔密度比(N/S)作为表皮解剖的综合参数,滇薯1418的G/S则在T1与T2相比时显著减少,N/S在T1与CK相比时显著增加,猜测干旱敏感型品种滇薯1418可能为防止水分过度丧失,使其腺毛和非腺毛数量增多,增加其对干旱的抵御和避害的能力。根据本试验结果,3个品种(系)的气孔密度随着干旱程度的加深(CK至T2至T1)呈现先增大后减小的趋势,并且,3个材料的气孔密度在T2处理下与CK相比均显著增加,T1与T2相比均显著减少,猜测马铃薯可能属于轻度干旱下气孔密度增加,中度干旱下气孔密度减少的作物,即适度的干旱可能增加叶片气孔密度,而过度干旱则使叶片气孔密度下降,这与前人的研究结果相似,其原因可能是轻度干旱胁迫使细胞伸长受抑制,导致叶面积减少,即单位面积的气孔数量增加,气孔密度上升[37]。马铃薯叶片对干旱胁迫的初期响应可能是通过调节气孔导度、关闭气孔以减少失水,表皮细胞的水分状况(膨压)可能是叶水力特性和气孔调节的关键点[38-39]。气孔对化学信号的响应目前有2种观点:一种是认为脱落酸直接作用于叶片保卫细胞,另一种是认为脱落酸通过叶肉细胞中离子间接作用于叶片保卫细胞[40-41]。在本研究中,并未呈现出“水分充足时气孔张开,水分亏缺时气孔闭合”的状态,反而是在水分充足条件下气孔闭合较多,其中青薯9号的气孔随着干旱程度的加深,由闭合状态逐渐变为打开状态,失去更多水分,呈现出气孔闭合能力较弱的现象,猜测气孔的启闭可能受到脱落酸的调控,由于脱落酸含量过低导致气孔开启,而脱落酸含量的减少与其合成源头有关。由表4可知,T1处理下,脱落酸含量与腺毛总数、气孔密度存在显著负相关,所以气孔闭合可能是受到叶片中脱落酸的调控,也可能是蒸发旺盛导致叶片气孔关闭,还可能是取样当时的大气湿度明显降低引起的叶片气孔关闭,具体还有待进一步研究。
3.2 不同干旱水平对马铃薯叶片光合特性和光合色素的影响
干旱胁迫还会影响马铃薯的光合生理,使其在干旱胁迫下气孔关闭,因吸收的 CO2 量减少,光合速率下降,导致最终产量减少,水分利用效率降低[41-42]。前人关于植物光合特性的研究则主要集中于对植株叶片光合特性的研究,张向娟等研究棉花叶片光合生理对干旱胁迫的响应,表明植物的光合能力会随着干旱胁迫程度的加深而减弱,从而使植物的生长受到阻碍[43];李鑫等通过研究不同干旱程度对马铃薯光合特性和耐旱性的影响,结果呈现马铃薯的叶绿素含量和光合参数与耐旱性有关[44];海梅荣等以会-2为试验材料,研究了马铃薯生理特性受干旱胁迫的影响,结果表明,在光合生理方面,马铃薯叶绿素含量和光合参数均会随着干旱胁迫的加剧而降低[45]。在本研究中,随着干旱程度的加深(T2至T1),3个品种(系)叶片的净光合速率、气孔导度、蒸腾速率均相比CK显著降低,与前人的研究结果一致;各品种(系)的叶片总叶绿素、类胡萝卜素的含量也均随着干旱程度的加深而下降,与前人的研究结果一致。而胞间二氧化碳浓度在T1处理下均比对照显著增加,与本研究中青薯9号 的叶片在中度干旱(T1)状态下,气孔由闭合状态逐渐变为打开状态,失去更多水分,呈现出气孔闭合能力较弱的现象呼应,因此可能是中度干旱 (T1)下,气孔密度降低以及气孔的闭合能力较弱,对CO2的吸收速率较弱,使得胞间二氧化碳浓度升高,水分的损失速率加大,使其光合作用受到影响,最终使其产量受到影响,而 3S-120的叶片净光合速率、气孔导度、胞间二氧化碳浓度、蒸腾速率、各光合色素含量(叶绿素a含量、叶绿素b 含量、类胡萝卜素含量、总叶绿素含量)受到干旱胁迫影响均比青薯9号小,最终产量也最大,说明光合特性与光合作用受干旱胁迫影响越小,产量越大。
3.3 不同干旱水平对的马铃薯叶片脱落酸与产量的影响
当土壤水分不足时,马铃薯会产生一定的内源激素对其生理活动进行调节,这种内源激素包括很多类型,其中对蒸腾起主要作用的激素为脱落酸[23]。说明马铃薯在土壤水分不足时,叶片可通过对渗透物质、保护酶和内源激素的调节来维持自身的正常生理代谢功能,来抵抗水分亏缺带来的影响。 由此可见马铃薯对土壤水分亏缺具有一定的调节和适应能力,也说明了其对土壤干旱胁迫逆境所表现出来的耐旱和避旱作用机制。田伟丽等发现在马铃薯干旱脱水等条件下,胁迫信号会激发脱落酸合成酶的作用,使脱落酸在细胞内的含量快速发生改变,并且随着水分胁迫程度增加马铃薯叶片中 脱落酸含量呈递增趋势[46]。 在本研究中,在3个马铃薯品种(系)中的脱落酸含量均随着干旱程度的加深(T2至T1)而逐渐增多,这与前人的研究结果一致。T1处理下,脱落酸含量与腺毛总数、气孔密度存在显著负相关,与非腺毛总数存在极显著负相关,T2处理下,脱落酸含量与腺毛总数存在极显著负相关,因此叶片腺毛数、非腺毛数、气孔密度均可能受到脱落酸的调控,具体调控的机制还有待进一步研究。试验中得出叶表皮层(包括保卫细胞)中的脱落酸含量增多,但至于叶表皮层中增加的脱落酸是来自根部还是叶肉细胞,抑或是在保卫细胞中合成,以及气孔的启闭是否更大程度取决于脱落酸含量调控,目前都尚不确定有待研究。
由表6可知,干旱胁迫对3S-120最终产量影响最小,对滇薯1418的最终产量影响最大。综合最终产量数据及各指标分析结果,验证了耐旱型材料3S-120能在干旱胁迫下更好地调节光合特性与光合作用,增加脱落酸含量,使最终产量增多,而干旱敏感型的材料滇薯1418通过调节叶片腺毛总数、非腺毛总数、气孔密度来抵御干旱胁迫,但此抵御机制对最终产量并无显著影响。
综上所述,马铃薯的表皮毛主要集中在叶片下表皮的非叶脉区域,各马铃薯品种(系)的叶片表皮毛数量和气孔密度对轻度干旱(T2处理)响应较为一致:表皮毛数量均呈增多趋势,气孔口径和开度减小。中度干旱(T1)胁迫下,干旱敏感型材料滇薯1418以增加腺毛总数、非腺毛总数、气孔密度来抵御干旱胁迫,叶片的净光合速率、气孔导度容易受到干旱胁迫的影响而显著降低;中间型材料青薯9号的腺毛总数、非腺毛总数与气孔密度比受干旱胁迫影响较小,但其在中度干旱胁迫下气孔为开启状态;而耐旱型材料 3S-120的叶片净光合速率(Pn)、气孔导度、胞间二氧化碳浓度、蒸腾速率、各光合色素含量(叶绿素a含量、叶绿素b 含量、类胡萝卜素含量、总叶绿素含量)受到干旱胁迫影响均比青薯9号小,且ABA含量随着干旱程度加深,增幅最大,说明其对干旱的抵御能力也相对最强。结合最终产量验证:耐旱型材料3S-120能在干旱胁迫下更好地调节叶片光合特性与光合作用,增加ABA含量,抵抗水分亏缺,使最终产量增多,干旱敏感型材料滇薯1418通过调节叶片腺毛总数、非腺毛总数、气孔密度来抵御干旱胁迫。
参考文献:
[1]Zhang Q,Yao Y B,Li Y H,et al. Causes and changes of drought in China:research progress and prospects[J]. Journal of Meteorological Research,2020,34(3):460-481.
[2]王莉莉,殷丛培,李 峰,等. 马铃薯根际土壤细菌群落结构及其对干旱胁迫的响应[J]. 中国农业科技导报,2022,24(6):58-69.
[3]陈 征,许嘉阳,范艺宽,等. 不同烤烟品种幼苗形态结构及光合参数对干旱胁迫响应机制的差异[J]. 中国生态农业学报,2016,24(11):1508-1520.
[4]Ilyas M,Nisar M,Khan N,et al. Drought tolerance strategies in plants:a mechanistic approach[J]. Journal of Plant Growth Regulation,2021,40(3):926-944.
[5]Seleiman M F,Al-Suhaibani N,Ali N,et al. Drought stress impacts on plants and different approaches to alleviate its adverse effects[J]. Plants,2021,10(2):259.
[6]Yang X Y,Lu M Q,Wang Y F,et al. Response mechanism of plants to drought stress[J]. Horticulturae,2021,7(3):50.
[7]郑植尹,王 芳. 干旱胁迫对马铃薯生理特性及解剖结构的影响[J]. 中国农学通报,2021,37(8):14-24.
[8]潘 念,苏 旺,周 云,等. 土壤水分胁迫对马铃薯生长发育 光合特性和产量的影响[J]. 河北农业科学,2022,26(1):70-75,94.
[9]赵媛媛,石 瑛,张丽莉. 马铃薯抗旱种质资源的评价[J]. 分子植物育种,2018,16(2):633-642.
[10]杨宏羽,平海涛,王 蒂,等. 不同倍性马铃薯品种的抗旱性[J]. 中国沙漠,2016,36(4):1041-1049.
[11]Galdon-Armero J,Fullana-Pericas M,Mulet P A,et al. The ratio of trichomes to stomata is associated with water use efficiency in Solanum lycopersicum (tomato)[J]. The Plant Journal,2018,96(3):607-619.
[12]Schilmiller A L,Last R L,Pichersky E.Harnessing plant trichome biochemistry for the production of useful compounds[J]. The Plant Journal,2008,54(4):702-711.
[13]Liakopoulos G,Stavrianakou S,Karabourniotis G.Trichome layers versus dehaired lamina of Olea europaea leaves:differences in flavonoid distribution,UV-absorbing capacity,and wax yield[J]. Environmental and Experimental Botany,2006,55(3):294-304.
[14]植漢成,郭宝林,葛 菲,等. 非腺毛形态在(药用)植物分类和植物类药材鉴别方面的研究进展[J]. 中国现代中药,2018,20(4):489-494.
[15]宋海慧. 番茄表皮毛特征及其在抗胁迫中的功能研究[D]. 哈尔滨:东北农业大学,2017.
[16]刘艳霞,马亚丽,兰海燕. 植物非腺毛形态发生及其功能研究进展[J]. 植物生理学报,2018,54(10):1527-1534.
[17]李 俊,杨玉皎,王文丽,等. UV-B辐射增强对马铃薯叶片结构及光合参数的影响[J]. 生态学报,2017,37(16):5368-5381.
[18]马 胜,齐恩芳,文国宏,等. 基于叶片显微结构综合评价马铃薯不同品种的抗旱性[J]. 中国马铃薯,2021,35(6):500-506.
[19]王 坤,韦晓娟,李宝财,等. 金花茶组植物叶解剖结构特征与抗旱性的关系[J]. 中南林业科技大学学报,2019,39(12):34-39.
[20]王锋堂,杨福孙,卜贤盼,等. 干旱胁迫下热带樱花叶片与气孔形态变化特征研究[J]. 热带作物学报,2017,38(8):1441-1445.
[21]秦天元,孙 超,毕真真,等. 马铃薯不同耐旱品系管栽苗及其根尖显微结构对干旱胁迫的响应[J]. 生物技术通报,2018,34(12):102-109.
[22]卢福顺. 水分胁迫对马铃薯生理指标和叶片结构的影响[D]. 哈尔滨:东北农业大学,2013:31-37.
[23]杨 波,田 露,王兰兰. 脱落酸调节植物气孔运动机制的研究进展[J]. 安徽农业科学,2014,42(25):8483-8485.
[24]鲁骄阳. 干旱胁迫对马铃薯叶片生理指标及块茎产量品质的影响[D]. 昆明:云南农业大学,2015.
[25]李鹏程,毕真真,孙 超,等. DNA甲基化参与调控马铃薯响应干旱胁迫的关键基因挖掘[J]. 作物学报,2021,47(4):599-612.
[26]云文丽,贾成朕. 河套地区食用向日葵干旱等级指标研究[J]. 干旱地区农业研究,2021,39(3):218-223.
[27]杨 鑫. 云南高原地区冬小麦需水规律及生长指标响应研究[D]. 昆明:云南农业大学,2017.
[28]刘朝霞. 土壤干旱胁迫对番茄根系生长、气孔特性及保护酶活性的影响[D]. 南京:南京信息工程大学,2016.
[29]张志良,瞿伟菁. 植物生理学实验指导[M]. 3版.北京:高等教育出版社,2003:67-70.
[30]Valverde P L,Fornoni J,Núez-Farfán J. Defensive role of leaf trichomes in resistance to herbivorous insects in Datura stramonium[J]. Journal of Evolutionary Biology,2001,14(3):424-432.
[31]Hetherington A M,Woodward F I. The role of stomata in sensing and driving environmental change[J]. Nature,2003,424(6951):901-908.
[32]Lawson T,Blatt M R. Stomatal size,speed,and responsiveness impact on photosynthesis and water use efficiency[J]. Plant Physiology,2014,164(4):1556-1570.
[33]Farber M,Attia Z,Weiss D. Cytokinin activity increases stomatal density and transpiration rate in tomato[J]. Journal of Experimental Botany,2016,67(22):6351-6362.
[34]Zhao L N,Li Y Q,Xie Q,et al. Loss of CDKC;2 increases both cell division and drought tolerance in Arabidopsis thaliana[J]. The Plant Journal,2017,91(5):816-828.
[35]Li Y P,Li H B,Li Y Y,et al. Improving water-use efficiency by decreasing stomatal conductance and transpiration rate to maintain higher ear photosynthetic rate in drought-resistant wheat[J]. The Crop Journal,2017,5(3):231-239.
[36]Gan Y,Zhou L,Shen Z H,et al. Stomatal clustering,a new marker for environmental perception and adaptation in terrestrial plants[J]. Botanical Studies,2010,51:325-336.
[37]谢兆森,宋世鑫,曹紅梅. 不同蓝莓品种的叶片结构和气孔特性比较[J]. 北方园艺,2015(4):5-8.
[38]王卫锋. 植物整体水分平衡的生理生态调控机制研究[D]. 北京:中国科学院大学,2013:9-10.
[39]蔡庆生. 植物生理学[M]. 北京:中国农业大学出版社,2014:19-23.
[40]金建新,李株丹,桂林国. 不同滴灌量下马铃薯脱落酸产生及对气孔活动的调节作用[J]. 中国农村水利水电,2023(7):168-172.
[41]段育龙. 植物叶片保卫细胞液胞融合对气孔运动的调节作用[D]. 兰州:兰州大学,2014:12-29.
[42]胡朋成,尹 娟,魏小东,等. 不同水氮处理对马铃薯品质及土壤脲酶活性的影响[J]. 江苏农业科学,2022,50(6):87-92.
[43]张向娟. 干旱胁迫下棉花叶片光合特性的适应机制研究[D]. 石河子:石河子大学,2014.
[44]李 鑫,孙 超,毕真真,等. 不同干旱水平对马铃薯光合特性和耐旱性的影响[J]. 植物生理学报,2019,55(8):1197-1210.
[45]海梅荣,陈 勇,周 平,等. 干旱胁迫对马铃薯品种生理特性的影响[J]. 中国马铃薯,2014,28(4):199-204.
[46]田伟丽,王亚路,梅旭荣,等. 水分胁迫对设施马铃薯叶片脱落酸和水分利用效率的影响研究[J]. 作物杂志,2015(1):103-108.
收稿日期:2022-12-28
基金项目:国家马铃薯产业技术体系建设专项(编号:CARS-09-15P);云南省科技厅重大科技专项(编号:202102AE090018)。
作者简介:邢 媛(1998—),女,云南玉溪人,硕士研究生,主要从事马铃薯栽培及逆境生理研究。E-mail:ynxy920@163.com。
通信作者:李 俊,博士,副教授,硕士生导师,主要从事马铃薯栽培及逆境生理研究。E-mail:nxy8mm@163.com。

