NaCl 胁迫下壳聚糖促进菜用大豆根毛生长和根尖内源IAA 积累的机理
郝佳奇,孟 飞,李 星,王 聪
(内蒙古民族大学农学院,内蒙古通辽 028042)
豆科植物生长发育过程中的显著特点是根瘤菌侵染根系形成根瘤,从而利用空气中的N2逐步转化为NH3,为植株提供60%以上的氮素[1]。根毛是根系表面向外延伸的结构,不仅参与植物营养吸收,同时在根系与外界微生物相互作用过程中发挥着重要作用。研究发现,根瘤菌通过交换信息物质与根毛相互识别是形成根瘤的首要阶段[2]。苗期豆科植物根毛分泌物可以吸引土壤中根瘤菌[3],如根毛通过分泌凝集素(lectins)与根瘤菌分泌的多糖物质专性结合,吸附根瘤菌[4-5];分泌的类黄酮,可以诱导根瘤菌在根毛附近大量聚集并产生多种物质,使根毛卷曲变形[6],同时,根毛细胞壁发生内陷溶解,根瘤菌由此侵入根毛形成侵入线,最终结瘤[7]。可见,根毛在根瘤菌侵染过程中发挥着极其重要的作用。然而,根毛的形成和生长与环境因素密切相关。已有研究表明,在外界环境变化时,植物通过改变根毛与非根毛细胞的比例、改变根毛长度等方式增加或减少根表面积[8]。高浓度的 NaCl 胁迫会使根毛密度降低、缩短根毛长度,改变植株根部的形态[9]。卢学琴等[10]发现,在一定浓度的 NaCl 条件下,剑麻幼苗根毛生长受到显著抑制,且加剧了根毛的萎缩和脱落。徐芬芬[11]和王爱斌[12]的研究表明,盐胁迫抑制水稻、小白菜的根毛发育,影响根系生长。生长素(IAA)是决定根毛形成与生长的关键因素[13],环境调控根毛表型的过程中,一般来说都会伴随着植物激素表达量的变化[14-15]。IAA 是在植物生长旺盛部位合成的极性小分子弱酸性化合物(吲哚类似物),其本质是吲哚乙酸。研究发现,IAA 主要通过合成、降解和运输等方式改变其在植物体内积累的部位和浓度,以此调控植物的生长发育以及根毛的生长[16-17]。
壳聚糖(CTS)是由甲壳素脱乙酰化形成的一种直链多糖,其能增强植物抗逆性的观点已得到普遍证实。研究发现,壳聚糖可以提高盐胁迫下苜蓿种子的发芽率[18]。壳聚糖处理显著提高了盐胁迫下黄瓜[19]、玉米[20]及豇豆[21]等幼苗的抗盐性,叶面喷施壳聚糖还可以提高番茄幼苗[22]对土壤镉胁迫的抗性。本项目组近期的研究发现,外源壳聚糖显著提高了NaCl 胁迫下菜用大豆的结瘤数和植株全氮含量[23],表明外源壳聚糖可提高盐胁迫下菜用大豆的结瘤固氮能力。但盐胁迫下壳聚糖对豆科植物,特别是对菜用大豆结瘤调控机制的研究尚鲜有报道。本试验通过研究NaCl 胁迫下壳聚糖对菜用大豆根毛生长及根尖内源IAA 积累的影响,探讨外源壳聚糖如何调控NaCl 胁迫下菜用大豆根尖内源IAA 积累及根毛生长,进而影响结瘤,以期为深入研究盐胁迫下壳聚糖促进菜用大豆结瘤的调控机制提供新的线索。
1 材料与方法
1.1 试验材料
菜用大豆选用主栽品种‘绿领八号’,根瘤菌选择与其共生匹配性较好的慢生型根瘤菌 USDA122(购自黑龙江省农业科学院微生物研究所)。壳聚糖购自北京索宝来科技有限公司(Solarbio),脱乙酰度≥90.0%,黏度为20.0~500.0 mPa。
1.2 试材培育
播种钵准备:选口径和高都为10 cm 且底部有小孔的塑料苗钵,引纱布条穿过钵底(所有纱布条的长、宽规格一致),装入蛭石,蛭石中加入用无菌蒸馏水配制的无氮营养液,以抓紧不滴水,松开不抱团为宜,然后将塑料钵置于口径 10 cm 装有 1/2 Fahraeus 无氮营养液[24]的组培瓶上方,塑料钵底部不接触到营养液,纱布条浸入液体用于吸取营养液,以维持塑料钵中营养液浓度和NaCl 浓度。
播种及出苗后培养:将催芽且发芽一致的种子播在装有蛭石的塑料苗钵中,每钵 1 粒,上面覆盖厚约2 cm 的蛭石。出苗后,白天光强为150 μmol/(m2·s),光周期为14 h 光照/10 h 黑暗,昼夜温度保持在25℃/18℃。
1.3 试验方案
1.3.1 试验处理 试验设置如4 个处理:CK,根部供无氮营养液,叶面喷施蒸馏水;T1,根部供无氮营养液,叶面喷施壳聚糖水溶液;T2,根部供溶有NaCl 的无氮营养液,叶面喷施蒸馏水;T3,根部供溶有 NaCl 的无氮营养液,叶面喷施壳聚糖水溶液。每处理3 次重复,每重复12 钵(株),完全随机排列。
1.3.2 壳聚糖诱导 T1 和T3 处理待幼苗两片真叶完全展开后进行壳聚糖处理,壳聚糖的适宜浓度为200 mg/L[25],均匀喷洒于幼苗叶片正、反两面,以量足但不向下滴落为宜,每处理用量为90 mL。同时,CK 与T2 处理喷洒蒸馏水。
1.3.3 NaCl 处理及接种 NaCl 处理在壳聚糖处理5 天后进行,NaCl 的适宜浓度为 50 mmol/L[26](在此浓度下,菜用大豆的生长会受到显著抑制,但能够形成根瘤)。向T2、T3 处理的幼苗钵中浇灌溶有NaCl 的无氮营养液,同时将组培瓶内也更换为溶有NaCl 的无氮营养液;CK、T1 处理只浇灌无氮营养液(浇液量同T2、T3 处理),同时组培瓶内也更换为无氮营养液。此后,每2~3 天将组培瓶内相应的营养液更换1 次。
NaCl 处理后随即进行接种。将摇匀的OD600值为0.1 的菌悬液用移液枪吸取1 mL,然后均匀喷注到每株幼苗根部周围,然后再覆盖约1 cm 厚蛭石保湿。放入培养室中培养,培养条件同上。
1.4 指标测定及方法
1.4.1 根毛生长指标的测定 在NaCl 处理后的第2、3、4、5 天时,将菜用大豆幼苗从塑料钵中取出,用清水将根系冲洗干净后,用体式显微镜观察幼苗根系的根毛总数、根毛密度、根毛长度、根毛起始距离及变形根毛数并拍照,随后分别测定各指标。
根毛总数和变形根毛数测定:自上而下从植株上选取 4 条侧根,每条侧根从下而上间隔2 cm 选取5 个视野,视野面积为1 cm2,用体式显微镜观察每个视野下的根毛数和变形根毛数,拍照后用ImageJ软件进行测数。4 条侧根的根毛数、变形根毛数的平均值即为该处理的根毛总数、变形根毛数[27]。
根毛密度测定:根毛密度=根毛总数×放大倍数/放大后的视野面积,每条根的根毛密度取5 个视野(1 cm2)下的平均值,4 条根的平均值为该处理的根毛密度[28]。
根毛长度测定:自上而下随机选取 4 条侧根,每条侧根随机测量10 条根毛,在体式显微镜下拍照后,用 ImageJ 软件测量根毛长度,4 条侧根的平均值为该处理的根毛长度[29]。
根毛起始距离:根毛起始距离是从根尖开始至第一个根毛出现的距离,用体式显微镜拍取相应部位照片后,利用ImageJ 软件进行测量[30]。
1.4.2 内源IAA 含量及相关指标测定 在NaCl 处理后的第 2、3、4、5 天时取出植株将根系冲洗干净,然后测定根系的MDA 含量,取根尖(长约1 cm左右)测定IAA 含量,吲哚乙酸氧化酶(IAAO)、过氧化物酶(POD)活性。
IAA 含量参照李明方[31]的方法测定,IAAO 活性参照张志良[32]的方法测定,POD 活性参照陈建勋等[33]的方法测定,MDA 含量参照邹琦[34]的方法测定。
1.4.3 根瘤数、根瘤重、植株干重及植株含氮量测定NaCl 处理30 天后,将幼苗从塑料钵中取出,用清水将根部冲洗干净后,立即测定结瘤数及根瘤鲜重,然后将植株烘干测定其干重和含氮量,植株含氮量采用凯氏定氮法测定[35]。
1.5 数据分析
用 SPSS 软件进行方差分析,采用 Duncan’s 新复极差法进行多重比较。
2 结果与分析
2.1 壳聚糖对 NaCl 胁迫下菜用大豆结瘤固氮及植株生长的影响
由图1 可看出,T1 处理的菜用大豆植株长势明显好于CK,T3 处理的植株长势明显好于T2 处理。表1 显示,生长 30 天后,NaCl 胁迫下T2 处理的菜用大豆的结瘤数、根瘤鲜重、植株含氮量及植株干重分别较CK 显著下降了 67%、80%、29%和 42%,而喷施了壳聚糖的T3 处理上述各指标较T2 处理分别升高 84%、151%、20%、54%,但均显著低于CK。T1 处理下,菜用大豆的结瘤数、根瘤鲜重、植株含氮量及植株干重均显著高于CK 处理,增幅分别为 38%、18%、12%、7%。可见,无论是盐胁迫条件还是无盐条件,壳聚糖处理均能显著促进菜用大豆的结瘤固氮,进而促进植株生长。

表1 NaCl 胁迫下喷施壳聚糖对菜用大豆结瘤能力及植株生长的影响Table 1 Effects of chitosan foliar application on nodule number and plant growth of vegetable soybean under NaCl stress

图1 NaCl 胁迫25 天时不同处理下菜用大豆植株生长状况Fig.1 Vegetable soybean plants under different treatments after 25 days of NaCl stress
2.2 壳聚糖对NaCl 胁迫下菜用大豆根毛生长和根毛变形的影响
2.2.1 壳聚糖对NaCl 胁迫下菜用大豆根毛总数的影响 根毛数量的多少对豆科植物的结瘤有着显著影响。如图2、图3A 所示,NaCl 胁迫(T2)导致菜用大豆的根毛总数大幅减少,处理第2、3、4、5 天时的降幅分别达CK 的46%、56%、45%、35%,而壳聚糖处理(T3)后菜用大豆的根毛总数显著增加,较T2 处理的增幅分别达 49%、69%、42%、26%,可见,外源壳聚糖可显著缓解盐胁迫对根毛形成的危害。T1 处理使菜用大豆在第2、4、5 天时的根毛总数均显著高于CK 处理,平均增幅达16%。说明在无盐条件下,壳聚糖对菜用大豆根毛的形成也有促进作用。

图2 NaCl 胁迫第 5 天时不同处理下菜用大豆根毛的生长状况Fig.2 Growth of root hairs of vegetable soybean under different treatments on the 5th day of NaCl stress
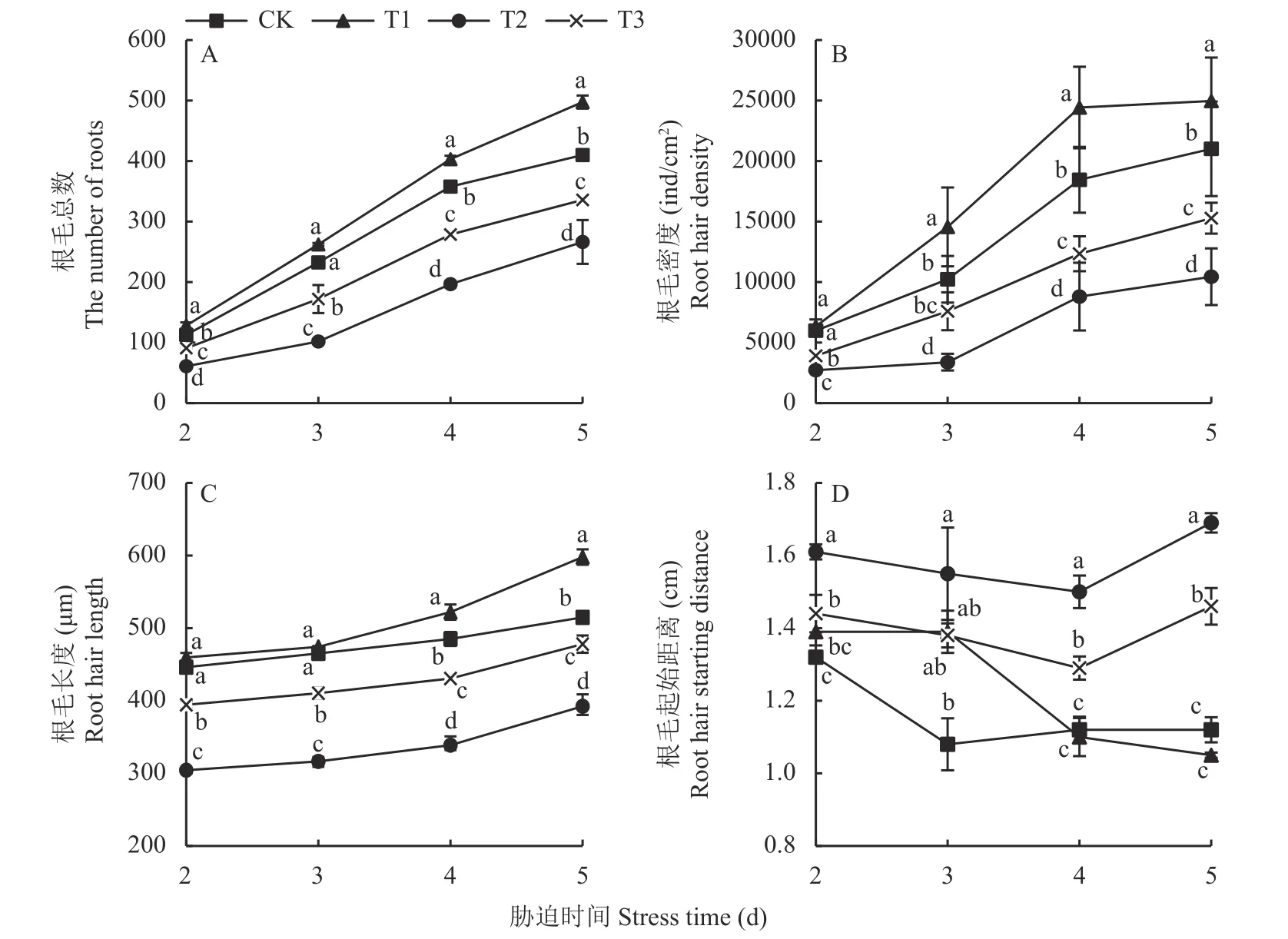
图3 NaCl 胁迫下壳聚糖处理对菜用大豆根毛生长的影响Fig.3 Effects of chitosan treatment on root hairs growth of vegetable soybean under NaCl stress
2.2.2 壳聚糖对NaCl 胁迫下菜用大豆根毛密度的影响 由图3B 可知,菜用大豆的根毛密度在NaCl胁迫(T2)期间均较CK 处理显著下降,其中在第3天时的降幅高达67%。T3 处理后,各时期的根毛密度与T2 处理相比均显著增加,在第2、3、4、5 天时增幅分别达44%、125%、40%、46%。T1 处理下菜用大豆在第3、4、5 天时的根毛密度均显著高于CK 处理,增幅分别为42%、32%、19%。可见,不论是有盐胁迫还是无盐条件,壳聚糖对菜用大豆根毛的发生都具有显著诱导作用。
2.2.3 壳聚糖对NaCl 胁迫下菜用大豆根毛长度的影响 NaCl 胁迫(T2)后,菜用大豆的根毛长度显著缩短(图2、图3C),整个胁迫期间的平均降幅达CK 的30%,而壳聚糖处理(T3)后使盐胁迫下菜用大豆的根毛长度大幅增长,在第2、3、4、5 天时增幅分别达30%、30%、27%、22%。T1 处理下,菜用大豆的根毛长度在第4、5 天时均显著高于 CK 处理。可见,外源壳聚糖对盐胁迫和无盐条件下菜用大豆的根毛生长均呈现出显著的促进作用。
2.2.4 壳聚糖对NaCl 胁迫下菜用大豆根毛起始距离的影响 根毛起始距离可直观地反映出根毛区的大小。如图3D 所示,T2 处理使菜用大豆的根毛起始距离显著增大,整个胁迫期间的平均增幅达CK处理的 38%。壳聚糖处理(T3)后,胁迫第 2、4、5天时的根毛起始距离均较T2 处理显著缩短,平均降幅达13%,说明壳聚糖处理可显著扩大NaCl 胁迫下菜用大豆的根毛区。T1 处理在各个时期均与CK 处理无显著差异,说明对根毛起始距离而言,壳聚糖在无盐条件下并未显现诱导效应。
2.2.5 壳聚糖对NaCl 胁迫下菜用大豆变形根毛数的影响 菜用大豆根毛被根瘤菌侵染后会出现卷曲变形,即变形根毛。由图4、图5 可知,T2 处理使菜用大豆变形根毛数显著降低,处理第 2、3、4、5天时较CK 的降幅分别达 35%、56%、32%、23%,说明NaCl 胁迫显著抑制了菜用大豆根系被侵染。壳聚糖处理(T3)后,NaCl 胁迫下各时期的变形根毛数均较T2 显著增加,增幅分别达12%、79%、31%、17%。T1 处理使菜用大豆在第3、4、5 天时的变形根毛数均较CK 处理显著增加,平均增幅达20%。可见,在盐胁迫和无盐条件下壳聚糖都能显著诱导菜用大豆根系被侵染。

图4 NaCl 胁迫第5 天时不同处理下菜用大豆根毛变形状况Fig.4 Deformation of root hairs of vegetable soybean under different treatments on the 5th day of NaCl stress
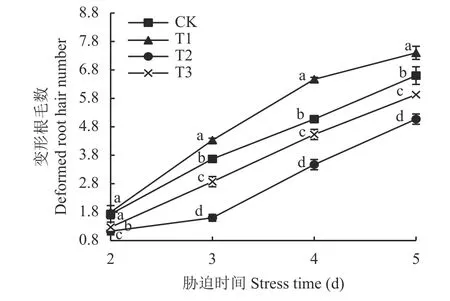
图5 不同处理菜用大豆变形根毛数随 NaCl胁迫时间的变化Fig.5 Dynamics of deformed root hair number of vegetable soybean with NaCl stress days
2.3 壳聚糖对NaCl 胁迫下菜用大豆根尖内源IAA 积累的影响
2.3.1 壳聚糖对NaCl 胁迫下菜用大豆根尖内源IAA含量的影响 由表2 可知,NaCl 胁迫(T2)显著抑制了菜用大豆根尖的内源IAA 含量,胁迫期间较CK 的平均降幅达31.4%。壳聚糖处理(T3)后,胁迫第2 天时与T2 差异不显著,其余时期均较T2显著升高,在第3、4、5 天时增幅分别达21.2%、39.8%、36.9%,其中第4 天时达对照水平。T1 处理在第3 天时的IAA 含量较CK 显著升高,其余时期均与对照无显著差异。可见,盐胁迫下壳聚糖处理促进了菜用大豆在胁迫中、后期根尖内源IAA 的积累;无盐条件下,壳聚糖仅在前期对根尖内源IAA的积累有诱导效应。
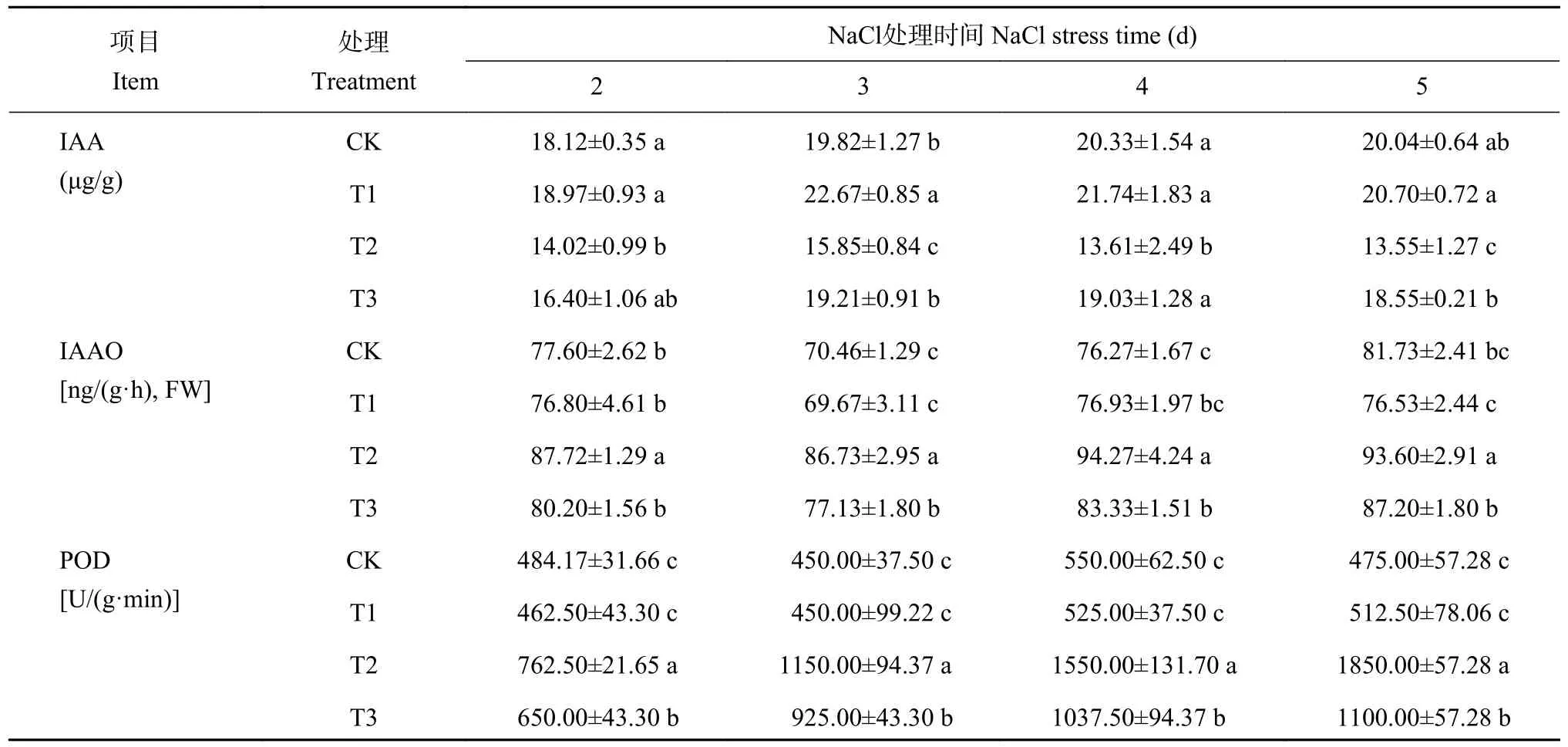
表2 壳聚糖对NaCl 胁迫下菜用大豆根尖内源IAA 水平的影响Table 2 Effects of chitosan on endogenous IAA content in vegetable soybean root tips under NaCl stress
2.3.2 壳聚糖对NaCl 胁迫下菜用大豆根尖IAAO 活性和POD 活性的影响 NaCl 胁迫(T2)显著升高了IAAO 和POD 的活性,与CK 处理相比,IAAO的活性平均升高了18.6%;POD 活性在胁迫第2 天时升高了57.5%,而其余时期的增幅均在1.5 倍以上。壳聚糖处理(T3)后,IAAO 和POD 的活性均较T2 显著下降,其中IAAO 活性的平均降幅为9.5%,POD 活性的平均降幅达27.0%。无盐条件下,壳聚糖处理对IAAO 和POD 的活性均无显著影响(表2)。
2.3.3 壳聚糖对NaCl 胁迫下菜用大豆根系MDA 含量的影响 MDA 含量是反映细胞膜脂过氧化程度的重要指标。由图6 可见,NaCl 胁迫(T2)下,菜用大豆根系MDA 含量大幅升高,其中第2 天时的增幅达CK 处理的1.1 倍,其余时期的平均增幅亦达CK处理的41.9%。壳聚糖处理(T3)显著降低了NaCl 胁迫下菜用大豆根系的MDA 含量,胁迫第2、3、4、5 天时的降幅分别为24.6%、17.4%、13.3% 和14.3%。无盐条件下,壳聚糖对MDA 含量无明显影响。说明盐胁迫下壳聚糖有效缓解了菜用大豆根系的膜脂过氧化。
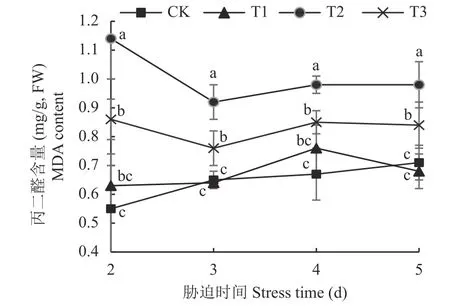
图6 不同处理菜用大豆根系 MDA 含量随 NaCl胁迫时间的变化Fig.6 Dynamics of vegetable soybean root MDA content with NaCl stress days
3 讨论
逆境胁迫可通过影响豆科寄主植物根毛发育进而影响结瘤。Duzan 等[36]研究发现,NaCl 胁迫使大豆根毛发育不良而不宜结瘤。干旱胁迫通常减少豆科植物根毛数目,或形成不正常的根毛而妨碍根瘤形成,降低结瘤数量,甚至使根系无法结瘤[37-38]。本研究中,NaCl 胁迫减少了菜用大豆根毛总数、密度及长度,增加了根毛的起始距离,同时大幅降低了变形根毛数,抑制了结瘤固氮,致使植株的生长受阻。喷施壳聚糖后,NaCl 胁迫下菜用大豆的根毛区扩大,根毛大量形成,根毛的长度和密度增加,变形根毛数亦大幅提高,促进了根瘤的形成和生长,提高了固氮量,进而促进了植株生长,这与王晓锋等[39]关于钙磷促进铝胁迫后紫花苜蓿结瘤固氮的研究结果相似。根毛总数、根毛长度等形态指标反映了根毛的生长状况,可直接影响寄主植物的信号感知和被侵染,而根系的被侵染性是决定结瘤固氮能力的内在因素之一[40]。根毛变形则是寄主被侵染的直观表现,是根毛对根瘤菌入侵和结瘤因子诱导的结瘤反应,根毛变形率提高意味着结瘤数的增加,固氮能力的提高[39]。外源壳聚糖缓解了NaCl 胁迫对菜用大豆根毛的伤害,改善了根毛的生长状况,进而促进了菜用大豆根毛对信号的感知和变形[41-42],这可能是其提高NaCl 胁迫下菜用大豆结瘤固氮能力的一个重要方面。
本试验在研究壳聚糖诱导根毛形成过程中发现,壳聚糖处理大幅提高了NaCl 胁迫下菜用大豆根尖内源IAA 含量,这与曲丹阳等[43]关于壳聚糖诱导提高玉米幼苗根系内源IAA 含量的研究结果相近。IAA 具有明显的促进根毛发育的作用。莫乙伟等[44]研究发现,在0~5 mg/L IAA 浓度范围内,随IAA 浓度增加,水稻根毛长度和密度也随之增加,而且只有根尖分生区IAA 处理后,才能诱导新的根毛区形成根毛。本研究中,壳聚糖可能首先诱导NaCl 胁迫下菜用大豆内源IAA 在根尖积累,内源IAA 进而诱导根尖非生毛细胞向生毛细胞转变,促进根毛密度和数量增加,缩短根毛距根尖距离,根毛起始过程完成后,促进根毛向外极性生长,增加根毛长度[8,44],这可能是壳聚糖促进NaCl 胁迫下菜用大豆根毛生长的重要因素之一。
活性IAA 在植物体内很易被氧化而失去活性,影响IAA 氧化的主要是IAAO 和POD[45-46]。研究发现,水分胁迫下荔枝叶片IAAO 和POD 活性增加,而IAA 含量减少,认为IAAO 和POD 活性增加可能加剧了IAA 的氧化分解[47]。干旱胁迫下棉花叶片IAA 含量的下降可能是POD 活性增加所致[48]。本研究中,NaCl 胁迫导致根尖IAAO 和POD 活性升高,IAA 含量大幅下降,这与陈立松等[47]和袁朝兴等[48]的研究结果相似,说明IAAO 和POD 活性的增加促进了IAA 的氧化分解,降低了根尖IAA 含量。壳聚糖处理显著降低了IAAO 和POD 的活性,这可能是其提高NaCl 胁迫下根尖内源IAA 含量的重要原因之一,这与前人关于NO 可通过抑制IAAO 和POD 活性来降低IAA 的分解,维持玉米幼苗叶片和根系IAA 含量的研究结果相似[49]。此外,内源IAA 的积累还会受到极性运输的影响,IAA 由合成部位极性运输到达作用部位后才能发生作用。环境胁迫导致生物膜的稳定性和完整性遭到破坏,增加细胞质膜的透性,影响IAA 的运输,从而导致IAA 在细胞内或细胞间的区域化失去调控,IAA 不能正常地发挥功能[50]。本研究发现,壳聚糖显著降低了NaCl 胁迫下菜用大豆根系的MDA 含量,表明壳聚糖有效缓解了NaCl 胁迫对根系的伤害,减轻了膜脂过氧化程度,维持了生物膜的相对稳定性和完整性,从而有利于IAA 由合成部位向根尖的极性运输,这可能是壳聚糖提高根尖内源IAA 含量的另一重要原因。内源IAA 的极性运输还需IAA 极性运输输入和输出载体的参与,NaCl 胁迫下壳聚糖如何调节IAA 极性运输载体的活动,还有待进一步探讨。
需要说明的是,本试验在NaCl 处理之前,先对植株进行了壳聚糖诱导处理[51],这主要是考虑到壳聚糖诱导植物产生抗性是需要一定时间的,如果壳聚糖与盐胁迫同时处理,可能会出现胁迫前期T3 与T2 差异不显著的情况,特别是本试验取样集中,处理时间短,可能会出现整个胁迫期间T3 与T2 差异不显著的情况,如果是这样,就与本研究结果截然不同,也不能真正体现壳聚糖对菜用大豆根毛形成及生长的诱导效应。
4 结论
NaCl 胁迫下,外源壳聚糖可通过降低IAAO 和POD 活性,减少IAA 的氧化分解;通过缓解根系膜脂过氧化,维持生物膜的相对稳定性和完整性,促进IAA 向根尖的极性运输,提高根尖内源IAA 含量,诱导根毛形成和生长,进而提高变形根毛数,这可能是其提高菜用大豆根尖IAA 含量及结瘤能力的重要原因之一。

