水稻磷转运蛋白Pht1 家族研究进展
刘朝柱,艾雯妍,文思颖,剧永望,刘 雪
(西南林业大学生态与环境学院,云南昆明 650224)
磷(P) 是植物生长所必需的大量元素,是细胞内ATP、核酸、磷脂、含磷酶和蛋白质的重要组成元素,亦是生物膜的重要组成物质,在种子萌发、花粉发育、果实形成等植物生命过程中发挥重要作用[1]。此外,磷参与植物体内物质合成、能量转移、基因表达、信号转导、产量与品质等重要生理生化过程[2-3]。土壤中磷主要以无机磷(H2PO4-、HPO42-和PO43-)形式被植物根系吸收[4-5],其中以H2PO4-为主。土壤中总磷含量较高,然而其中约80%为难以被植物直接吸收利用的有机磷[6],此外,无机磷易被土壤吸附,同时可与钙、镁、铁、铝等金属阳离子结合形成难溶或不溶性化合物,亦可被微生物转化为有机磷[7-8],导致土壤中磷的移动性和生物有效性降低,仅约1%可被植物直接吸收利用,严重影响植物对磷的吸收和作物生产[9]。
磷的吸收和转运依赖于植物体内的磷转运蛋白(phosphate transporter,Pht),提高磷转运蛋白表达对促进植物磷吸收具有重要作用[10]。土壤中有效态磷含量极低(1~10 µmol/L)[11],远低于植物正常生长所需含量(5~21 mmol/L)[12-13]。缺磷胁迫时,植物可诱导表达高亲和性磷转运蛋白,以促进植物根系对磷的吸收[14-16]。磷转运蛋白根据其亚细胞定位可分为5 个家族(Pht1~Pht5)[17-20],植物体内的磷转运蛋白主要为Pht1 家族,其功能研究亦最为深入[21-22]。Pht1 主要位于根系细胞膜,属于溶质转运蛋白家族的超家族(major facilitator super family, MFS)[23],与植物对土壤中可溶性磷的吸收密切相关[24],与有机酸、氨基酸、多糖和无机离子转运蛋白构成H2PO4-/nH+共转运蛋白,为高亲和性磷转运蛋白[16];且植物Pht1 家族成员具有高度同源性,双子叶植物成员间具有70%的氨基酸同一性[25]。
水稻是供给世界一半以上人口食用的主要粮食作物,其中亚洲消费量占比约90%,是我国种植面积最广的粮食作物,占全国粮食作物总种植面积的27.4%。“十二五”以来,我国水稻产量超过2 亿t,占全国粮食总产的36.1%,供全国60%人口食用[26-28]。土壤磷素是影响水稻产量的重要因素,水稻生长期代谢活动旺盛,需大量磷满足生长需求,缺磷易导致水稻植株矮小、叶面积减小、分枝数与分蘖数减少、开花期延迟、穗形偏小且穗粒数减少,导致产量降低[29]。由于磷肥利用率低,为保障农业生产,通常施用过量磷肥,长期施肥导致磷在土壤中大量积累,农田系统中磷流失具有潜在面源污染和水体污染风险[30-31]。
不同水稻品种对缺磷胁迫的耐性机制包括:1) 形态重塑应答型,主要通过促进根系生长,增加根系与土壤接触,提高对土壤中磷的吸收[32];2) 磷高效吸收利用应答型,主要通过诱导土壤中固定态磷的活化、植物对土壤磷的高效吸收和体内磷的高效利用等相关基因(如Pht1 家族)表达,促进固定态磷的释放和高效吸收与利用[33-34]。如何筛选培育磷高效吸收利用应答型水稻品种已引起广泛关注,研究如何提高磷的利用率对提高水稻产量具有重要意义,深入研究水稻Pht1 家族功能可为提高水稻磷吸收和利用提供重要理论依据,对培育磷高效水稻和农业可持续发展有重要意义。因此,本文基于前期研究,综述水稻磷转运蛋白Pht1 家族的结构与分类,家族成员的生物学功能,重点阐述OsPT3、OsPT4、OsPT8的表达条件、模式和生物学功能。综述内容可为今后研究水稻Pht1 家族提供理论依据和坚实基础,为通过提高水稻对磷的吸收和利用效率应对土壤磷缺乏提供理论依据和技术参考,对促进水稻充分利用土壤内源磷,降低外源磷肥施用,降低环境磷污染和保障农业生产具有重要的现实意义。
1 Pht1 家族结构与分类
磷转运蛋白根据其亚细胞定位分为5 个家族:Pht1 家族位于细胞膜,受缺磷胁迫诱导表达;Pht2家族位于原生质体,为组成型表达系统,是磷营养充足状态下的吸收系统;Pht3 家族位于线粒体,负责线粒体中磷的交换;Pht4 家族位于高尔基体,参与磷从液泡到叶绿体和高尔基体的转运;Pht5 家族位于液泡,负责将磷转运至液泡中[11,17-20,35]。磷转运蛋白分为低亲和和高亲和两类,低亲和磷转运蛋白在高磷条件下促进植物吸收磷,亲和力常数为3~10 µmol/L;而高亲和磷转运蛋白在低磷条件下促进植物吸收磷,亲和力常数为50~300 µmol/L[36]。在磷转运蛋白的5 个家族中,因Pht1 家族多为高亲和磷转运蛋白,在低磷/缺磷条件下响应最为强烈,对磷的吸收和转运发挥关键作用,故目前对Pht1 家族的研究最多最深入。
植物Pht1 家族属于超家族MFS 的第九亚家族,不同物种Pht1 家族蛋白的结构极为相似,具有高保守性。Pht1 家族基因在细胞质膜表达,利用质膜的氢离子浓度梯度驱动植物对磷的吸收和转运[15,37]。Pht1 家族为高亲和磷转运蛋白,主要在根部表达并受低磷胁迫诱导[38]。该家族基因的氨基酸数目一般为518~587,均为膜整合蛋白[39]。Pht1 家族蛋白的等电点为7.6~9.2,分子量约57~61 kDa;具有12个亲脂跨膜结构域,主要由含17~25 个氨基酸残基的α 螺旋构成;在第6 个与第7 个跨膜区间普遍存在1 个亲水环,约由60 个氨基酸残基构成,最终形成“6 螺旋-亲水大环-6 螺旋”式结构,其中C-端、N-端和亲水大环均在质膜内部(图1)[40-41]。同时,该家族还具有H2PO4-/nH+共转运蛋白、糖转运蛋白和MFS 通用转运蛋白等的特征结构域和一段保守的氨基酸特征序列GGDYPLSATIMSE[42]。
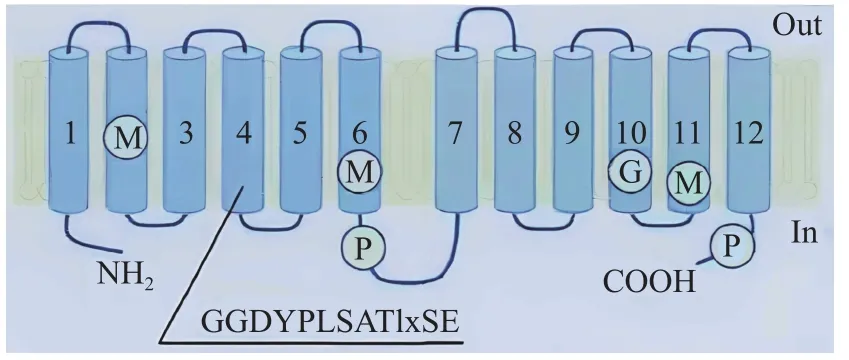
图1 Pht1 家族跨膜结构预测[42]Fig.1 Prediction of Pht1 family transmembrane structure [42]
2002 年水稻基因图谱的公布为通过遗传手段对水稻进行改良奠定了分子生物学基础,对水稻分子生物、分子育种方面的研究工作具有重要意义[43]。水稻共有26 个磷转运蛋白,命名为OsPT1~OsPT26,分布于11 条染色体上[22,36,44-45],各家族包含的磷转运蛋白基因及其染色体定位如表1 所示。其中,目前已报道的Pht1 家族成员有13 个,命名为OsPT1~OsPT13[22],其分子信息如表2 所示。
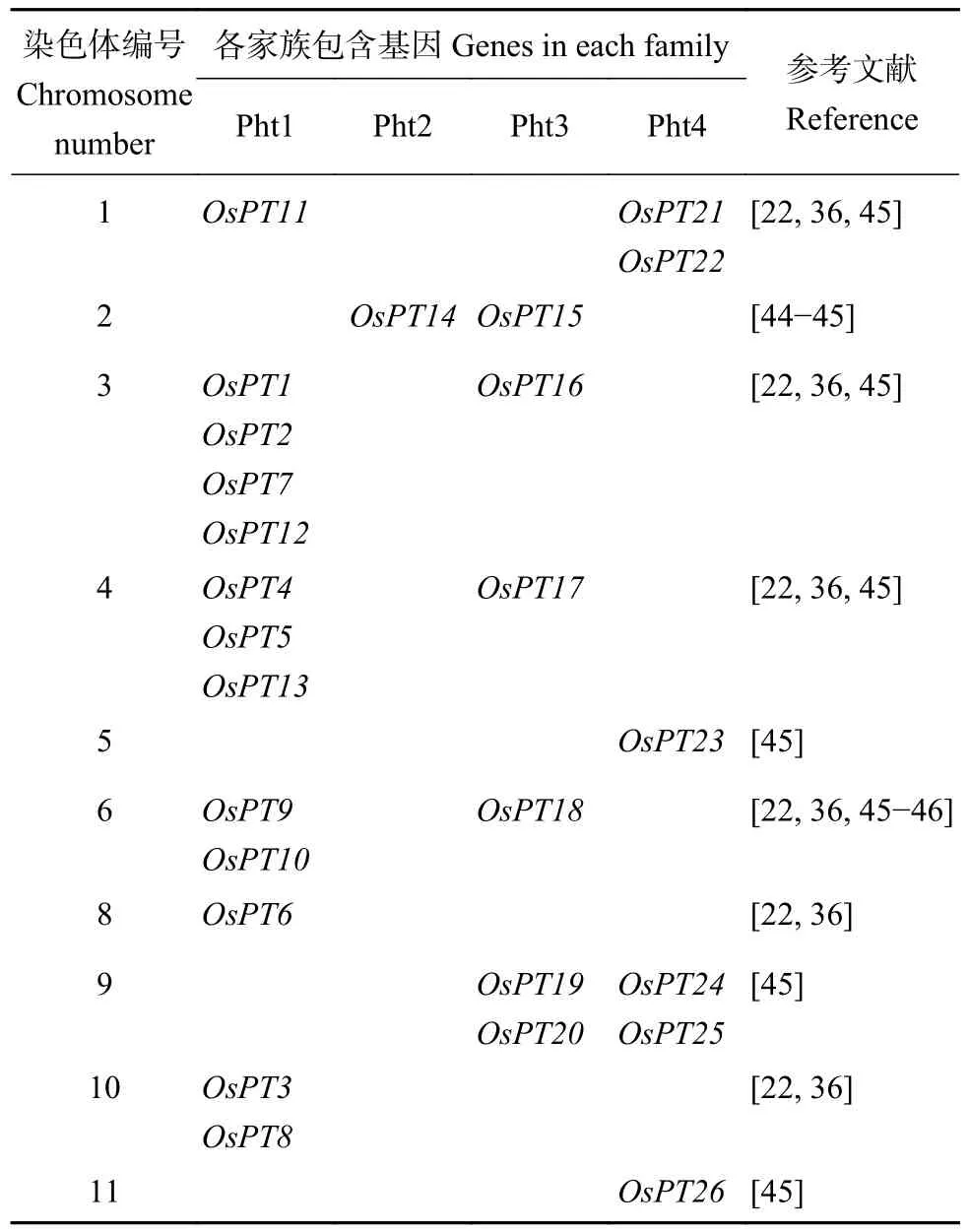
表1 水稻Pht 家族磷转运蛋白分子基因、所属家族与分布Table 1 Genes, families, and chromosome distribution of Pht family P transporters in rice
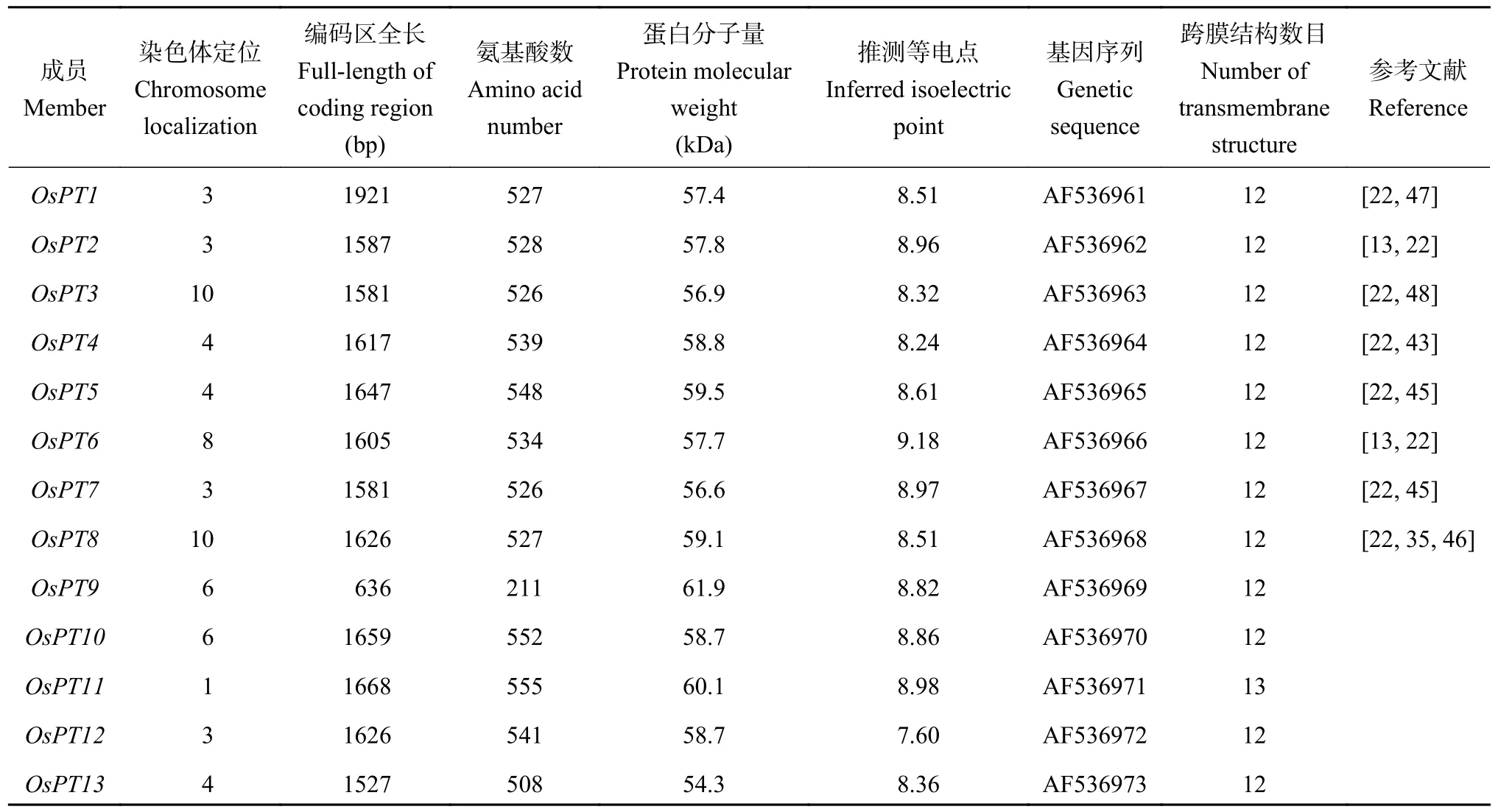
表2 水稻Pht 家族磷转运蛋白分子信息Table 2 Molecular information of Pht family P transporters in rice
2 Pht1 家族起源与同源性
首个被鉴定的高亲和磷转运蛋白基因来自酿酒酵母(Saccharomycescerevisiae)中的ScPH084[49],高等植物中首个被鉴定的Pht1 家族磷转运蛋白基因为拟南芥(Arabidopsisthaliana) 中的AtPHT1和AtPHT2[50]。通过基因测序和同源基因序列比对,近年来,相继从拟南芥[16]、马铃薯(Solanumtuberosum)[50-51]、番茄(Solanumlycopersicum)[52-53]、烟草(Nicotiana tabacum)[54]、大麦(Hordeumvulgare)[55]、茄子(Solanum melongena)[56]、水稻[21-22]、大豆(Glycinemax)[57]等物种中获得了高亲和磷转运蛋白基因。
水稻Pht1 家族磷转运蛋白氨基酸序列高度保守,不同植物种属间同源性高达76%[36],其中,OsPT4和OsPT5位于同一染色体且距离较近,同源性高达93%[58];OsPT2和OsPT6同源性极高,达70.6%[13]。Pht1 家族磷转运蛋白分属3 个亚类,OsPT2和OsPT6分别属于I 和III 亚类,其中OsPT2与大麦的磷转运蛋白HoRvu;PT1和HoRvu;PT2属同一亚类,同源性高达91%,而OsPT6与玉米磷转运蛋白ZEAmaPT3属同一亚类,同源性高达79.8%[13]。
3 Pht1 家族的生物学功能
Pht1 家族的分子调控机制[10]及水稻Pht1 家族成员中OsPT1、OsPT2、OsPT6、OsPT11和OsPT13的生物学功能已有综述[59]。目前对OsPT3、OsPT4和OsPT8的表达和超表达研究比较深入,因此,本文重点阐述OsPT3、OsPT4和OsPT8转运蛋白的生物学功能。
3.1 OsPT3 生物学功能
OsPT3基因位于水稻基因组第10 号染色体,其DNA 全长为1977 bp,编码区全长(CDS) 为1581 bp,共编码526 个氨基酸,以单拷贝形式存在于基因组上,不含内含子,蛋白分子量约为56.9 kDa,等电点为8.32 (表2),含有12 个跨膜螺旋结构,分为6 个N 端的跨膜区和6 个C 端的跨膜区,蛋白N 末端和C 末端均朝向细胞质一侧,在第6 和第7 个跨膜区之间被一个中央亲水大环分隔,为典型的质膜整合蛋白拓扑结构[48]。通过TMHMM-2.0 绘制的水稻高亲和磷转运蛋白OsPT3 跨膜结构模式图如图2 所示。
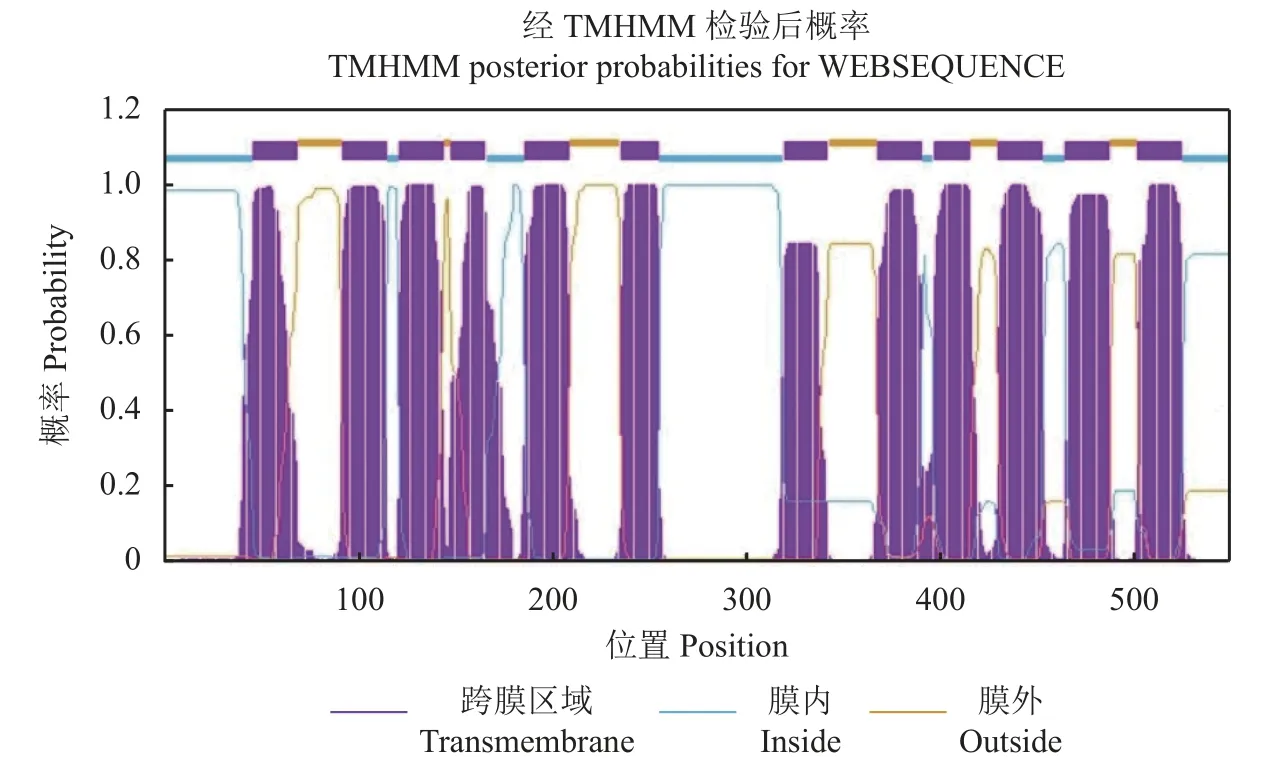
图2 水稻高亲和磷转运蛋白OsPT3 的跨膜结构模式图Fig.2 Transmembrane structure mapping of rice high affinity P transporter OsPT3
OsPT3介导水稻对磷的吸收和转运,在磷缺乏环境中(<1~5 µmol/L),OsPT3对磷的获取与再分配起关键作用[60]。在水稻Pht1 家族中OsPT3和OsPT2是受缺磷诱导表达最为强烈的两个成员[61]。在田间生长条件下,OsPT3主要在水稻营养生长期的根和叶中表达(表3),在萌发的种子、颖壳和花药等繁殖器官中亦有表达。水培条件正常供磷(200 µmol/L)时,OsPT3在水稻各部位的表达均较弱;低磷(10µmol/L)时,OsPT3在根中表达显著上调;磷浓度极低(1~5 µmol/L)时,OsPT3表达呈跳跃式上升,当磷浓度由10 µmol/L 降至5 µmol/L,OsPT3在根和叶鞘的表达丰度分别提高3 和10 倍;无磷时,OsPT3在水稻各部位的表达丰度达到最高值,根、第4叶、第7 叶、第5 叶、第6 叶、叶鞘的相对表达水平分别为0.8、0.3、0.14、0.08、0.06、0.02[48],其表达随恢复供磷而逐渐降低,恢复供磷24 h 后,其表达恢复至正常供磷水平[48]。Ai 等[15]推测OsPT3可能与OsPT2共同参与低磷条件下根系对磷的吸收。综上,OsPT3可能主要在极端低磷条件下发挥作用,且与OsPT2和OsPT10可能存在相互作用。
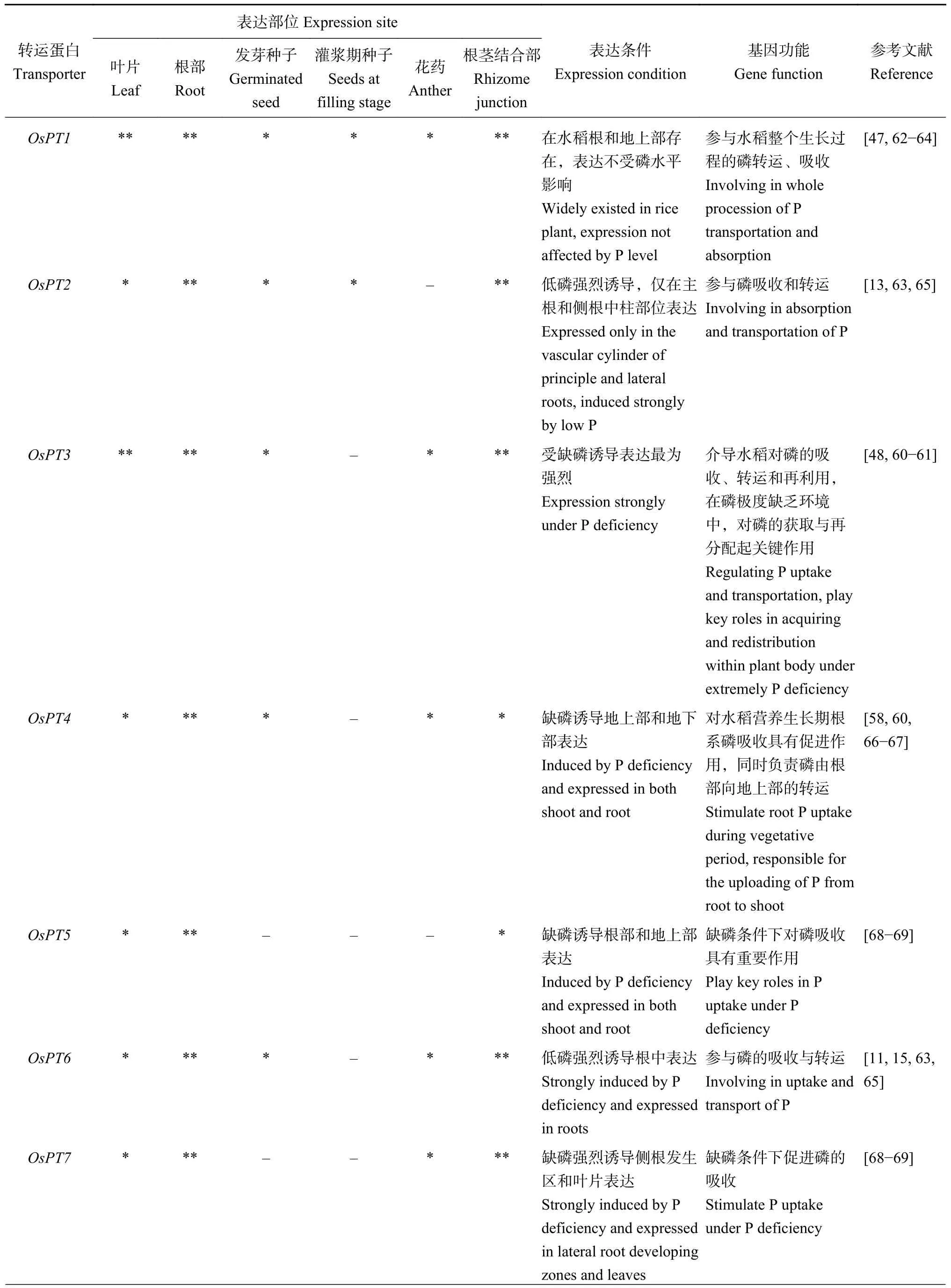
表3 水稻Pht1 家族转运蛋白表达部位、表达条件及基因功能Table 3 Expression sites of rice Pht1 family transporters
常明星[48]利用CRISPR/Cas9 技术[66]对水稻基因组进行高效定向突变,获得了OsPT3基因敲除的水稻转基因材料。定量PCR 结果显示,OsPT3在野生型和假阳性株系叶片中表达微弱(相对表达水平为31.4),而在阳性株系中表达量显著提高(相对表达水平为141)[48]。水培条件正常供磷(200 µmol/L)时,OsPT3超表达株系地上部和根部总磷和可提取磷含量分别为野生型的3.5 和4.5 倍;低磷(10 µmol/L)时,超表达株系根部总磷和可提取磷含量分别是野生型的2 和3 倍[48,60]。综上,超表达OsPT3不仅提高水稻根系对磷的吸收能力,亦显著提高水稻地上部和地下部的磷含量。
3.2 OsPT4 生物学功能
OsPT4基因位于水稻基因组第4 号染色体,编码区全长(ORF)为1617 bp,编码539 个氨基酸。蛋白分子量58.8 kDa,等电点8.24 (表2)。蛋白亲水性分析表明,OsPT4含有11 个跨膜域[43]。通过TMHMM-2.0 绘制的水稻高亲和磷转运蛋白OsPT4跨膜结构模式图如图3 所示。
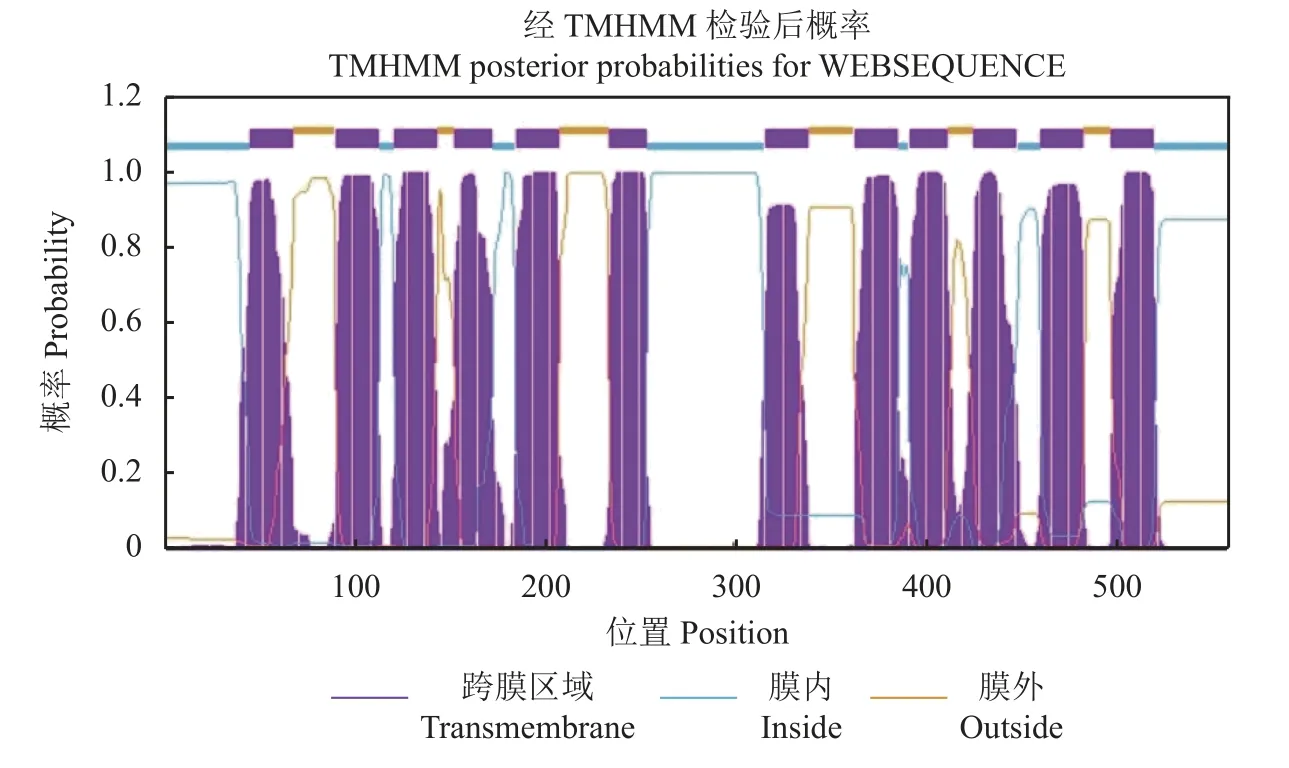
图3 水稻高亲和磷转运蛋白OsPT4 的跨膜结构模式图Fig.3 Transmembrane structure mapping of rice high affinity P transporter OsPT4
OsPT4对水稻营养生长期根系磷吸收具有促进作用,同时负责磷由根部向地上部的转运[66-67],OsPT4编码位于质膜上的磷转运蛋白,是在正常磷情况下水稻根表皮细胞中唯一具有特异性转运功能的蛋白,可协助植物从外部环境摄取磷并将其转运至植物体内[67],促进磷的吸收和转运,且在水稻胚发育过程[73]和磷从水稻营养器官向生殖器官转运过程中发挥重要作用[43]。OsPT4在根、叶片、叶舌、节、节间、雄蕊和颖果中均有表达(表3),主要负责向根、茎和糙米中转运和积累磷。在幼穗分化期,荧光定量PCR 显示水稻OsPT4相对表达量表现为根系(0.033)>叶片(0.015)>茎基部(0.005)>叶鞘(0.004)>未成熟穗(0.003)。在孕穗期,根系、剑叶叶鞘、剑叶、倒二叶、倒二叶叶鞘、花梗、茎基部、花轴、小穗中OsPT4相对表达量依次为0.02、0.016、0.014、0.008、0.006、0.0025、0.002、0.002、0.001[74]。综上,OsPT4在水稻中主要在根系表达,其次为其他组织和部位,具有吸收和转运磷的作用。
OsPT4是功能性磷转运蛋白,在缺失高亲和磷转运蛋白PHO84 的酵母突变体中异源表达OsPT4可恢复其表型,使其在低磷培养基中能够正常生长,表明OsPT4在体外具有磷转运活性[58]。遗传学试验进一步发现,OsPT4超表达植株磷含量较野生型显著增加,水培条件磷充足(200 µmol/L)条件下3 个超表达株系(Ox1、Ox2 和Ox3)地上部磷含量分别比野生型提高9.4%、14.3%和11.4%,根部分别提高27.7%、23.5%和19.1%;缺磷(10 µmol/L)条件下超表达株系地上部磷含量分别提高52.2%、38.5%和37.9%,根部分别提高15.4%、13.6%和13.1%[74]。综上,OsPT4的超表达显著提高正常磷(200 µmol/L)及低磷(10 µmol/L)条件下水稻对磷的吸收效率。
OsPT4超表达不仅显著提高水稻对磷的吸收效率,同时对氮的吸收亦有促进作用。研究发现:1)OsPT4在根和胚中表达极强,超表达可诱导不同磷浓度下水稻体内磷含量提高,促进胚发育和种子形成[67]。OsPT4在水稻生殖生长阶段根系中相对表达丰度较高,OsPT4超表达使水稻剑叶、叶鞘、茎秆、稻壳、穗柄和糙米中磷含量出现不同程度的提高,与野生型相比,水培且磷充足(200 µmol/L)条件下,OsPT4超表达株系剑叶、叶鞘、茎秆、稻壳、穗柄和糙米中总磷含量分别平均提高12.9%、15.5%、17.1%、22%、56.3% 和17.3%;缺磷(10µmol/L)条件下则分别提高了61.4%、48.1%、53.6%、38.4%、61%和47.4%[58,74]。同时,OsPT4超表达可显著提高正常供磷(200 µmol/L)条件下的单株产量和千粒重,使株系单产提高7%,使千粒重提高9.3%;亦可提高缺磷(10 µmol/L)条件下的结实率、单株产量及千粒重,分别提高10.6%、9.1%、10.7%[58,74]。2)OsPT4超表达使缺磷条件下瘪壳与糙米中氮含量分别提高16.8%和19.8%,氮利用效率提高6.6%[74]。另有研究发现,与OsPT8超表达植株出现的严重磷中毒现象不同[70],在OsPT4超表达材料中,不仅提高正常供磷条件下水稻生殖生长阶段各组织中的磷含量,亦促进缺磷条件下各组织中的磷积累,表明OsPT4在水稻生育后期的磷吸收与利用过程中发挥重要作用[74]。由此可推断OsPT4可促进水稻在缺磷条件下对磷的积累与利用,从而提高缺磷条件下的产量[66,74]。
3.3 OsPT8 生物学功能
OsPT8基因位于第10 号染色体,编码区全长为1626 bp,共编码527 个氨基酸,以单拷贝形式存在,基因无内含子。推测其蛋白等电点为8.51,带电量为6.69 (pH=7,表2)[35]。通过TMHMM-2.0 软件分析OsPT8的跨膜结构,结果显示OsPT8为膜整合蛋白,包括6 个N 端的跨膜区以及6 个C 端的跨膜区,氨基酸N 末端和C 末端均朝向细胞内,12 个疏水跨膜区域由一个带电荷的亲水区分隔成2 组,每组各6 个,第6 和第7 个跨膜区由一个中央亲水环分隔,为典型的质膜转运蛋白拓扑结构。亚细胞定位结果显示OsPT8基因定位于细胞膜,是一个质膜蛋白[35]。通过TMHMM-2.0 绘制的水稻高亲和磷转运蛋白OsPT8跨膜结构模式图如图4 所示。
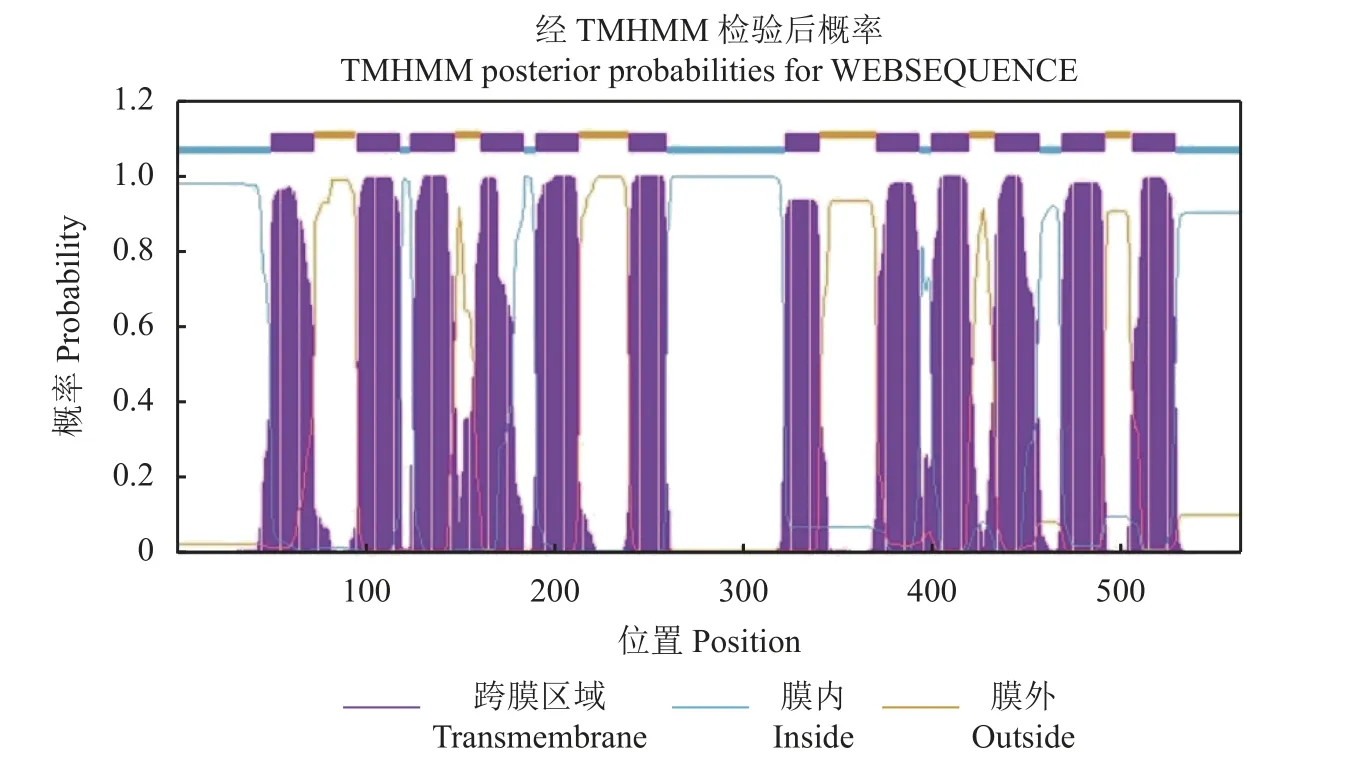
图4 水稻高亲和磷转运蛋白OsPT8 的跨膜结构模式图Fig.4 Transmembrane structure mapping of rice high-affinity P transporter OsPT8
Pht1 家族基因中OsPT8对环境磷浓度响应最为敏锐,OsPT8基因启动子驱动的GUS 和GEP 报告基因的表达显示,OsPT8可在根到种子等多组织器官中表达,且不受磷供给的影响[35]。OsPT8不仅参与水稻早期磷的吸收与转运,亦参与水稻生长后期磷从营养器官向生殖器官的转运[71]。贾宏昉[35]将含有启动子融合和报告基因的转基因植株组织染色进行组织石蜡切片,发现根尖、支根区、根茎结合部、叶片在正常供磷(300 µmol/L)和缺磷(15 µmol/L)水培条件下均有显色,且缺磷条件下表达强烈(表3);在花药、灌浆期种子和发芽种子中均检测到基因存在,与RT-PCR 和q-PCR 结果一致,表明OsPT8可能参与水稻整个生长发育过程中磷的吸收与转运[70]。同时OsPT8的表达对水稻种子中植酸含量亦有一定影响,抑制地上部OsPT8表达可抑制磷从营养器官向种子的转运,却能促进植酸在种子中的合成,其植酸含量比对照提高8.7%[75]。OsPT8蛋白能够弥补缺失高磷亲和基因的酵母突变体,并且在添加微摩尔级(150 µmol/L)33P 的条件下,OsPT8使爪蟾卵母细胞磷含量提高130%,表明OsPT8蛋白是高亲和性磷转运蛋白[35]。
OsPT8与OsPT6类似,亦可完全弥补酵母PH084突变体,OsPT8可能通过调控磷的吸收对植物生长发育产生影响。例如,正常供磷(300 µmol/L)水培条件下,超表达OsPT8使转基因植株表现出生长迟缓、植株矮小和叶片发黄等典型的磷中毒症状,而低磷(15 µmol/L)条件下,不良表型得到恢复。超表达该基因导致水稻因磷吸收过量而降低有效分蘖数和结实率;沉默该基因造成水稻结实率降低甚至不育[70],表明OsPT8对水稻有效分蘖数和结实率具有一定影响。利用RNA 干扰技术选择性敲除OsPT8,抑制该基因在枝条和种子胚乳中的表达,发现胚乳特异性沉默OsPT8后种子的千粒重与野生型相比呈下降趋势,平均降低值>1 g,表明OsPT8对磷的再分配和维持种子磷稳态具有关键作用[71-75]。不同磷浓度水培试验发现,低磷(15 µmol/L)时,OsPT8过表达株系OX-25、OX-33 和OX-87 株高分别提高10.7%、10.7%和13.5%,但随磷浓度升高,OsPT8过表达株系株高降低,当达到正常磷水平(300 µmol/L)时,OsPT8过表达株系株高分别降低8.8%、11.9%、12.7%;当达到高磷浓度(1500 µmol/L)时,OsPT8过表达株系株高分别降低19.6%、16.8%、20.8%[71],表明OsPT8在不同磷浓度条件下通过调控磷的吸收和转运而影响水稻植株的株高。类似地,大田试验发现,OsPT8过表达使水稻植株在未施用磷肥条件下,株高、穗长和实粒率分别提高4.4%、8.0% 和4.9%;而在施用746 kg/hm2磷肥条件下,株高、穗长和实粒率分别降低5.6%、13.8%和5.7%。此外,超表达OsPT8使磷在水稻根和茎杆中过量积累,在高磷(1500 µmol/L)水培条件下使水稻出现叶尖萎蔫和坏死等磷中毒现象,表明OsPT8过表达提高了水稻在低磷条件下的株高、穗长、实粒率和产量;但正常磷和高磷条件下,OsPT8过表达会造成磷在植株内富集,对植株生长产生不良影响[71,76]。
3.4 Pht1 家族其他成员生物学功能
除OsPT3、OsPT4和OsPT8外,水稻Pht1 家族其他成员亦具有不同的表达条件、模式及功能。参与磷吸收与转运的OsPT1的表达不受环境磷水平的影响,在根部和地上部呈组成型表达[64]。低磷可强烈诱导OsPT2和OsPT6在根中的表达[63],其中OsPT2主要存在于主根和侧根的中柱,但在根尖无表达[58],是低亲和磷转运蛋白;OsPT6则主要存在于根表皮细胞及皮层和中柱(表3),参与根系磷的吸收与植株体内的转运[15]。OsPT2和OsPT6基因在维持水稻植株对磷吸收、转运和正常生长方面具有重要作用,OsPT2或OsPT6基因沉默,使低磷胁迫条件下水稻根系总长、根表面积、根系体积和根尖数均显著下降,影响水稻的根系形态[65]。水稻中OsPT5、OsPT10和OsPT12的表达量随OsPT4表达量的变化而变化,在OsPT4超表达时下降,在OsPT4抑制表达时升高[58],可能的原因是不同成员之间相互影响,表明水稻磷吸收是一个复杂且高效协调的过程。OsPT5在水稻根尖和新叶中微弱表达,在根部和地上部受缺磷诱导表达[77],在缺磷3 周后,根尖、支根发生区、根茎结合部和叶片均有微弱表达,但在供磷条件下其表达消失,在花药、灌浆期种子和发芽种子均无表达。OsPT7在缺磷处理下,支根发生区和叶片表达强烈,但根尖无表达(表3),而在供磷条件下,叶片中无表达,在花药中表达。OsPT7与OsPT6表达模式相似,但表达量不同[69]。33P 吸收试验表明,OsPT5和OsPT7在酵母中对磷的亲和性(Km)分别为65.4 和74 μmol/L,可能均为高亲和磷转运蛋白[77]。磷饥饿可特异性诱导OsPT9和OsPT10在根和叶中的表达,OsPT9和OsPT10可能参与了叶对磷的吸收[46]。Zhou 等[68]发现,缺磷诱导OsPT1、OsPT5、OsPT7、OsPT9和OsPT12基因在根部表达,而降低地上部表达。OsPT11只在菌根感染下才表达,不受磷及其它营养元素水平的诱导表达[22],OsPT11和OsPT13同时参与水稻丛枝菌根系统的构建,但OsPT13不受丛枝菌根诱导表达[58,72]。
4 结论与展望
Pht1 家族磷转运蛋白在植物磷吸收和转运中发挥重要作用,其协同作用可使磷转运分配至特定组织、细胞及细胞器中。目前关于Pht1 家族的研究较多,已报道13 个家族成员,本文综述了Pht1 家族的结构与分类、起源与同源性分析,重点阐述了Pht1家族成员OsPT3、OsPT4、OsPT8的表达模式和基因功能以及超表达方面的研究进展。同时,以下几方面需进一步深入研究。
经长期进化,Pht1 家族基因在磷吸收转运过程中出现分工,各转运蛋白间功能互补、相互协作,亦存在功能上的部分重叠(冗余)。例如,OsPT7的表达只在OsPT3的超表达材料中显著下调,而OsPT8的表达不受OsPT3敲除和过表达的影响;OsPT6在超表达和突变体材料中的表达均显著下调,在OsPT9和OsPT10双重RNAi 株系中则检测到磷吸收减少,表明Pht1 水稻家族成员间存在功能上的部分重叠(冗余),以同源或异源寡(多)聚体的形态共同发挥功能[46,48]。用Split-ubiquitin 酵母双杂交技术单独验证了OsPT2和OsPT3存在互作关系,BiFC 和Co-IP 试验均显示OsPT2和OsPT3可在质膜上发生互作[48]。OsPT1、OsPT2、OsPT4、OsPT5、OsPT10、OsPT11、OsPT12和OsPT13的表达量随OsPT4表达量的变化而变化,表明水稻磷吸收转运过程是一个复杂且高效协调的过程,可通过双基因或多基因敲除进行深入研究[58]。据推测,OsPT4与OsPT8在水稻磷吸收运输过程中可能存在功能互补,水稻通过OsPT4吸收土壤中的磷,由OsPT8将磷向地上部运输[58],该推测需进一步验证。目前对Pht1 家族各基因的功能表达以及相互之间的关系已有部分研究,但Pht1 家族基因在植物体内的工作机制复杂,需进一步研究各转运蛋白间的关系。
随着Pht1 家族研究的不断深入,发现其对吸收和转运砷、硒、硅等具有一定作用。例如,高等植物通过磷转运蛋白吸收砷,但更加倾向于转运磷[78]。Pht1 家族中OsPT1和OsPT8均参与了水稻砷吸收和转运过程[79-80],水稻根部OsPT1、OsPT4和OsPT8表达量在砷处理后显著增加,表明OsPT4可能与OsPT1和OsPT8类似,具有砷吸收和转运能力[58]。亦有报道发现,敲除OsPT4能够有效降低水稻根中砷的积累[70]。此外,OsPT2还和硒的吸收有关,缺磷时硒的吸收增强[81],表明OsPT2可能会协助植物在低磷环境中吸收硒。有报道指出,施硅会降低水稻植株地上部磷含量,但根系磷含量不受影响;施硅不影响磷从水稻根系向地上部的转运,但提高了磷的利用效率;同时,磷转运相关基因的表达分析结果显示,硅显著下调OsPT6在粳稻中的相对表达量,而在籼稻中无显著变化[82]。因此,后续研究可关注Pht1 家族成员对植物吸收和转运砷酸盐、硒、硅等的作用、关系与机理。
此外,OsPT8转基因植株的病原菌接种试验发现,OsPT8参与了水稻对稻瘟病菌和白叶枯菌的防御反应,OsPT8负调控水稻对真菌和细菌病原菌的抗病反应,OsPT8可抑制抗病正调控基因的转录水平,对水稻抗稻瘟病具有负调控作用,过表达OsPT8基因可抑制水稻白叶枯病菌相关抗病基因的表达,造成水稻对白叶枯病菌的抗病性降低[76]。目前关于Pht1 家族磷转运蛋白基因的抗病信号通路互作关系的研究较少,前期研究报道主要为OsPT8,拟南芥的抗病基因AtPHT4;1虽为磷酸转运蛋白,但属于研究较少的Pht4 家族,且其磷转运功能较弱[83-84]。因此,深入研究Pht1 家族成员在植物生理信号网络中的分子机制,有利于培育高抗病性和高磷利用率的优质水稻品种。

