水稻木质部伤流液响应镉胁迫的蛋白组鉴定
郭 宝,李雪姣,唐 静,张振华,罗劲松
(湖南农业大学资源学院,湖南长沙 410128)
镉(Cd)是一种在地壳中稀有的重金属,然而在过去的几十年里,由于工业废气的大气沉降、采矿、冶炼废水的灌溉以及化肥和有机肥的施用,耕地的Cd 污染日益严重[1-3]。Cd 容易被植物吸收,在可食用组织中积累,并进入食物链,对食品安全和人类健康构成风险[4]。
植物维管系统由木质部和韧皮部组成,它们对各种化合物的长距离运输使植物能够适应不同的环境[5-11]。韧皮部是光同化代谢物(如蔗糖) 从源器官(成熟叶) 运输到汇器官(包括根、种子和未成熟叶)的主要途径[12]。木质部主要由导管和薄壁细胞组成,主要参与矿质营养的长距离转运过程。长距离信号使植物能够在严重的环境压力条件下适应和生存,木质部汁液蛋白质组学研究可说明植物中长距离运输机制对各种非生物胁迫的响应。在过去的30 年中,“鸟枪法分析”已成为综合蛋白质组分析的有效方法,番茄、黄瓜、玉米、大豆、杨树、水稻、油菜等多种植物木质部汁液蛋白质组被鉴定出来[13-25]。随着研究的深入,发现植物响应氮素、盐胁迫以及生物胁迫的木质部汁液蛋白组会发生变化,如铁和锰缺乏分别导致番茄119 个和118 个木质部汁液蛋白的丰度发生显著变化,这些蛋白主要参与蛋白质代谢、应激、氧化还原和细胞壁修饰代谢途径[26];玉米木质部汁液中的23 个蛋白质在不同氮供应条件下有不同程度的积累,这23 个蛋白质中有15 个主要参与一般的非生物或生物胁迫反应,而其它5 个蛋白质似乎主要对氮供应不足或过量做出反应[27];干旱条件下玉米木质部汁液的代谢组和蛋白组显著变化,其中干旱诱导的脱落酸、细胞分裂素、过氧化物酶及苯丙类化合物等的显著变化,有助于理解玉米对干旱胁迫的适应性[28];重金属Cd 的胁迫使甘蓝型油菜木质部汁液中28 个蛋白丰度发生显著变化,这些蛋白主要参与细胞壁修饰、应激、氧化还原以及脂质和蛋白质代谢[29]。
植物木质部汁液蛋白组的变化和相关物质从根到茎的长距离运输是植物适应环境胁迫的重要机制[30-32]。Cd 是威胁水稻安全生产和食品健康的主要重金属之一,木质部介导的Cd 从根到茎的转移决定了水稻茎和籽粒中Cd 的积累[33],这一转运过程主要取决于植物长距离运输木质部汁液的能力。研究表明,Cd 主要通过负责吸收必需元素的转运系统进入根细胞[34-35],水稻Cd 的吸收主要由Nramp5 介导[36-38]。Cd 在水稻体内的长距离转运主要由HMA3[39]和HMA2[40-41]家族调控,近期研究表明植物防御素基因CAL1也在这一过程中发挥重要作用,其通过螯合细胞质的Cd,并外排至胞外通过木质部汁液长途转运定向调控Cd 向叶片积累[42]。然而在木质部伤流液中,蛋白质是如何响应Cd 而发生变化的在很大程度上仍是未知。为了找出与Cd 长距离转运相关的因子,我们在Cd 胁迫和非Cd 胁迫下的水稻木质部伤流液中共检测发现了616 个蛋白,其中一些蛋白的基因如防御素样蛋白基因CAL1已有报道,一些依然未知。本研究鉴定木质部伤流液中参与Cd 运输过程的蛋白质组的生物学信息,为水稻Cd 积累调控提供理论基础,也为Cd 的长距离转运提供新的研究基因。
1 材料与方法
1.1 材料与处理
1.1.1 水稻材料及处理 水稻以野生型“中花11”(OryzasativaL., ZH11)为供试材料,将种子在去离子水中浸泡2 天,并在37°C 下发芽16 h。将发芽的种子播种到切掉底部的96 孔PCR 板中,然后漂浮在去离子水表面。7 天后将幼苗移植到Yoshida 水稻营养液(0.37 mmol/L CaCl2、0.17 mmol/L NaH2PO4、0.47 mmol/L MgSO4、0.27 mmol/L K2SO4、0.70 mmol/L(NH4)2SO4、45 mmol/L Fe-EDTA、0.40 mmol/L SiO2、15 mmol/L H3BO3、4.6 mmol/L MnSO4、0.1 mmol/L NaMoO4、0.15 mmol/L ZnSO4、0.16 mmol/L CuSO4, pH 5.5)并在12 h (光照)/12 h (黑暗)的昼夜循环条件下在温室中生长。室温保持在光照28℃,暗处理22℃,每周更换营养液并待生长至苗期(28 天)时分别用0、10 μmol/L Cd 处理3 天。
1.1.2 拟南芥材料及水培处理 选取拟南芥地上部特异表达启动子CAB2,利用引物p1300-CAL1-F/R(表1)克隆去掉终止密码子的CAL1基因CDS 序列并与C-myc 连入pCAMBIA1300 载体,得到CAB2:CAL1-MYC/1300。将所得载体转化农杆菌,再用农杆菌侵染拟南芥Col-0 获得转基因植株。以拟南芥野生型Col-0 (ArabidopsisthalianaWild-type)及带有CAB2 启动子驱动CAL1表达的转基因植株CDM-4 和CDM-12 为供试材料。将拟南芥种子播种于育苗盘中,10 天后用海绵包裹植株根部,移栽至拟南芥水培盒中,盒子外围用黑色胶带包裹,抑制水培液中藻类生长。水培液为1/4 PNS 培养液,具体养分组成如下:1 mol/L KNO3、1 mol/L KH2PO4、1 mol/L MgSO4、1 mol/L Ca(NO3)2、0.02 mol/L Fe-Na2-EDTA、70 mmol/L H3BO3、14 mmol/L MnCl2、1 mmol/L ZnSO4、0.2 mmol/L NaMoO4、10 mmol/L NaCl、0.01 mmol/L CoCl2、0.5 mmol/L CuSO4,每4 天更换1 次营养液,光照培养室环境温度为22℃至24℃,光照周期为16 h (光照)/8 h (黑暗)。待生长至20 天后,用10 μmol/L CdCl2处理3 天。
表1 相关引物序列Table 1 Related primer sequences
1.1.3 拟南芥材料的平板处理 将转基因拟南芥植株CDM-4 和CDM-12 及野生型Col-0,分别在含有0、50 μmol/L Cd 的1/2 MS 平板上培养至14 天,进行表型拍照观察。
1.2 水稻木质部伤流液的制备
待水稻生长至苗期(28 天),分别用0、10 μmol/L Cd 处理,3 天后,使用根压法制备木质部伤流液。即在水稻植株茎距底端约2 cm 的位置,用剃须刀片水平去顶,然后去除维管组织外的细胞层。为避免受损细胞的污染,弃去前30 min 切割表面的渗出液,随后收集渗出液冻干保留,供后续试验。
1.3 实时荧光定量 PCR
使用Trizol 试剂(Invitrogen) 提取拟南芥总RNA 并使用HiscriptII RT SuperMix Kit (Vazyme)试剂将RNA 合成cDNA。使用ChamQTMSYBR Color qPCR Master Mix (Vazyme)和Step One Plus Real-Time PCR 系统进行qRT-PCR,引物序列见(表1)。CAL1相对表达水平通过公式2-ΔCt计算。
1.4 转录组样品制备与分析
将生长了28 天的水稻苗分别在含0、10 μmol/L Cd 的营养液中处理3 天后,分根部和地上部进行取样,并将样品快速浸于液氮当中,每个样本4 个重复。测序平台使用Illumina HiSeq2500 平台上的转录组测序(Denovo Biotechnology Co.,中国广州)。
1.5 元素含量测定
正常培养和Cd 处理后的拟南芥植株前后用10 mmol/L CaCl2溶液和去离子水各冲洗3 次,每株植物代表一个样本,设置4 次重复。将样品在75℃的烘箱中干燥1 天后称重,并用优级纯HNO3消解,使用ICP-MS 测定元素含量。
1.6 SDS-PAGE 检测
冻干后的伤流液样品(见1.2) 各加200 μL UA Buffer,冰浴超声处理。4℃ 14000 ×g离心15 min,取上清,采用Bradford 法测定蛋白质浓度[43];取20 μL 上清进行SDS-PAGE 电泳,采用Candiano 等[44]的方法进行考马斯亮蓝染色。
1.7 酶解蛋白质样品的制备
正常培养和Cd 处理水稻伤流液样品(1.2)各取70 μL,加入DTT 至终浓度为10 mmol,37℃ 2 h。加入IAA 至终浓度50 mmol/L,避光反应30 min。加入2 μg Lys-C,37℃酶解3 h。各加入5 倍体积50 mmol/L NH4HCO3Buffer,混匀后加入8 μg Trypsin,37℃过夜酶解。C18-SD Extraction Disk Cartridge脱盐,真空冷冻干燥,0.1%FA 复溶,OD280肽段定量。
1.8 ESI 质谱分离与鉴定
毛细管高效液相色谱为Thermo Scientific Q Exactive 质谱仪。采用纳升流速HPLC 液相系统Easy NLC 进行分离。缓冲液:A 液为0.1%甲酸水溶液,B 液为0.1%甲酸乙腈水溶液(乙腈为84%)。色谱柱以95%的A 液平衡,酶解样品由自动进样器上样到上样柱Thermo scientific EASY column (2 cm×100 μm 5 μm-C18),再经分析柱Thermo scientific EASY column (75 μm×100 mm 3 μm-C18)分离,流速为300 nL/min。相关液相梯度如下:0~100 min,B 液线性梯度从0%到50%;100~108 min,B 液线性梯度从50%~100%;108~120 min,B 液维持在100%。
样品经毛细管高效液相色谱分离后,用Q-Exactive质谱仪(Thermo Finnigan) 进行质谱分析。分析时长:120 min,检测方式:正离子,母离子扫描范围:300~1800 m/z,一级质谱分辨率:70000 at m/z 200,AGC target:3e6,一级Maximum IT:10 ms,Number of scan ranges:1,Dynamic exclusion:60 s。多肽和多肽碎片的质量电荷比按照下列方法采集:每次全扫描(full scan) 后采集10 个碎片图谱(MS2 scan),MS2 Activation Type:HCD,Isolation window:2 m/z,二级质谱分辨率:17500 at m/z 200,Microscans:1,二级Maximum IT:60 ms,Normalized collision energy:27 eV,Underfill ratio:0.1%。
质谱鉴定原始文件(RAW 文件)通过Proteome Discoverer 1.4 软件进行数据库检索。数据库为自建数据库IRGSP-1.0-protein-2014-06-25.fasta。搜库参数设定如下:Enzyme 为Trypsin;Missed cleavage 设为2;静态修饰设定Carbamidomethy C;动态修饰设定Oxidation M。Peptides tolerance 设为20 ppm,ms/ms tolerance 设为0.1 Da,Peptide FDR<0.01。
1.9 生物信息学分析
使用BLAST2GO 软件对已识别的蛋白质进行GO 功能注释,这个过程可以概括为序列比对、映射、注释和注释增强。使用TargetP (www.cbs.dtu.dk/services/TargetP)评估蛋白质中信号肽的存在,并使用SecretomeP (www.cbs.dtu.dk/services/SecretomeP)将蛋白质指定为经典分泌(CS) 和非经典分泌型(NCS)[45-47]。使用国家水稻数据中心和生物技术信息中心网站NCBI 进行水稻和拟南芥蛋白的同源性分析。
1.10 数据处理与统计分析
采用SPSS 系统LSD 最小差异性分析多重范围比较对试验数据进行统计分析,每个试验至少进行4 次生物学重复。P>0.05 为没有显著差异。用Origin 2021 软件制作柱形图和基因表达图,Excel 软件制作表格。
2 结果与分析
2.1 木质部伤流液蛋白SDS-PAGE 检测
从水稻木质部伤流液中的蛋白质组成(图1A)可知,正常培养水稻木质部伤流液中的蛋白质分子量为7.2~111.6 KDa,Cd 处理后为6~158.1 KDa。

图1 水稻木质部伤流液SDS-PAGE 检测鉴定的不同类型蛋白数量Fig.1 Identified protein number of different classes in xylem sap of rice by SDS-PAGE
2.2 质谱鉴定到的木质部伤流液蛋白
经ESI 质谱鉴定分析,正常生长条件下培养的水稻作为对照(CK),其木质部伤流液中共检测到了463 个蛋白质,Cd 处理中共检测到了503 个蛋白质(图1B)。350 个蛋白质在Cd 处理和对照样品中均检测到,153 个蛋白质只在Cd 处理的样品中检测到(图1C),CK 和Cd 处理的水稻木质部伤流液中蛋白质数量的差异可能与Cd 的胁迫相关。
利用国家水稻数据中心和生物技术信息中心网站(NCBI),对所鉴定的蛋白进行生物信息学分析,616 个已鉴定到的蛋白中425 个被预测属于分泌型途径,其中241 个(39.12%)属于经典分泌蛋白,184 个(29.87%)属于非经典分泌蛋白。剩余187 个(30.36%)蛋白被预测为非分泌蛋白,4 个(0.65%)不属于其中任何一类,归为未知(图1D)。
2.3 伤流液蛋白功能分类
将正常条件培养和Cd 处理条件下水稻木质部伤流液中所得到的蛋白进行GO 功能分析,揭示了Cd处理对水稻木质部伤流液蛋白组变化的影响。分析显示,正常培养和Cd 处理下水稻木质部汁液中鉴定的蛋白在生物进程项中,对金属离子、丙酮酸代谢、己糖代谢以及对压力和无机物的响应显著富集;在核酸功能项中,作用于邻糖基键和糖基键的水解酶活性、抗氧化酶活性、催化酶活性显著富集;在亚细胞定位项中,胞外区、细胞边缘、外部封装结构、质体基质和细胞壁显著富集(图2)。
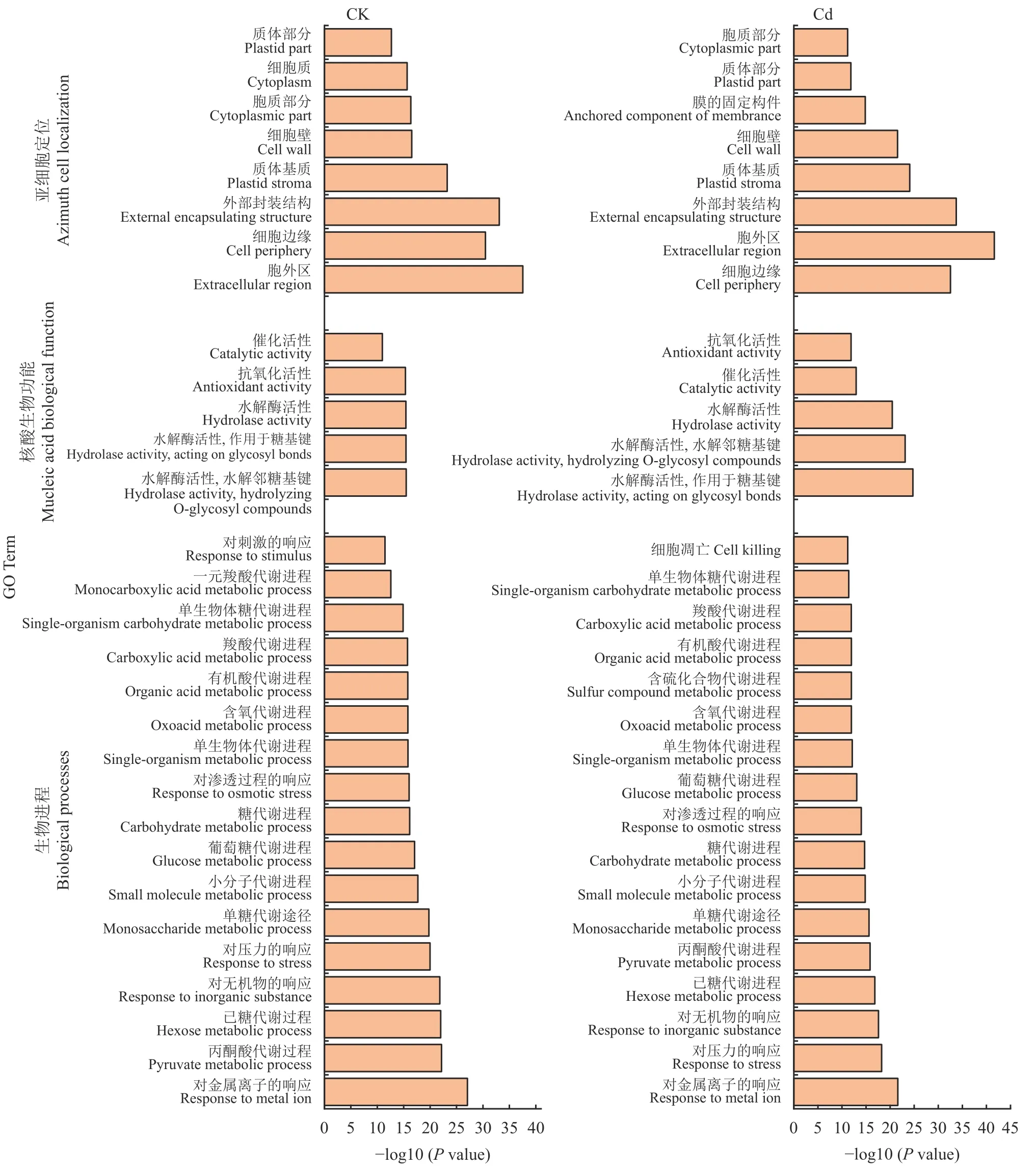
图2 水稻木质部伤流液中蛋白质的GO (GO Term) 分析Fig.2 GO Term analysis of proteins in xylem sap of rice
为进一步分析水稻木质部伤流液蛋白所参与的代谢途径,将正常培养和Cd 处理条件下所检测到的616 个已鉴定和定量的蛋白进行Pathway 分析,并划分为不同的代谢途径(图3)。结果表明水稻木质部伤流液蛋白主要参与碳代谢途径、光合作用中碳的固定、苯丙素的生物合成、戊糖磷酸代谢途径和次生代谢产物等的生物合成途径。
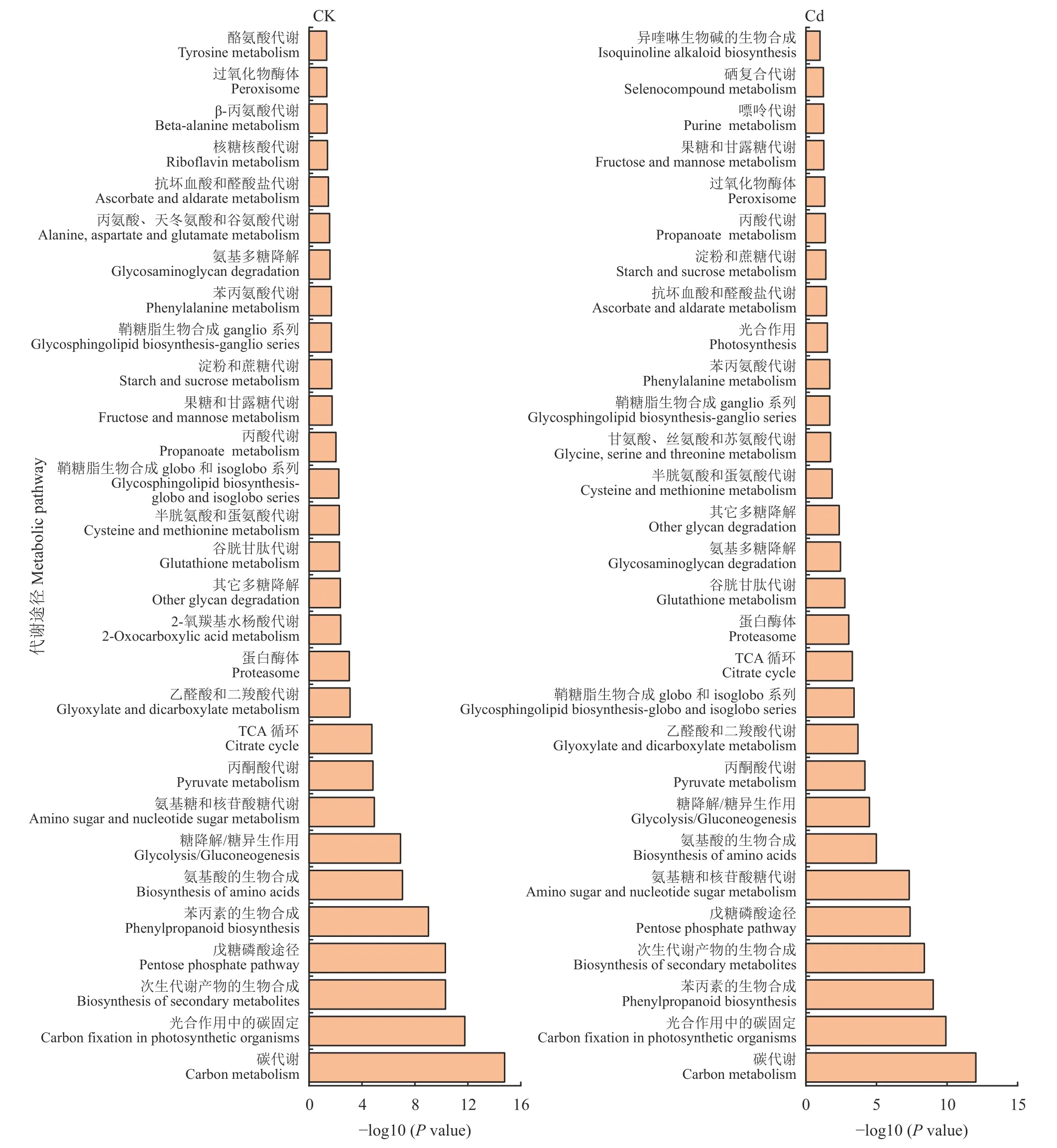
图3 水稻木质部伤流液蛋白质的Pathway 分析Fig.3 Pathway analysis of proteins in xylem sap of rice
2.4 特异存在于Cd 处理样品的木质部伤流液蛋白功能分类
经Cd 处理后的水稻木质部伤流液中共检测到了503 个蛋白质,其中153 个为Cd 胁迫处理样品中特有的蛋白质。这些蛋白质中有106 个属于分泌型途径,其中65 个为经典分泌蛋白,41 个为非经典分泌蛋白,其余46 个蛋白为非分泌蛋白,1 个蛋白未知(表2)。
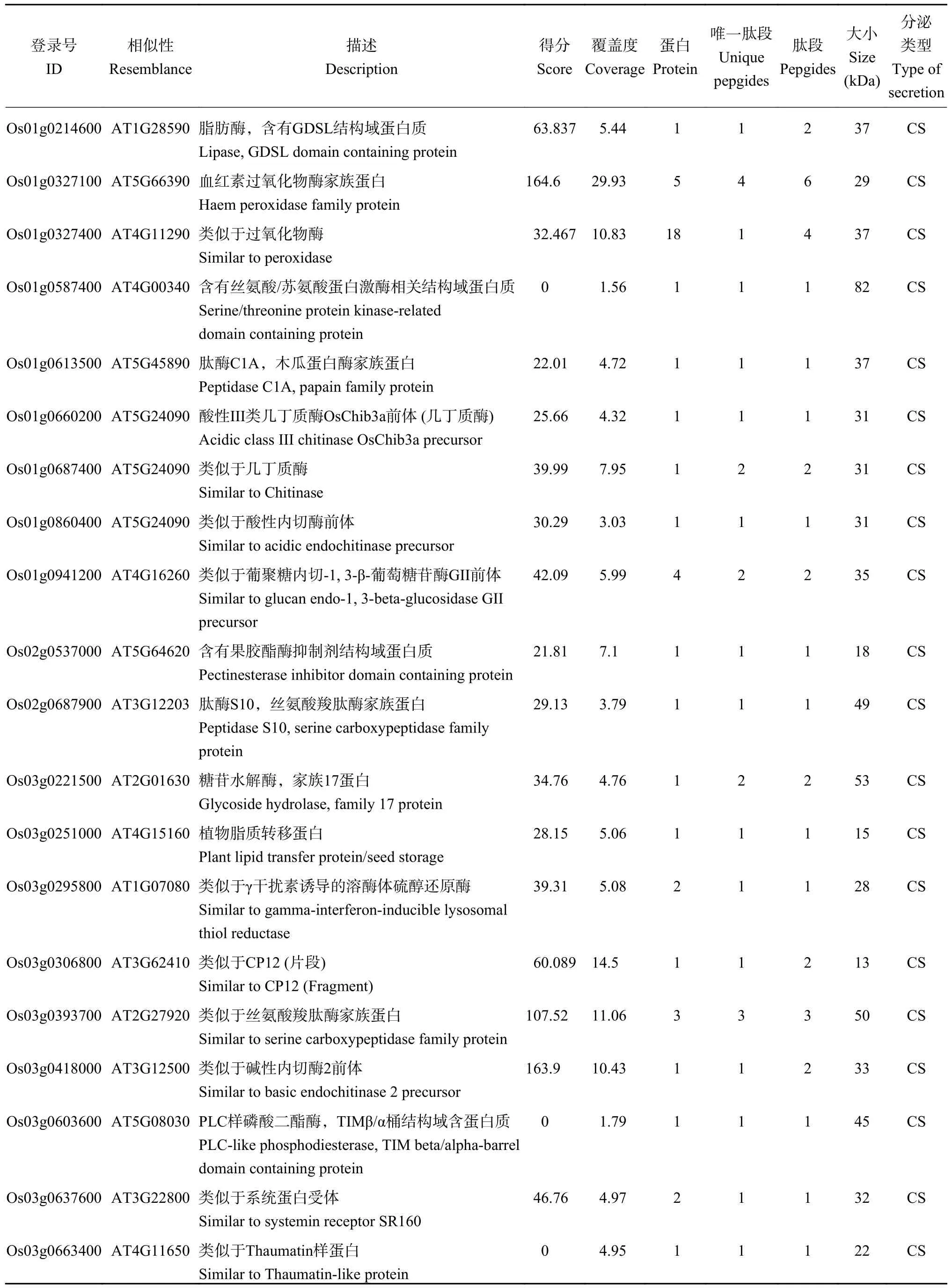
表2 水稻木质部伤流液Cd 特异蛋白质一览表Table 2 List of Cd specific proteins in xylem sap of rice
将水稻木质部伤流液中153 个Cd 特异蛋白进行GO 功能分析和Pathway 分析,结果表明:在生物进程的GO 富集项中,细胞凋亡、细胞壁组织或生物合成、对压力的响应最为富集(图4A);亚细胞组分的GO 富集项中,胞外区、膜的锚定成分、细胞外周、质体基质、外部封装结构、细胞壁最为富集(图4B);进一步分析发现,水稻体内Cd 特异蛋白在氨基糖和核苷酸糖代谢、乙醛酸和二羧酸代谢、碳代谢、苯丙素的生物合成等代谢途径最为富集(图4C)。

图4 水稻木质部伤流液中Cd 特异蛋白质的GO 分析及Pathway 分析Fig.4 GO analysis and Pathway analysis of Cd specific proteins in xylem sap of rice
2.5 拟南芥地上部异源表达CAL1 对Cd 积累和耐受的影响
从表2 看出,在Cd 处理水稻木质部伤流液中,同时检测到了已报道的参与Cd 长途距离转运和叶片Cd 积累的基因CAL1(Os02g0629800),其与拟南芥AT2G02120 同源性高达98%。为了探究CAL1是否具有Cd 修复潜力,通过带有地上部特异表达启动子CAB2 驱动CAL1表达的CALI拟南芥转基因植株,将所得到的CDM-4、CDM-12 两个株系进行基因表达验证,发现CAL1在地上部特异过表达(图5A)。将植株进行50 μmol/L Cd 处理,转基因株系CDM 与野生型叶片上观察到了明显的黄化(图5B),且组内黄化程度无显著差异,生物量基本一致(图5C),表明其地上部特异表达CAL1不影响拟南芥对Cd 的耐受性。与野生型对照Col-0 相比,CAL1转基因植株显著增加了地上部Cd 的积累量,而根部无明显变化(图5D),表明CAL1地上部特异表达具有植物修复的潜力。值得注意的是CAL1转基因株系并没有改变其它金属元素在植株体内的积累量(图5E),表明CAL1并不参与其它金属元素的运转与分配。

图5 拟南芥地上部异源表达CAL1 对Cd 积累和耐受的影响Fig.5 Accumulation and tolerance of Cd as affected the heterologous expression of CAL1 in Arabidopsis plants
2.6 细胞壁代谢相关基因受镉诱导表达模式分析
细胞壁是植物细胞的第一道防御屏障,153 个Cd 特异蛋白的GO 分析显示:亚细胞组分项中的细胞壁项显著富集,生物进程项中的细胞壁组织或生物合成项显著富集。这表明水稻在受到Cd 胁迫时细胞壁代谢相关基因积极响应,以此我们通过RNASeq 分析了153 个Cd 特异蛋白中与细胞壁代谢相关的15 个基因的表达模式:经过Cd 处理后,FLA7、UAM1、ME6、RPH7、TLP1、UCC1、Cht12基因表达在水稻地上部上调,FLA13、XYN1、QRT3、PME41、FLA11、YLS3基因表达在水稻地上部下调。CHT3、FLA13、XYN1、FLA7、UAM1、ME6、RPL17基因表达在水稻根部上调,TLP1、QRT3、UCC1、PME41、FLA11、YLS3、Cht13基因表达在水稻根部下调(图6)。这些基因的表达受Cd 胁迫响应,其对水稻Cd 积累耐受的相关影响及机制仍需进一步的探究。

图6 Cd 特异细胞壁基因的表达Fig.6 Expression of Cd specific cell wall genes
3 讨论
Cd 是一种威胁水稻安全生产和食品健康的重金属,近年来中国水稻发生的Cd 污染事件引起了广泛关注(http://magazine.caing.com/2011/cwcs437/),因此了解植物体内Cd 积累和转运的分子机制十分重要。水稻中Cd 的积累和转运机制已经有了大量研究[48],水稻根部从土壤中吸收的Cd 在谷物中积累的过程中,木质部介导的Cd 转运被认为是水稻籽粒中Cd积累的决定性因素。木质部伤流液中含有多种蛋白,它们不仅参与多种物质的运输,而且还参与植物的生理活动,因此木质部伤流液蛋白质组学研究可说明植物中长距离运输机制对Cd 胁迫的响应。然而在水稻木质部伤流液中,蛋白质如何响应Cd 胁迫在很大程度上仍是未知的。
本研究采用鸟枪法质谱对水稻木质部伤液进行蛋白组的鉴定和分析,在水稻木质部伤流液中共鉴定到了616 个蛋白质,在正常培养的水稻中鉴定到了463 个蛋白质,这明显多于之前研究所鉴定到的118 个水稻木质部伤流液蛋白[24]。值得注意的是,通过全面比对分析发现之前研究鉴定到的118 个木质部伤流液蛋白,只有49%的蛋白与本研究所鉴定到的木质部伤流液蛋白是重合的,这可能与水稻品种、木质部伤流液蛋白组的重复数以及水稻生长培养条件和检测手段的灵敏度有关。通过进一步比对发现,这些重合蛋白主要参与细胞壁合成或修饰、氧化还原调节、新陈代谢等过程。除此以外本研究所鉴定到的69%的蛋白属于分泌蛋白,30.4%的蛋白属于非分泌蛋白,这种比例的非分泌蛋白可能是由于质谱的高灵敏度引起。其次本研究对鉴定到的蛋白进行GO 及Pathway 分析,并着重分析了只存在于Cd 处理样品中的153 个Cd 特异蛋白。对这些Cd 特异蛋白进行功能分类,发现它们与植物抗氧化胁迫、细胞壁代谢和发育等相关,表明这些蛋白在植物应对Cd 胁迫时起着重要的作用,这为植物Cd 的长途转运提供了新的切入点。
植物细胞已经进化出许多机制来保护自己免受Cd 的毒性。细胞壁是防止Cd 进入和破坏原生质体的最重要的物理和化学屏障[49]。植物细胞壁由初级细胞壁和次级细胞壁组成,两者都有一系列解毒机制来应对Cd 胁迫。植物体中的细胞壁是质外体的重要组成成分,细胞壁的修饰代谢可能对Cd 的质外体运输有调控作用,目前有很多研究都表明细胞壁相关的基因与地上部Cd 的积累有关:CesA基因家族编码纤维素合成酶,在细胞壁的纤维素合成过程中发挥关键作用,Cesa9(G101K)突变能够改变传导组织中的细胞壁特性,从而影响Cd 的转运效率而导致地上部的Cd 低积累[50];PME基因编码果胶甲脂酶,参与果胶的修饰过程,由果胶甲酯酶(PMEs)和果胶乙酰酯酶(PAEs)修饰的果胶多糖代表了能够与Cd 结合的最重要的细胞壁成分[51],果胶甲基酯酶(PME)可以通过增加羧基(COO―)的体积调节果胶甲酯化程度来结合Cd,并以此参与到植物对Cd 的反应和积累过程中[52]。这些基因是细胞壁合成或修饰等过程中的关键调控因子,它们的表达水平变化可能导致细胞壁结构的改变,从而影响植物对Cd 的吸收、转运和积累。本研究鉴定到的蛋白中细胞壁代谢相关的蛋白显著富集,通过RNA-Seq 分析到了Os08g0530200、Os01g0786500、Os05g0361500、Os03g0599800、Os06g0726100、Os04g0613200、Os09g0536400、Os08g0502400、Os05g0186300、Os05g0563600、Os03g0672900、Os09g0557900、Os01g0159200、Os03g0167000、Os03g0418000 等细胞壁代谢相关基因受Cd 诱导的表达模式,通过研究这些基因的功能和调控机制,可以深入理解细胞壁与地上部Cd 积累之间的关系,为探索植物的Cd 耐受性机制提供重要线索。
金属离子对植物次生代谢产物的生物合成和积累具有重要调控作用:一方面,通过直接影响生物合成途径中酶的催化活性,改变次生代谢产物的生物合成效率;另一方面,作为环境胁迫因子促发抗氧化酶等防御系统保护植物,激发植物细胞产生一系列的生理生化反应,从而对次生代谢产物的生物合成过程产生间接影响[53]。一般情况下,活性氧在植物体内的产生和清除是动态的平衡状态,Cd 毒害会破坏活性氧的代谢平衡,导致植物体内活性氧的爆发,超氧阴离子、过氧化氢、羟基自由基等活性氧大量累积[54],进而引起膜解体[55]、激素失调[56]、核酸降解[57]等。植物为了应对氧化胁迫,自身演化出了一套活性氧清除系统,抗氧化酶在其中发挥着重要作用。谷胱甘肽代谢在调节氧化胁迫和抵抗非生物胁迫中也非常重要[58-60],其过程主要由谷胱甘肽还原酶、谷胱甘肽过氧化物酶、谷胱甘肽硫转移酶调控[61-62]。本研究鉴定到的水稻木质部伤流液蛋白在Pathway 的分析中次生代谢物的生物合成项显著富集;在GO 功能分析中金属离子的响应、抗氧化活性项显著富集。其中经Cd 处理的水稻木质部伤流液中检测到了多种抗氧化酶相关的过氧化物酶(如Os10g0109600、Os04g0651000、Os03g0235000)和谷胱甘肽硫转移酶(Os03g0135100) 等,表明水稻在Cd 的胁迫下,通过增加抗氧化物酶的活性以及通过谷胱甘肽硫转移酶调控谷胱甘肽代谢等来加快抵抗氧化胁迫,从而减轻Cd 对水稻的毒性。
当Cd 进入植物细胞后便对植物产生一系列毒害作用,细胞凋亡是细胞受内外因子刺激后发生的由自身基因调控的生理性死亡行为,是一个主动和高度有序的生命过程。某些动物细胞凋亡相关研究认为活性氧尤其是过氧化氢是诱发细胞凋亡的普遍信号分子[63]。一些以植物为受体的研究表明,植物在抵抗逆境过程中能产生细胞凋亡,如Al、Cd 胁迫下植物可以通过超氧自由基离子介导细胞凋亡发生[64-65]。本研究中Cd 特异蛋白的GO 功能分析发现,细胞凋亡的生物进程项最为富集,通过注释发现Os11g0138900、Os11g0707000 等均与该进程有关,具体机制有待进一步探究。同时近期有研究证明,多泡体(MVB)定位的AAA 型ATP 酶LRD6-6 可能通过调节MVB 介导的水稻囊泡运输来抑制免疫和细胞死亡[66],本研究鉴定到了被描述为AAA 型ATP 酶家族蛋白Os11g0707000,其是否具有相同功能也有待进一步探究。
苯丙素类是指基本母核具有一个或几个C6-C3单元的天然有机化合物,包括简单苯丙素类、香豆素类、黄酮类和木脂素等,具有抗氧化、抗炎、抗菌、降血脂等多种生物活性[67-70]。苯丙素类化合物由莽草酸途径衍生而来,苯丙氨酸解氨酶(PAL) 是莽草酸代谢途径的关键酶和限速酶,能将莽草酸途径产生的L-苯丙氨酸经过解氨作用,生成反式肉桂酸,继而进入苯丙烷代谢途径,生成香豆酸、芥子酸等中间产物,这些酸可以形成辅酶A (CoA),最终转化为类黄酮、木脂素、酚酸等次生代谢产物,在植物受到生物和非生物胁迫时发挥重要作用[71-72]。苯丙素类的存在关系到植物生长的调节作用和抗御病毒的侵袭作用,已有研究证明OsGRP3能够通过改变水稻苯丙素生物合成途径来增强水稻抗旱性[73],短小芽孢杆菌LZP02 能够通过改善碳水化合物代谢和苯丙素生物合成来促进水稻根系生长[74]。在本研究中Cd 处理的水稻木质部伤流液中检测到了苯丙氨酸解氨酶(Os02g0626100)的表达,对Cd 特异蛋白的Pathway 分析显示苯丙素生物合成显著富集,同时也在正常培养的水稻木质部伤流液中检测到了与苯丙素生物合成相关的Os03g0749300、Os02g0236600、Os02g0626100 等蛋白。
目前土壤Cd 污染主要采用物理修复和化学修复的方法,但遗憾的是这些方法均不能有效的处理Cd污染[75]。在这种情况下低Cd 作物品种的培育和Cd污染农田的植物修复是两项重要的应对策略。为探究一些特异基因在植物修复土壤Cd 污染过程中的应用前景,本研究就木质部伤流液中检测到的已报道参与Cd 长途转运的CAL1基因进行拟南芥转基因探究。本研究发现在拟南芥地上部异源特异表达CAL1基因增加了地上部Cd 的积累量,而对Cd 耐受性没有显著影响,这表明CAL1基因在植物修复土壤Cd污染过程中具有一定的应用前景。
4 结论
水稻木质部伤流液中共鉴定到616 个蛋白质,241 个为经典分泌蛋白,184 个为非经典分泌蛋白;在616 个蛋白中153 个蛋白是Cd 胁迫下所独有的特异蛋白,主要参与了氨基糖和核苷酸糖代谢、乙醛酸和二羧酸代谢、碳代谢、苯丙素生物合成过程。还鉴定到与细胞壁代谢相关的响应Cd 诱导的特异蛋白基因,包括研究已报道的参与Cd 长途转运的CAL1蛋白,在拟南芥地上部异源表达CAL1基因增加了拟南芥地上部Cd 含量,验证了CAL1基因的功能,为Cd 的长距离转运提供了新的研究基因。

