杜仲水提物改善动物睡眠障碍作用机制的网络药理学分析及实验动物验证
吕梦圆,柴学军,崔恩慧,张露露,朱晓岩,陈树林,赵善廷*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.西安医学院基础医学部,陕西西安 710000)

杜仲(EucommiaulmoidesOliver)是一种落叶乔木,别名思仲,在我国有着悠久的药用历史,主要是以树皮入药。《神农本草经》中记载,杜仲性温,味甘,归肝、肾经,具有补肝肾、强筋骨、安胎的功效等[4]。在临床实践中杜仲具有良好的改善睡眠作用,大剂量[20~25g/(kg×d)]的杜仲煎剂对犬进行灌胃,能使其安静、贪睡,不易受外界刺激[5]。然而,杜仲改善睡眠障碍的分子作用机制尚不明确。本研究利用网络药理学和分子对接技术,通过动物试验探究杜仲改善睡眠障碍的作用机制,为杜仲用于治疗睡眠障碍的临床应用和降低畜禽应激,提高畜禽生产性能和免疫力提供理论依据。
1 材料
1.1 数据库与软件
中药系统药理学数据库与分析平台(TCMSP,https://www.tcmsp-e.com/);Uniprot蛋白质数据库(https://www.uniprot.org/),GeneCards综合数据库(https://www.genecards.org/);Drug bank 数据库(https://go.drugbank.com/);人类孟德尔遗传综合数据库(OMIM,https://omim.org/);STRING11.5 数据库(https://cn.string-db.org/);PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/);PDB蛋白质结构数据库(PDB,https://www.rcsb.org/);David6.8在线平台(https://david.ncifcrf.gov/home.jsp); VENNY2.1.0网页版(https://bioinfogp.cnb.csic.es/tools/venny/index.html);Cytoscape 3.8.0软件;ANY-maze软件;Graphpad Prism 8.0.2软件;SPSS 26.0软件。
1.2 药物与试剂
对氯苯丙氨酸,上海阿拉丁生化科技股份有限公司产品;杜仲水提物,陕西全昌荣生物科技有限公司产品;Evo M-MLV反转录试剂盒,荧光定量试剂盒,Accurate Biotechnology公司产品。
1.3 实验动物
30只2月龄ICR雄性小鼠,购于斯贝福(北京)生物技术有限公司,实验动物生产许可证号:SCXK(京)2019-0010,小鼠买回后饲养于22-24℃、湿度为60%±10%的环境中,光照/黑暗各12 h,小鼠可自由取食和饮水。实验动物的使用经过西北农林科技大学动物医学院动物保护委员会批准(编号:SCXK[SHAAN]2017-003)。
2 方法
2.1 杜仲相关靶点筛选
利用TCMSP数据库,设置参数标准为口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug likeness,DL)≥0.18和血脑屏障(blood-brain barrier,BBB) ≥-0.03,获取杜仲的主要有效活性化合物及其作用的蛋白质靶点[6]。整合杜仲有效化合物作用的蛋白质靶点后,删除重复靶点,获得杜仲作用靶点数据集,并利用Uniprot蛋白质数据库将杜仲作用靶点进行规范。
2.2 睡眠障碍相关靶点筛选
以睡眠障碍“Sleep disorders”为关键词,分别在OMIM数据库和GeneCards综合数据库中进行疾病相关潜在靶点的检索。在 GeneCards综合数据库中,Relevance score值越高则代表该靶点与疾病联系密切,故根据经验,若靶点数目过多,则取Relevance score大于中位数的目标靶点为睡眠障碍潜在靶点[7]。合并两个数据库检索结果后,删除重复值即为睡眠障碍靶点。
2.3 PPI网络的构建和核心靶点的筛选
利用VENNY2.1.0网页将杜仲成分作用靶点和睡眠障碍靶点取交集。之后将交集靶点导入STRING11.5 数据库,设定生物种类为智人(Homosapiens), 最小互相作用阈值为中等可信度“medium confidence(0.4)”,其余均为默认设置,构建杜仲治疗睡眠障碍蛋白互作网络(PPI network)并下载PPI 网络的 TSV 格式文件,运用 Cytoscape3.8.0软件对其进行网络分析,根据结果筛选出杜仲改善睡眠障碍的核心靶点。
2.4 靶点GO功能及KEGG通路富集分析
将2.3获得的交集靶点导入David6.8在线平台,物种设置为智人(Homosapiens),进行GO功能富集分析和KEGG通路富集分析。对交集靶点进行 GO 功能分析,以研究杜仲改善睡眠障碍的主要生物功能,包括可能存在的生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF);进行 KEGG 通路富集分析,以研究杜仲改善睡眠障碍的主要信号通路。
2.5 成分-靶点的分子对接验证
利用Cytoscape3.8.0版本软件构建杜仲成分-睡眠障碍靶点-通路网络图进行网络分析,选择度值排名前2的具有水溶性的杜仲成分,在PubChem 数据库下载其 2D 结构导入至Chem3D 20.0.0.41软件中以最小能量进行3D转换。从PDB数据库下载杜仲改善睡眠障碍核心靶点的三维晶体结构,经Pymol2.4.0软件去除水分子和配体,导入至AutoDuckTools1.5.7进行加氢、分配电荷后保存为pdbqt格式文件。将上述两部分文件经AutoDuck4.2.6软件进行分子对接。
2.6 动物试验验证
2.6.1 睡眠障碍模型建立与分组给药 30只2月龄ICR雄性小鼠,适应性饲养1周后,随机分为3组,每组10只,分别为正常对照组、睡眠障碍组、杜仲组。除正常对照组外,其余2组小鼠每日腹腔注射对氯苯丙氨酸(PCPA)溶液450 mg/kg,连续注射2 d,正常对照组腹腔注射等体积的生理盐水。第一次腹腔注射PCPA后24~48 h,睡眠障碍组小鼠活动量增多,攻击性增强,身上出现多处明显创伤,体重下降,与正常对照组小鼠相比差异明显。造模完成后,正常对照组和睡眠障碍组小鼠每日灌胃1次生理盐水(1 mL/100 g),杜仲组的小鼠按1 mL/100 g每日灌胃杜仲水提物溶液(将杜仲水提物粉末加入蒸馏水配成400 mg/mL的溶液)。按照上述灌胃方法,连续灌胃5 d。
2.6.2 小鼠旷场实验 最后一次灌胃结束1 h后,进行旷场试验。从同一角落将小鼠放于长为50 cm,宽为50 cm,高为30 cm的旷场反应箱中,并使用摄像机记录每只小鼠进入旷场后的运动轨迹。每只小鼠的测试时间为5 min,测试完成后使用75%的乙醇清洁旷场反应箱。使用ANY-mazeTM视频跟踪系统分析小鼠在旷场中的运动轨迹。
2.6.3 荧光定量PCR检测 使用TRIzol试剂提取小鼠下丘脑组织总RNA。之后,使用Evo M-MLV反转录试剂盒,将总RNA反转录成cDNA,作为荧光定量PCR的模板,采用Bio-Rad CFX 96TM Real-time PCR检测系统(Bio-Rad)使用荧光定量试剂盒进行荧光定量PCR检测。引物如下:DRD2,F:5′-ACCTGTCCTGGTACGATGATG-3′,R:5′-GCATGGCATAGTAGTTGTAGTGG-3′; GABRA1,F:5′-AAAAGTCGGGGTCTCTCTGAC-3′,R:5′-CAGTCGGTCCAAAATTCTTGTGA-3′; GAPDH,F:5′-AGGTTGTCTCCTGCGACTGCA-3′,R:5′-GTGGTCCAGGGTTTTTTACTCC-3′。在计算基因表达时采用三次测量的平均周期阈值(Ct)值,并使用GAPDH作为内参基因。2-ΔΔCt法测定目标基因的相对mRNA表达量。
2.6.4 统计分析 采用SPSS 26.0统计软件进行分析处理,采用单因素方差分析(one-way ANOVA)进行多组间显著性检验,组间比较采用最小显著性差异法(least significant difference,LSD)。P<0.05 表示差异有统计学意义。采用Graphpad Prism 8.0.2软件将统计数据(mean±SME)绘制成图。
3 结果
3.1 杜仲“化合物-靶点”网络的构建
通过TCMSP数据库的筛选,并剔除没有靶基因的活性成分,共获得杜仲有效化合物13个,包括cyclopamine(环巴胺)、yangambin(鹅掌楸树脂酚B二甲醚)等,见表1(按DL由大到小排列)。去除各活性成分重复作用靶点后,共获得杜仲作用靶点89个。

表1 杜仲活性成分Table 1 Active components of Eucommia ulmoides Oliver
3.2 睡眠障碍相关靶点的筛选
通过Gene Cards综合数据库共检索到睡眠障碍靶点7 621个,根据经验设定Relevance score大于中位数2.824300289的目标靶点为睡眠障碍潜在靶点,共获得睡眠障碍潜在靶点3 799个。通过OMIM数据库共检索到睡眠障碍潜在基因596个,去除两个数据库重复值后,共获得睡眠障碍靶点4276个。
3.3 杜仲改善睡眠障碍交集靶点PPI网络构建
将筛选所得的杜仲靶点和睡眠障碍靶点输入VENNY2.1.0网页进行分析,共获得交集靶点32个。由此可见,杜仲对睡眠障碍有一定的改善作用,交集靶点可能是杜仲改善睡眠障碍的核心靶点。将32个交集靶点导入STRING11.5 数据库,隐藏游离节点后,保存该PPI网络的TSV格式文件,并导入Cytoscape3.8.0软件进行网络分析,结果如表2所示,度值排名前4的靶点分别为HTR3A、GABRA1、DRD2、GABRA2,提示这些靶点可能是杜仲改善睡眠障碍的核心靶点。

表2 杜仲改善睡眠障碍的核心靶点Table 2 The key targets of Eucommia ulmoides Oliver for improving sleep disorders
3.4 靶点GO功能及KEGG通路富集分析
将23个交集靶点导入David6.8在线平台,进行GO分析,以P<0.01为筛选条件,共获得GO富集条目108条,其中包括生物过程(BP)69条,细胞组分(CC)21条和分子功能(MF)18条。根据P值从小到大进行筛选,交集靶点参与的生物过程主要包括化学性突触传递、G蛋白偶联受体信号通路偶联环核苷酸第二信使、细胞钙离子稳态等;细胞组成主要包括突触、质膜的组成成分等;分子功能主要包括神经递质受体的活化、G蛋白偶联的5-羟色胺受体的活化、5-羟色胺的结合、多巴胺神经递质受体的活化等。
对23个交集靶点进行KEGG通路富集分析,根据P<0.01共筛选得到 11 条显著信号通路。根据P值从小到大排列,杜仲治疗睡眠障碍的靶点主要涉及以下KEGG通路:神经活性配体-受体相互作用(Neuroactive ligand-receptor interaction)、钙离子信号通路(Calcium signaling pathway)、味觉转导(Taste transduction)、5-羟色胺能突触(Serotonergic synapse)、多巴胺能突触(Dopaminergic synapse)、cAMP信号通路(cAMP signaling pathway)等。
3.5 分子对接验证
构建杜仲成分-睡眠障碍靶点-通路网络图,结果图1所示,蓝色为杜仲成分,紫色为睡眠障碍靶点,绿色为代谢通路。其中度值排名前2的具有水溶性的杜仲成分分别是Tabernemontanine(烟碱单宁)和Epiquinidine(表奎宁定)。由于PDB数据库中没有适用的GABRA2的三维晶体结构,故将2种化合物分别与其余3个核心靶点进行分子对接,结果见表3,结合能越小,对接效果越好。结果显示,这两种化合物与DRD2靶点和GABRA1靶点的结合能均为负数,结合良好。

DRD1,多巴胺D1受体;DRD2,多巴胺D2受体;DRD3,多巴胺D3受体;DRD4,多巴胺D4受体;DRD5,多巴胺D5受体; GABRA2,γ-氨基丁酸受体α2亚基;GABRA1,γ-氨基丁酸受体α1亚基; NOS3,内皮型一氧化氮合成酶;GABRA5,γ-氨基丁酸受体α5亚基;CASQ2,肌集钙蛋白2; CHRM5,毒蕈碱型乙酰胆碱能受体M5; CALM1,钙调蛋白1;HTR1D,五羟色胺1D受体;PHKA2,磷酸化酶激酶α2亚基;GABRA3,γ-氨基丁酸受体α3亚基; HTR2B,五羟色胺2B受体; HTR3A,五羟色胺3A受体HTR1B,五羟色胺1B受体;HTR2C,五羟色胺2C受体;HTR2A,五羟色胺2A受体;HTR7,五羟色胺7受体DRD1,D(1) dopamine receptor; DRD2,D(2) dopamine receptor; DRD3,D(3) dopamine receptor; DRD4,D(4) dopamine receptor; DRD5,D(5) dopamine receptor; GABRA2,Gamma-aminobutyric acid receptor subunit alpha-2; GABRA1,Gamma-aminobutyric acid receptor subunit alpha-1; NOS3,Nitric oxide synthase 3; GABRA5,Gamma-aminobutyric acid receptor subunit alpha-5; CASQ2,Calsequestrin-2; CHRM5,Muscarinic acetylcholine receptor M5; CALM1,Calmodulin-1; HTR1D,5-hydroxytryptamine receptor 1D; PHKA2,phosphorylase kinase regulatory subunit alpha-2; GABRA3,Gamma-aminobutyric acid receptor subunit alpha-3; HTR2B,5-hydroxytryptamine receptor 2B; HTR3A,5-hydroxytryptamine receptor 3A;HTR1B,5-hydroxytryptamine receptor1B; HTR2C,5-hydroxytryptamine receptor 2C; HTR2A,5-hydroxytryptamine receptor 2A; HTR7,5-hydroxytryptamine receptor图1 杜仲成分-睡眠障碍靶点-通路网络图Fig.1 Eucommia constituents-sleep disorder targets-pathways network

表3 分子对接结果Table 3 The results of molecular docking
3.6 动物试验
3.6.1 杜仲对睡眠障碍小鼠行为学的影响 经过ANY-mazeTM视频跟踪系统分析,各组小鼠的旷场试验结果如图2所示。与正常对照组相比,睡眠障碍组小鼠的运动总距离、平均移动速度和中央区域移动距离均显著增加(P<0.05)。与睡眠障碍组小鼠相比,杜仲组小鼠运动总距离和平均移动速度显著减小(P<0.01),更接近正常对照组, 中央区域移动距离略有减小,但差异并不显著(P>0.05)。
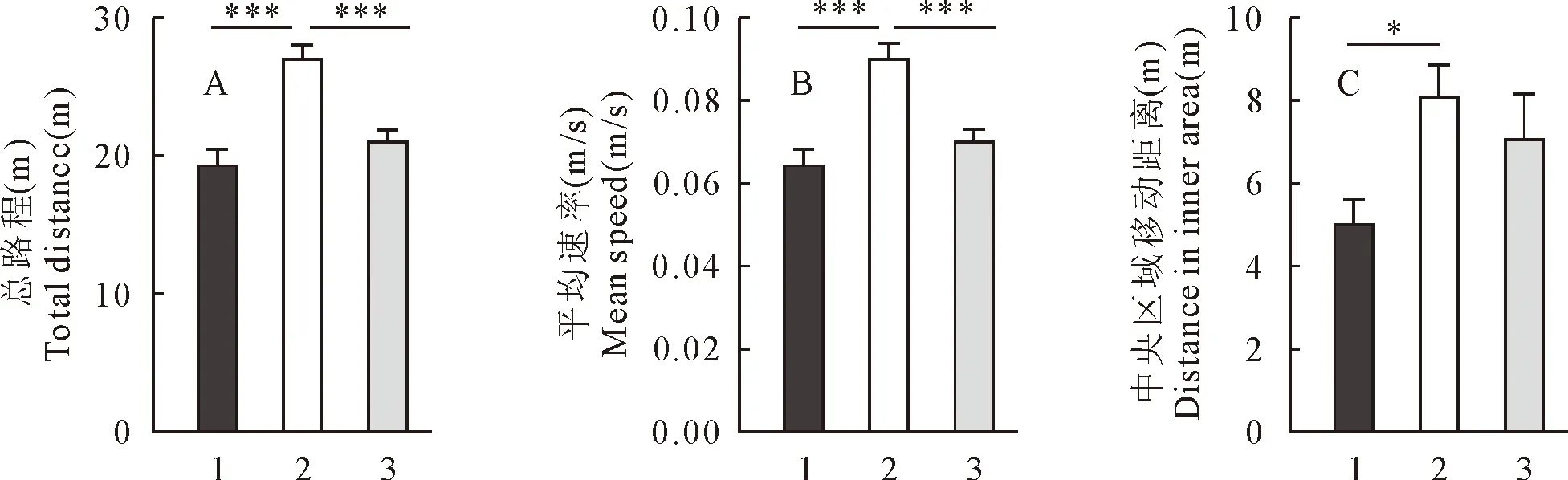
1.正常对照组;2.睡眠障碍组;3.杜仲组1.Control group; 2.Sleep disorders group; 3.Eucommia ulmoides Oliver group图2 各组小鼠旷场试验结果Fig.2 The results of the open field test for each group of mice
3.6.2 杜仲对睡眠障碍小鼠下丘脑DRD2、GABRA1 基因mRNA表达水平的影响 如图3(A)所示,与正常对照组小鼠相比,睡眠障碍组小鼠下丘脑DRD2基因的mRNA的表达水平显著升高(P<0.01);与睡眠障碍组小鼠相比,杜仲组小鼠下丘脑DRD2基因的mRNA的表达水平显著降低(P<0.01),几乎下降到与正常对照组相似的水平。图3(B)结果显示,与正常对照组小鼠相比,睡眠障碍组小鼠下丘脑GABRA1基因的mRNA的表达水平显著降低(P<0.05);与睡眠障碍组小鼠相比,杜仲组小鼠下丘脑GABRA1基因的mRNA的表达水平显著升高(P<0.01),甚至超过了正常对照组。
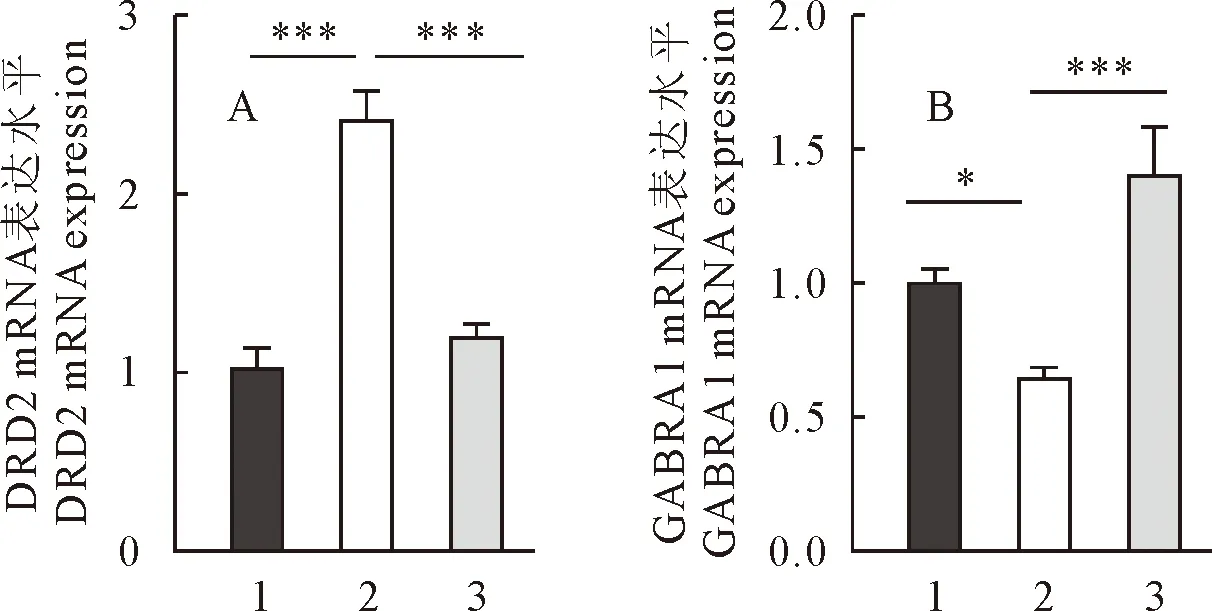
1.正常对照组;2.睡眠障碍组;3.杜仲组1.Control group; 2.Sleep disorders group; 3.Eucommia ulmoides Oliver group图3 各组小鼠下丘脑DRD2、GABRA1基因mRNA表达水平检测结果Fig.3 The results of mRNA expression levels of DRD2 and GABRA1 genes in hypothalamus of each group of mice
4 讨论
《素问·生气通天论》中记载,“阳气者,精则养神”。传统中医学认为阳气具有养神、安神的作用,阳气不足时将导致神气不宁,进而引发睡眠障碍[8]。清代医者郑寿全在《医法圆通》中写道“有因肾阳衰而不能启真水上升以交于心,心气即不得不降,故不卧”,可见心肾不交将导致不寐[9]。杜仲性温,具有温补肝肾的作用,在改善睡眠的中药处方中出现频率较高[10]。然而杜仲改善睡眠障碍的具体作用机制尚未阐明。
本研究利用网络药理学技术,经过筛选,共获得包括烟碱单宁、表奎宁定等13个杜仲有效化合物, 32个药物靶点基因。后经PPI蛋白互作分析,获得4个核心靶点HTR3A、GABRA1、DRD2和GABRA2。经过GO和KEGG分析,预测到杜仲改善睡眠障碍可能参与的生物过程有化学性突触传递等69个,参与的分子功能主要包括神经递质受体活化等18个,参与的代谢通路有神经活性配体-受体相互作用通路等11条。使用Cytoscape 软件构建杜仲成分-睡眠障碍靶点-通路网络,筛选出杜仲调节睡眠障碍的主要化合物为烟碱单宁和表奎宁定。分子对接结果显示这两种化合物与DRD2靶点和GABRA1靶点均结合良好。这表明杜仲有效成分可能通过调控DRD2和GABRA1基因的表达发挥作用。DRD2是编码多巴胺D2受体的基因,GABRA1是编码GABAA受体α亚基的基因。

基于网络药理学和分子对接结果,我们进行了动物实验。目前,腹腔注射对氯苯丙氨酸(PCPA)是国内外常见的研究药物改善睡眠作用的动物模型[17]。PCPA是一种色氨酸羟化酶(TPH)的抑制剂,可以抑制5羟色胺(5-HT)的合成,造成睡眠障碍[18]。旷场实验常用于评估动物的焦虑和自发活动水平[19]。在本研究中,与睡眠障碍组相比,杜仲水提物显著减少了失眠小鼠的运动量(P<0.05),表现出良好的镇静效果。荧光定量PCR结果提示,杜仲有效成分通过调节DRD2和GABRA1基因的表达,发挥镇静和缓解焦虑的作用。
畜禽养殖过程中常发生动物应激反应,后者会导致睡眠障碍,不但降低动物机体免疫力,导致动物易感染疾病,而且会引起动物体重下降,影响畜禽肉蛋奶生产性能。本研究结果表明,中药杜仲水提物可以通过调控DRD2和GABRA1基因的表达改善动物睡眠障碍,为将杜仲水提物开发为动物饲料添加剂用于降低应激提高畜禽免疫力和生产性能提供了依据。

