丛毛红曲霉工程菌TI- 25 高产莫纳可林K发酵工艺优化
张亚如,肖丽酾,陈丽晨,叶燕芳,郑政淮,黄志伟*
(1.福建农林大学 食品科学学院,福建 福州 350002;2.福建农林大学 福建省特种淀粉品质科学与加工技术重点实验室,福建 福州 350002)
红曲是亚洲的一种传统食物,又称为赤米、红米,具有药用和食用的双重用途[1]。红曲霉属(Monascus Van.Tiegh.) 隶属于散囊菌目(Eurtotiales)、曲霉科(Aspergillaceae)[2]。红曲霉发酵籼米(又称为红曲米)被广泛食用[3]。红曲霉发酵后可产生各种有益的次生代谢产物,包括色素、γ-氨基丁酸、莫纳可林K(monacolin K,MK)等[4-5]。
莫纳可林K 最早由日本学者远藤章教授于1979年从红色红曲霉(Monascus ruber)的发酵产物中首次分离获得[6]。莫纳可林K 是一种广泛应用的降血脂药物,其结构与胆固醇合成途径限速酶——3-羟基-3-甲基戊二酰辅酶A 还原酶相似,可高效地竞争性抑制该还原酶的活性,从而有效抑制血液中的胆固醇合成[7-8]。莫纳可林K 在酸性条件下有酸式和内酯式两种结构,其中起降血脂作用的是酸式莫纳可林K[9]。除降血脂外,莫纳可林K 还具有抗癌防癌[10-12]、保护神经[13-14]、抗炎抑菌[15]等生理功能。
红曲霉生产MK 的常见发酵模式有固态发酵(solid state fermentation,SSF)和液态发酵(submerged fermentation,SmF)。在红曲霉产MK 的发酵条件优化研究中,以SSF 的研究居多[16-17],其原因可能是与SmF 法相比,SSF 法有许多优势,真菌在SSF 中能产生更多的酶和次级代谢物,并且有些酶只在SSF 中产生[18]。Zhang 等[19-20]向液态培养基中加入琼脂制成固态培养基,再将红曲霉分别接种于切割成小块的固态培养基与未加琼脂的液态培养基中进行发酵试验,结果发现与SmF 相比,SSF 下红曲霉的生物量积累、MK 合成速率、甘油消耗率、细胞膜的流动性与渗透性以及甘油耐受浓度都明显高于SmF 下的红曲霉。因此,在SSF下红曲霉的MK 产量通常会比SmF 高[21-22]。
本课题组在前期研究中获得了过表达mok I 基因的丛毛红曲霉工程菌TI-25,其MK 产量比出发菌株CICC 5045 提高了41.39%。本试验采用固态发酵的方式,研究发酵瓶装米量、初始加水量、种子液接种量、种子液培养基初始pH 值、培养温度、发酵变温时间6 个因素对该菌株MK 产量的影响,并结合响应面法优化其产MK 的最适发酵工艺,以期为该菌株的应用推广奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 菌株与培养基
供试菌株为丛毛红曲霉过表达mok I 基因的工程菌TI-25。
麦芽汁琼脂培养基:称取145.1 g 麦芽汁琼脂培养基,加入适量纯净水中,加热使其充分溶解后定容至1 000 mL,然后分装于试管中,在121 ℃下高压灭菌20 min。
种子液培养基配方:蛋白胨10 g,葡萄糖30 g,NaNO32 g、甘油70 g,KH2PO41 g,MgSO4·7H2O 1 g,豆粕粉15 g。种子液培养基配制完成后,分装于250 mL三角瓶中(100 mL/瓶),在121 ℃下高压灭菌20 min。
固态发酵基础培养基配方:甘油5 g,籼米30 g,pH 自然,纯净水14 mL,于121 ℃下高压灭菌20 min。
1.1.2 材料与试剂
籼米(金泰香米):泉州万年香米业有限责任公司;麦芽汁琼脂培养基:山东海波海洋生物科技股份有限公司;葡萄糖蛋白胨、甘油、磷酸二氢钾、豆粕粉(发酵专用)、ZnSO4·7H2O、氢氧化钠、75%乙醇、NaNO3、Mg-SO4·7H2O(均为分析纯):国药集团化学试剂有限公司;乙腈、磷酸、甲醇(均为色谱纯):格雷斯(中国)有限公司;MK 标准品(洛伐他汀≥98%):中国食品药品检定研究院。
1.2 仪器与设备
DHG-9005 电热鼓风干燥箱:上海一恒科学仪器有限公司;MDF-382E 超低温保存箱:日本三洋电机贸易会社;ZHWY-200D 恒温摇床:上海智城分析仪器制造有限公司;MJ-54A 高压蒸汽灭菌锅:施都凯仪器设备有限公司;KQ-500VDE 双频数控超声波清洗器:昆山市超声仪器有限公司。
1.3 方法
1.3.1 丛毛红曲霉菌株TI-25 产MK 发酵工艺的单因素试验
1.3.1.1 发酵瓶装米量对MK 产量的影响
在350 mL 发酵瓶中分别装入20、30、40、50、60 g籼米,固定培养基的初始加水量为30 mL、种子液接种量为10%、种子液培养基初始pH4.5、30 ℃培养2 d后,变温为28 ℃继续培养13 d。考察发酵瓶装米量对MK 产量的影响。
1.3.1.2 初始加水量对MK 产量的影响
固定发酵瓶装米量30 g、种子液接种量10.0%、种子液培养基初始pH4.5、30 ℃培养2 d 后,变温为28 ℃继续培养13 d。在大米固态培养基中,分别添加10、15、20、25、30、35 mL 水,考察培养基的初始加水量对MK 产量的影响。
1.3.1.3 种子液接种量对MK 产量的影响
固定发酵瓶装米量30 g、培养基的初始加水量30 mL、种子液培养基初始pH4.5、30 ℃培养2 d 后,变温为28 ℃继续培养13 d。在大米固态培养基中分别接种7.0%、10.0%、13.0%、16.0%、19.0%的种子液,考察种子液接种量对MK 产量的影响。
1.3.1.4 种子液培养基初始pH 值对MK 产量的影响
固定发酵瓶装米量30 g、培养基的初始加水量30 mL、种子液接种量10.0%、30 ℃培养2 d 后,变温为28 ℃继续培养13 d。利用氨水和醋酸调节种子液培养基的初始pH 值,分别调至4.0、4.5、5.0、5.5、6.0、6.5,种子液培养后接种到籼米固态培养基中,考察种子液培养基初始pH 值对MK 产量的影响。
1.3.1.5 发酵变温时间对MK 产量的影响
固定发酵瓶装米量30 g、培养基的初始加水量30 mL、种子液接种量10.0%、种子液培养基初始pH4.5。分别将已接种丛毛红曲霉的发酵瓶置于30 ℃下发酵培养1、2、3、4、5、6 d 后,变温为28 ℃继续发酵培养至15 d,考察发酵变温时间对MK 产量的影响。
1.3.1.6 发酵时间对MK 产量的影响
固定发酵瓶装米量30 g、培养基的初始加水量30 mL、种子液接种量10.0%、种子液培养基初始pH4.5,30 ℃发酵培养2 d,然后28 ℃发酵培养至18 d。将接种丛毛红曲霉后的籼米固态培养基分别培养7、9、13、15、18、21、24 d,考察发酵时间对MK 产量的影响。
1.3.1.7 固态发酵条件最优组合的响应面优化设计
选取单因素试验的最佳条件中心位置,并分别选取在中心位置的左右水平值。选取对丛毛红曲霉MK产量影响较显著的因素:发酵瓶装米量、初始加水量、变温时间,进行三因素三水平的响应面试验设计,因素水平见表1。

表1 响应面试验的因素和水平Table 1 Factors and levels of response surface experiment
1.3.2 高效液相色谱检测和MK 产量计算
酸式MK 标准溶液:准确称取1.5 mg MK 标准品,置于10 mL 棕色容量瓶中,加入2 mL 0.2 mol/L NaOH溶液处理,再用75%乙醇定容至10 mL,50 ℃水浴35 min,超声转化35 min,配制成浓度为150 μg/mL 的标准溶液。
内酯式MK 标准溶液:准确称取1.5 mg MK 标准品,置于10 mL 棕色容量瓶中,以75%乙醇溶解,并定容至10 mL,配制成150 μg/mL 的标准溶液。
待测样品的前处理:称取1.0 g 丛毛红曲霉发酵产物的待测样品,加入10 mL 离心管中,加入75%乙醇溶液定容至10 mL,于30 ℃下超声处理40 min,超声过程的前期、中期、后期均要进行摇匀,超声结束后静置15 min,然后取上清液5 mL,过0.45 μm 滤膜后待进样检测。
色谱条件:色谱柱为Waters SunFire C18(5 μm,4.6 mm×150 mm);流动相为乙腈∶0.1%磷酸水溶液=55∶45(体积比);流速为1 mL/min;紫外检测器的波长为238 nm;柱温为30℃;进样量为20 μL。
高效液相色谱(high performance liquid chromatography,HPLC)检测后,待测样品中MK 产量的计算公式如下。
式中:Y 为MK 产量,mg/kg;W 为稀释倍数;CMK为MK 标准品浓度和待测样品目标物质峰面积(A)的比值,μg/mL;m 为待测样品的质量,g。
1.4 数据处理与统计
采用SPSS 数据处理系统(IBM SPSS Statistics 24.0)和Design-Expert 12.0,对试验数据进行统计分析。
2 结果与分析
2.1 MK 标准品和待测样品的HPLC 图
MK 标准品的高效液相色谱图见图1。丛毛红曲霉菌株TI-25 待测样品的HPLC 色谱图见图2。

图1 MK 标准品的高效液相色谱图Fig.1 HPLC chromatography of standard form of MK
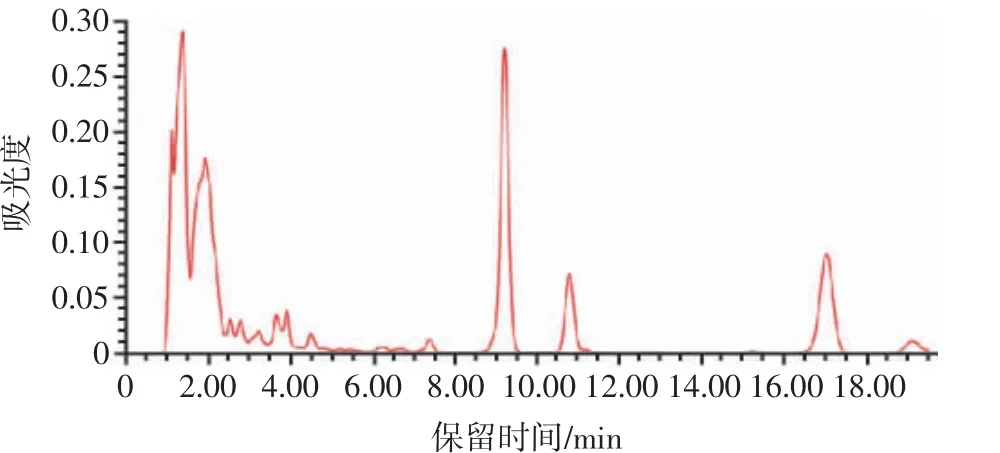
图2 丛毛红曲霉菌株TI-25 待测样品的HPLC 色谱图Fig.2 HPLC chromatography of Monascus pilosus strain TI-25 samples to be measured
由图1 可以看出,在150 μg/mL 浓度下,酸式MK标准品的出峰时间为9.328 min,内酯式MK 标准品的出峰时间为17.751 min,均不存在杂峰,有良好的分离效果。
由图2 可以看出,待测样品中酸式MK 的出峰时间为9.032 min,内酯式MK 的出峰时间为17.751 min,不存在杂峰,有良好的分离效果。
2.2 单因素试验结果
2.2.1 发酵瓶装米量对MK 产量的影响
红曲霉固态发酵中,氧气对产MK 产量至关重要,发酵过程中,瓶装米量对生产MK 的影响较大,而对氧浓度的控制主要取决于发酵瓶装米量的多少。发酵瓶装米量对MK 产量的影响结果如图3 所示。
从图3 可知,当发酵瓶的装米量为20~30 g 时,丛毛红曲霉的MK 产量随发酵瓶装米量增加逐渐提高,且在30 g 时MK 产量最高,可达到303.04 mg/kg,其原因可能是发酵瓶的装米量过少时,培养基里的水分易挥发,培养基变干,无法提供红曲霉正常生长所必需的营养[23]。装米量为30~50 g 时,丛毛红曲霉的MK 产量随着发酵瓶装米量的增加而逐渐降低。分析其原因,可能是发酵瓶中的氧气有限,若装米量过多会加快氧气的消耗,使发酵瓶内产生大量乙醇,不利于红曲霉的生长,从而影响MK 的产量。因此发酵瓶装米量以30 g 最优。
2.2.2 初始加水量对MK 产量的影响
固态发酵基质的不同对其含水量的要求也不同,但一般为40%~60%[24],含水量过高或过低都不利于红曲霉的生长。培养基的初始含水量对MK 产量的影响结果如图4 所示。
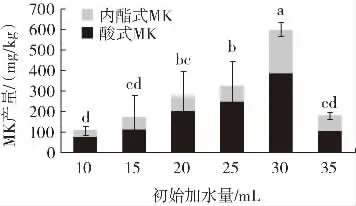
图4 培养基的初始加水量对MK 产量的影响Fig.4 Effect of initial water addition in culture medium on MK yield
从图4 可知,培养基初始加水量的多少对MK 产量有一定的影响。在10~30mL 时,随着初始加水量的增加,丛毛红曲霉菌株TI-25 的MK 产量持续增加;在初始加水量达到30 mL 时,MK 的产量最高,为601.21 mg/kg。分析其原因,加水量少于30 mL 时,米粒发酵不充分,断层稍有白色,米质较硬,水不能将大米完全浸泡,不利于菌体的生长繁殖,导致其MK 产量较低。当初始加水量为35 mL 时,MK 产量大幅下降,且发酵籼米出现严重结团现象,不利于菌体的生长。因此,加30 mL 水最有利于丛毛红曲霉菌株TI-25 的生长和MK 合成。
2.2.3 种子液接种量对MK 产量的影响
种子液接种量的不同会影响菌体的生长状况,进而对其MK 产量存在一定的影响。种子液接种量对MK 产量的影响结果见图5。

图5 种子液接种量对MK 产量的影响Fig.5 Effect of inoculation amount of seed solution on MK yield
如图5 所示,种子液接种量对其MK 产量有一定的影响。当种子液接种量为10.0%时,发酵产物的MK产量最高,达到442.12 mg/kg。分析原因可能是当种子液接种量过少时,菌体生长速度较慢,培养基营养过剩,发酵需要的时间增加,MK 产量较低;当种子液接种量不断增加时,菌体生长繁殖加快,从而消耗的营养及溶氧量不断增加,导致MK 产量受限。因此,丛毛红曲霉产MK 的最佳种子液接种量为10.0%。
2.2.4 种子液培养基初始pH 值对MK 产量的影响
种子液培养基初始pH 值对MK 产量的影响试验结果见图6。

图6 种子液培养基初始pH 值对MK 产量的影响Fig.6 Effect of initial pH of culture medium with seed solution on MK yield
图6 显示,种子液培养基的不同初始pH 值对其MK 产量的影响不大。当种子液培养基初始pH 值小于4.5 时,MK 产量与种子液培养基初始pH 值呈正比,当种子液培养基初始pH 值高于4.5 时,随着种子液培养基初始pH 值的升高,MK 产量整体呈下降趋势。当种子液培养基初始pH 值为4.5 时,MK 产量达到最高,即298.86 mg/kg,说明此时的种子液培养基初始pH 值最适宜丛毛红曲霉产MK。
2.2.5 发酵变温时间对MK 产量的影响
红曲霉发酵过程中,变温培养的MK 产量普遍优于恒温培养,但不同的菌株对变温的需求不同[21-25]。发酵变温时间对MK 产量的影响试验结果见图7。

图7 发酵变温时间对MK 产量的影响Fig.7 Effect of temperature change time of fermentation on MK yield
如图7 所示,发酵变温时间对红曲霉产MK 也有着很大的影响。当30 ℃培养3 d 后变为28 ℃继续培养12 d 时,丛毛红曲霉的MK 产量最高,达到826.75 mg/kg;当30 ℃培养的时间过长时,MK 产量会显著降低,这可能是因为丛毛红曲霉的发酵周期一般为15 d,菌丝体长期在高温下,生长旺盛,营养物质提前耗尽,不利于后期发酵产物的次生代谢物积累,从而降低了MK的产量。因此,30 ℃培养3 d 后变为28 ℃继续培养12 d,为丛毛红曲霉菌株TI-25 固态发酵产MK 的最适变温条件。
2.2.6 发酵时间对MK 产量的影响
不同红曲霉菌株的发酵周期可能不同,要根据具体的菌株确定其适宜的发酵时间[26]。发酵时间对MK产量的影响结果见图8。

图8 发酵时间对MK 产量的影响Fig.8 Effect of fermentation time on MK yield
如图8 所示,发酵时间对丛毛红曲霉MK 产量的影响较大。在发酵前期(1~6 d),MK 的产量很低甚至检测不到,说明丛毛红曲霉产MK 的发酵周期可能较长,发酵前期正处于其生长阶段尚未合成MK;当发酵至15 d 时,MK 的产量达到最高值(261.47 mg/kg);继续发酵,MK 的产量整体呈降低趋势,其可能原因是营养物质在发酵后期消耗殆尽,不能再支持菌体的生长,从而导致MK 的产量降低。因此,红曲霉产MK 的发酵过程中,其MK 产量在发酵至第15 天时达到最大值。
2.3 固态发酵条件最优组合的响应面优化结果分析
2.3.1 响应面优化试验与结果
根据单因素试验结果,利用Design-Expert 12.0 进行中心组合试验设计,所得结果如表2 所示。
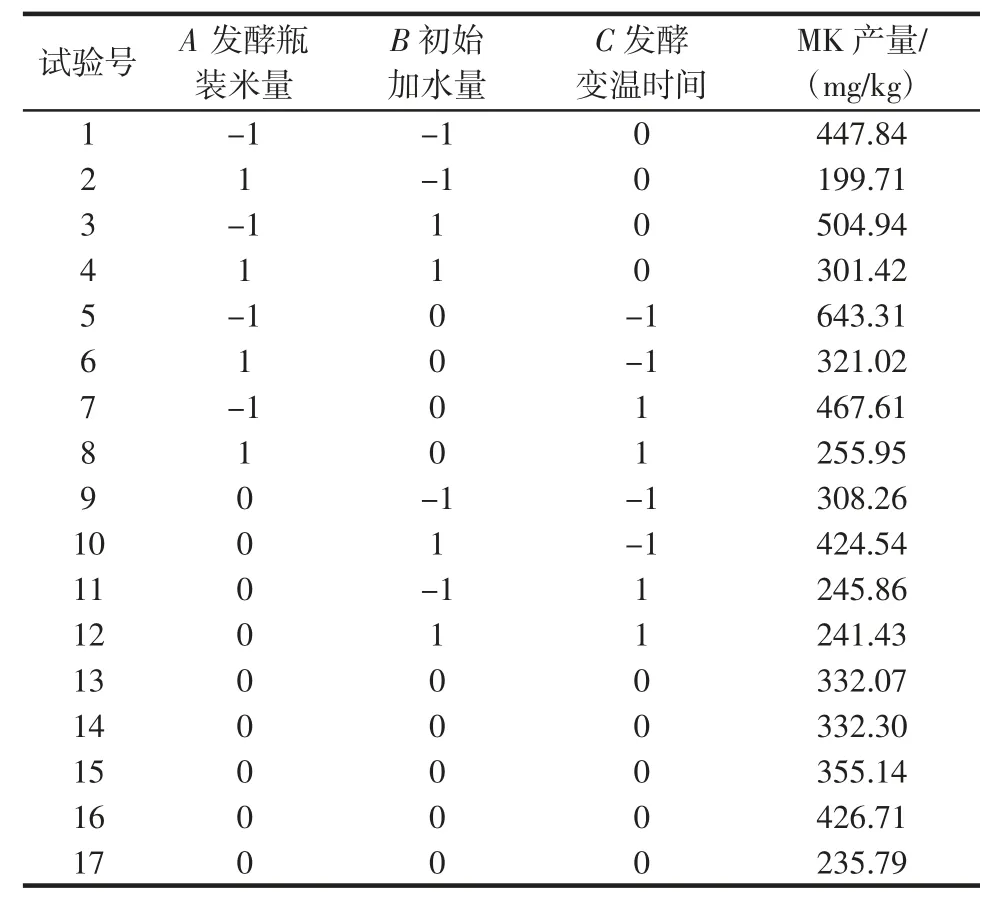
表2 响应面试验设计与结果Table 2 Response surface experimental design and results
2.3.2 响应面模型的建立与分析
利用Design-Expert 12.0 软件对表2 中的试验结果进行回归分析,得到二次回归模型的方差分析结果,见表3。

表3 二次回归模型方差分析Table 3 Analysis of variance for quadratic regression model
对表3 中的数据进行二次多项回归拟合,得到MK产量(Y)对发酵瓶装米量(A)、初始加水量(B)、发酵变温时间(C) 的二次多项式回归方程:Y=336.4-123.20A+33.83B-60.79C+11.15AB+27.66AC-30.18BC+72.01A2-44.94B2+13.56C2。
由表3 可以看出,响应模型极显著,F=7.75,失拟项P=0.967 3>0.05 不显著,表明该模型拟合度较高。方程决定系数R2为0.908 8,说明该方程的回归效果比较理想;预测R2值(0.791 6)与矫正R2值(0.782 7)较为接近,表明该方程不需要做进一步优化。此外,模型的一次项A 影响极显著(p<0.01),C 影响显著(p<0.05)。通过比较F 值的大小得出3 个因素对MK 产量影响的主次顺序为A>C>B,即发酵瓶装米量>发酵变温时间>初始加水量。
各交互作用对MK 产量影响的响应面图见图9。

图9 各因素交互作用对MK 产量的影响Fig.9 Effects of interaction between factors on MK yield
根据三维响应面可以看出各变量之间的交互作用对响应值的影响,等高线是响应面在水平方向的投影,等高线呈椭圆形表示两因素交互作用显著,呈圆形表示两因素交互作用不显著。由图9 可以看出,各因素交互作用大小依次为BC>AC>AB,但各曲面坡度均较平缓,等高线接近圆形,对响应面值的影响均不显著,与表3 的回归分析结果相符。
由该模型得到的最佳发酵条件:发酵瓶装米量20 g,初始加水量32.38 mL,30 ℃培养3 d 后,变温为28 ℃继续培养12 d,种子液接种量10.0%,种子液培养基初始pH 值为4.5,按此条件发酵培养,MK 产量为635.12 mg/kg,与预测的643.61 mg/kg 接近,说明该回归方程预测的MK 产量与实际的MK 产量是一致的。
3 结论
本试验以MK 为目标产物,通过单因素试验和Box-Behnken 响应面优化试验,得出丛毛红曲霉工程菌TI-25 高产MK 的最佳发酵工艺:发酵瓶装米量20 g,初始加水量32.38 mL,30 ℃培养3 d 后变为28 ℃继续培养12 d,种子液种子液接种量10%,种子液培养基初始pH 值为4.5,按此条件发酵培养,MK 产量高达635.12 mg/kg。这与预测值643.61 mg/kg 接近,说明通过响应面优化得到的丛毛红曲霉工程菌TI-25 高产MK 的固态发酵工艺参数准确可靠。

