混菌发酵对西拉葡萄酒香气品质的影响
邢家爱,于庆泉,李福东,锁然,党超,王颉*,刘亚琼*
(1.河北农业大学 食品科技学院,河北 保定 071000;2.中粮长城桑干酒庄(怀来)有限公司,河北 张家口 075400)
西拉(Syrah)葡萄原产于法国罗讷河谷,是世界第四大红色酿酒品种,我国第五大红色酿酒品种。近几年西拉葡萄在我国的种植面积稳步增加,据统计,2016 年我国西拉葡萄种植面积约1 000 hm2,占世界该品种栽培面积的0.6%。西拉所酿葡萄酒因具有浓郁的浆果香、烤肉味以及黑胡椒香气特征而深受消费者喜爱[1]。但国内关于西拉葡萄酒的风味研究相对较少,主要涉及栽培技术对果实品质的影响以及陈酿条件对西拉葡萄酒品质的影响[1-3],酵母菌种对其风味品质的影响尚不明确。
葡萄酒的酒精发酵是涉及多种微生物复杂生化反应的过程,作为主导微生物的酵母菌的种类以及菌种间的相互作用均会影响代谢物的种类和含量[4-5]。目前,葡萄酒生产企业广泛使用商业酿酒酵母(Saccharomyces cerevisiae)进行酒精发酵以便最大程度地保证发酵的顺利完成,并获得稳定的产品质量,但这在一定程度上削弱了葡萄酒的产区独特性[6-7]。研究发现,本土微生物菌群更适应当地的气候、土壤和微生态条件,应用本土酵母菌进行发酵有利于增强葡萄酒风味多样性和产区典型性[8-9]。葡萄生长环境中存在着多种非酿酒酵母(non-Saccharomyces cerevisiae),其分泌的糖苷酶可促进葡萄汁中的糖苷前体物质水解生成挥发性香气化合物,但难以单独完成酒精发酵,通常与酿酒酵母进行混合发酵以改善葡萄酒的风味品质[10-12]。研究表明,戴尔有孢圆酵母参与发酵能提高苯乙醇、辛酸乙酯和癸酸乙酯等的含量,增强马瑟兰葡萄酒的花果香味[13]。美极梅奇酵母与S.cerevisiae 混合发酵提高了澳大利亚西拉葡萄酒中乙酸苯乙酯、庚酸乙酯和芳樟醇等的含量,赋予葡萄酒愉悦的风味[14]。Mestre等[15]报道称,顺序接种有孢汉逊酵母和S.cerevisiae 的马尔贝克葡萄酒中乙酸异戊酯、己酸乙酯和γ-丁内酯的含量高于酿酒酵母单菌发酵的葡萄酒,对葡萄酒的感官特性有积极影响。然而,非酿酒酵母与酿酒酵母混合发酵对国产西拉葡萄酒风味品质的影响研究鲜有报道。
本研究以怀来产区西拉葡萄为原料,选用本土美极梅奇酵母和本土葡萄汁有孢汉逊酵母及商业戴尔有孢圆酵母,分别与酿酒酵母F15 按照不同接种方案进行发酵试验,探究混合发酵对葡萄酒理化指标、挥发性香气成分以及感官品质的影响,旨在为非酿酒酵母对西拉葡萄酒风味品质的改善研究提供参考。
1 材料与方法
1.1 材料与试剂
西拉葡萄:2021 年10 月采自河北怀来桑干酒庄葡萄园,还原糖含量242.6 g/L,可滴定酸含量(以酒石酸计)5.67 g/L。
酿酒酵母(S.cerevisiae)F15:法国LAFFORT 公司;商业戴尔有孢圆酵母(Torulaspora delbrueckii):安琪酵母股份有限公司; 本土美极梅奇酵母(Metschnikowia pulcherrima)、本土葡萄汁有孢汉逊酵母(Hanseniaspora uvarum):均由河北农业大学果蔬加工贮藏实验室前期在怀来产区筛得,保藏于河北农业大学食品科技学院。
YPD 培养基:葡萄糖20 g/L、蛋白胨20 g/L、酵母浸粉10 g/L、琼脂20 g/L(固体培养基时加入),高压灭菌20 min。
葡萄汁培养基:葡萄汁高压灭菌20 min。
果胶酶(食品级,8 600 PGNU/g):法国LAFFORT公司;偏重亚硫酸钾、氯化钠(食品级):国药集团化学试剂有限公司;3-辛醇标准品:美国Sigma-Aldrich 公司;柠檬酸(分析纯):天津市北辰方正试剂厂;磷酸氢二钠(分析纯):天津市科密欧化学试剂有限公司。
1.2 仪器与设备
7890B -5977A 气相色谱质谱联用仪、HP -INNOWAX 色谱柱(60 m×250 μm,0.25 μm):美国Agilent公司;57328-U 固相微萃取仪:美国Supelco 公司;Wine Scan FT 120 葡萄酒成分分析仪:丹麦FOSS 公司;SPX 生化培养箱:宁波东南仪器有限公司;HZQ-F全温振荡培养箱:哈尔滨市东联电子技术开发有限公司;TU-1810 紫外分光光度计:北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 酵母培养
商业酿酒酵母菌株的活化:称取S.cerevisiae F15活性干粉(100 mg/L),将其溶于10 倍体积的37 ℃的无菌水中活化20 min。称取T.delbrueckii 活性干粉(200 mg/L),将其溶于10 倍体积的25 ℃的无菌水中活化20 min。
本土非酿酒酵母菌株的活化:从YPD 固体培养基上挑取M.pulcherrima 和H.uvarum 的单菌落分别接入YPD 液体培养基中,28 ℃摇床培养24 h,以2%的接种量接种到葡萄汁培养基中,28 ℃培养48 h 后以2%的接种量进行酒精发酵。
1.3.2 发酵试验
西拉葡萄除梗破碎后加入20 mg/L 果胶酶,50 mg/L偏重亚硫酸钾,分装于5 L 玻璃发酵罐中,每罐约3.5 L西拉葡萄醪,低温浸渍48 h,按照表1 的接种方案接入酵母种子液,15~25 ℃发酵,每个处理3 组平行。每天监测发酵液比重,当比重降至0.996 时测定发酵液中残糖含量,当残糖含量小于4 g/L 时,分离皮渣,从每个发酵罐中取200 mL 酒样,于-20 ℃保存待测。

表1 发酵试验接种方案Table 1 Inoculation programme of fermentation test
1.4 试验指标测定方法
1.4.1 基本理化指标
酒精度、还原糖含量、总酸含量、pH 值和甘油含量等基本理化指标利用葡萄酒成分分析仪测定,透射扫描波数5 012~926 cm-1。
色度及色调:参考李运奎等[16]的方法测定。酒样经0.45 μm 滤膜过滤,配制与酒样相同pH 值的磷酸氢二钠-柠檬酸缓冲液将酒样稀释10 倍,将待测样品放入1 cm 比色皿中,分别测定其在波长420、520、620 nm下的吸光值A420、A520、A620,色度为三者之和,色调为A420与A520的比值。
1.4.2 挥发性香气化合物
采用气相色谱质谱联用仪测定酒样中挥发性香气物质,参照夏亚男等[17]的方法并稍作改动。吸取8 mL待测酒样于20 mL 样品瓶中,同时加入10 μL 的3-辛醇(300 mg/L)和2 g NaCl,立即盖紧瓶盖密封。40 ℃水浴平衡15 min 后,将萃取头插入样品瓶顶空部分吸附40 min,于气相色谱仪进样口解吸6 min。
色谱条件:升温程序为50 ℃保持2 min,以3 ℃/min的速率升温至80 ℃,再以5 ℃/min 速率升温至230 ℃,持续6 min。进样口温度为240 ℃,不分流进样,载气为高纯氦气,流速为1 mL/min。
质谱条件:电子轰击电离源;电子能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;质谱扫描范围m/z 35~550。
定性与定量分析:利用质谱扫描图谱与NIST14.L谱库进行比对定性,对匹配度为80%以上的组分进行分析。各成分的含量采用内标法进行半定量,选用3-辛醇作为内标物质。
1.4.3 感官评价
品评小组由7 名经验丰富的品酒师和5 名经过专业培训的品评人员组成,采用盲品的方式。在光线充足、通风良好、无异味的房间内进行3 轮。分别从外观(澄清度、色泽)、香气(花香、果香、酒精味)、口感(酸度、甜度、收敛性)和整体评分4 个方面对酒样进行评价,按照10 分制强度等级进行打分,评分范围从0(弱)到10(强),感官评价结果为所有评估小组成员得分的平均值。
1.5 数据统计分析
试验结果用平均值±标准差表示,使用SPSS26 软件进行方差分析和邓肯多重比较,显著性水平P<0.05;使用Origin 2021 软件进行绘图和主成分分析。
2 结果与分析
2.1 酒精发酵过程中比重的变化
不同处理酒样的比重变化如图1 所示。

图1 酒精发酵过程比重的变化Fig.1 Change of specific gravity during alcohol fermentation
由图1 可知,各处理酒样的比重随发酵时间的延长呈持续下降趋势,不同处理酒样的比重下降速率存在差异。发酵前3 d,各处理酒样比重下降均较缓慢,变化不明显。随后比重快速下降,从发酵第10 天开始各处理酒样比重下降速率趋缓,发酵12 d 时F15 处理酒精发酵结束,15 d 时其余处理均完成酒精发酵,且所有处理最终达到相似比重。混合发酵延长了酒精发酵时间,这与Hranilovic 等[14]的研究结果一致。
2.2 不同处理对西拉葡萄酒基本理化指标的影响
酒精发酵结束时酒样的基本理化指标如表2 所示。
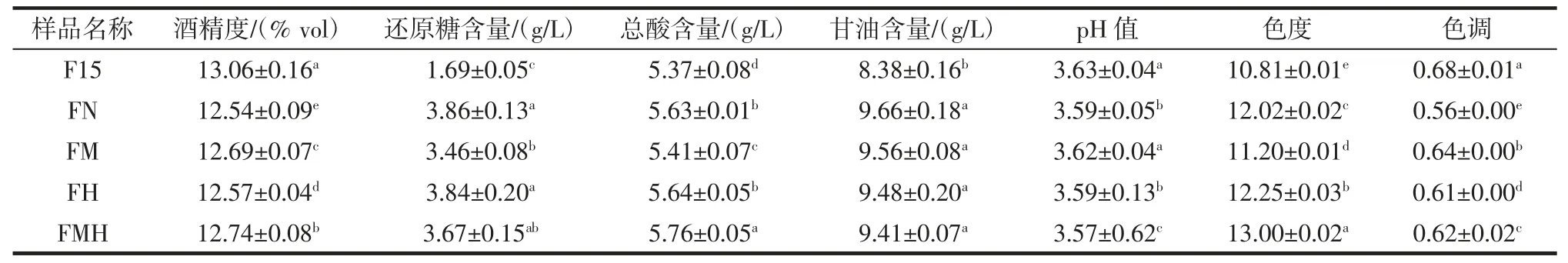
表2 酒精发酵后酒样的基本理化指标Table 2 Basic physical and chemical indexes of wine samples after alcohol fermentation
由表2 可知,5 个处理的还原糖含量均小于4 g/L,混合发酵处理的酒精度(12.54% vol~12.74% vol)均显著低于F15 处理(13.06% vol)(P<0.05),这与宋茹茹等[18]的研究结果一致。非酿酒酵母通过氧化消耗葡萄糖生成除乙醇外的其他代谢产物,从而降低酒样的乙醇含量[19]。此外,混合发酵的葡萄酒中甘油含量提高了12.3%~15.3%,甘油可以增加葡萄酒的黏度,赋予葡萄酒圆润的口感和丰满的酒体。相关研究显示,非酿酒酵母具有较强的产甘油能力,如H.uvarum 与S.cerevisiae混合发酵的甘油含量高于酿酒酵母单独发酵[20]。混合发酵显著提高了葡萄酒色度(P<0.05),这可能与混合发酵处理丙酮酸含量增加有关,丙酮酸与花色苷形成色素vitisin A,有助于增加色素稳定性[21]。与单菌发酵相比,混合发酵葡萄酒的色调显著降低(P<0.05),颜色更偏向红色,这与梁丽红等[22]的研究结果一致。
2.3 香气成分分析
不同处理对西拉葡萄酒挥发性香气化合物的影响如表3 所示。

表3 不同试验处理葡萄酒的香气成分及其含量Table 3 Aroma components and their contents in wine samples with different test treatments
由表3 可知,供试酒样共检测出37 种挥发性香气物质,包括17 种酯类(其中乙酸酯类5 种、乙醇酯类10 种以及其他酯类2 种)、10 种高级醇类、4 种脂肪酸类和6 种其他类化合物。不同处理对西拉葡萄酒挥发性香气成分的影响差异较大,其中FM 香气物质含量最高,为27 787.61 μg/L,对照F15 香气物质含量最低,为23 254.24 μg/L。
酯类物质是葡萄酒中重要的风味组成成分,主要包括乙酸酯和乙醇酯,它们能够为葡萄酒带来愉悦的花香和果香味[23]。本试验各处理酒样中酯类总含量从高到低依次是FM>FH>FN>FMH>F15,混合发酵有利于提升酯类产量,这与李毅丽等[24]的研究结果一致。与对照F15 相比,混合发酵处理乙酸异戊酯含量提高了54.2%~204.2%,且含量均超过其阈值,增强了葡萄酒的果香特征。乙酸苯乙酯可以赋予葡萄酒栀子花香和玫瑰花香,本试验FM 酒样中乙酸苯乙酯含量明显高于其他处理。此前有研究发现M.pulcherrima 与S.cerevisiae顺序接种发酵提高了葡萄酒中乙酸苯乙酯的含量[25]。供试酒样中共检测出10 种乙醇酯类化合物,其中辛酸乙酯(梨香、菠萝)、癸酸乙酯(椰子味、果香)和己酸乙酯(青苹果、草莓、香蕉)含量较高,对葡萄酒的果香有重要贡献,混合发酵均提高了己酸乙酯的含量。
高级醇是酵母代谢的副产物之一,在氨基酸或糖的作用下,通过Ehrlich 途径和葡萄糖合成代谢途径生成[26],对葡萄酒香气有重要影响。当含量低于300 mg/L时会增加葡萄酒的香气复杂性,当含量过高时则会给葡萄酒带来负面影响[27]。由表3 可知,混合发酵显著提高了苯乙醇含量(P<0.05),其中FN 酒样中苯乙醇含量最高,是F15 处理的2.29 倍,赋予葡萄酒玫瑰、蜂蜜、丁香花的香气。混合发酵酒样的异丁醇含量为对照的1.71 倍~3.86 倍,李毅丽等[24]和夏鸿川等[28]的研究也得到相似结果。此外,仅在FM 和FH 酒样中检测到辛醇,给葡萄酒带来了茉莉花香和柠檬香味。
葡萄酒中的脂肪酸对香气平衡起重要作用,低浓度时能赋予葡萄酒奶酪、黄油等香气特征,高浓度则会有醋酸味和刺激味[29]。本试验共检测出4 种脂肪酸,与对照F15 相比,混合发酵处理显著降低了酒样中挥发性脂肪酸总量,同时混合发酵处理的葡萄酒中辛酸和己酸的含量明显减少。这与宋茹茹等[18]的研究结果一致,T.delbrueckii 与酿酒酵母混合发酵显著降低了辛酸含量,有利于减少葡萄酒的酸败味。萜类物质具有较低阈值,对葡萄酒中花香和水果香有重要贡献[30]。本试验中测得的萜烯类化合物有香茅醇和β-香茅醇,其中β-香茅醇只在对照F15 中检测出,而香茅醇含量在各处理中差异不明显。
不同处理香气物质的主成分(principal component,PC)分析如图2 所示。

图2 香气化合物主成分分析的因子载荷图Fig.2 Factor load diagram of principal component analysis of aroma compounds
由图2 得知,PC1 的贡献率为50.2%,PC2 的贡献率为23.5%,总贡献率为73.7%。各处理在图中彼此分离,F15 处理与顺序接种发酵处理分别位于PC1 的左右两侧且相距较远,说明混合发酵处理改变了葡萄酒的香气轮廓。其中F15 位于PC1 的正方向和PC2 的负方向上,主要有Y12(棕榈酸乙酯)、Y35(β-香茅醇)、Y30(癸酸)和Y16(己酸异戊酯)等香气成分。而混合发酵处理组均位于PC1 的负方向上,其中FMH 位于PC2 的负方向上,与Y27(丙醇)、Y20(壬醇)、Y13(9-癸烯酸乙酯)和Y37(2,4-二叔丁基苯酚)相关性强;FN、FM 和FH 位于PC2 的正方向上,酒样中Y3(乙酸苯乙酯)、Y10(己酸乙酯)、Y5(乙酸乙酯)、Y21(苯乙醇)、Y2(乙酸异戊酯)、Y6(辛酸乙酯)、Y9(丁酸乙酯)和Y23(正己醇)等香气物质含量丰富,这些物质为葡萄酒贡献了浓郁的花香味和果香味。
2.4 感官评价结果
不同处理西拉葡萄酒的感官分析结果如图3 所示。

图3 酒精发酵结束西拉葡萄酒香气轮廓图Fig.3 Aroma profile of Syrah wine after alcohol fermentation
从外观方面来看,葡萄酒的澄清度无明显差异,混合发酵的葡萄酒色泽评分略高于对照。口感方面,混合发酵的葡萄酒酸度评分略高,各处理甜度和收敛性差别不大。在香气方面,对照组的酒精味较明显,与该处理酒样的乙醇含量较高相一致。添加非酿酒酵母发酵弱化了酒精味,并且具有更加浓郁的花香和果香味,这与混合发酵处理酒样中一些酯类物质和高级醇类物质含量增加有关,祝霞等[29]也发现混合发酵明显增强了葡萄酒的花香和果香特征。综合分析,FM 处理的酒样香气馥郁、口感平衡且酒体丰满,整体感官评分最高。
3 结论
本试验探究了不同非酿酒酵母与酿酒酵母混合发酵对西拉葡萄酒理化指标、挥发性香气成分以及感官品质的影响。结果表明:与对照F15 相比,混合发酵处理葡萄酒的乙醇含量显著降低,甘油含量及色度均显著增加(P<0.05)。在香气方面,混合发酵均提高了香气物质总量,其中FM 酒样的香气物质总量比对照增加了19.5%,增强了西拉葡萄酒愉悦的果香和花香味,感官评价结果表明FM 葡萄酒香气浓郁协调,且具有良好的口感,整体评分最高。综上所述,本土M.pulcherrima 与S.cerevisiae 顺序接种发酵对改善西拉葡萄酒的香气品质有积极作用,具有潜在的应用价值。

