混合光照对雨生红球藻PSII 光化学活性与色素积累的影响
张娟,李翔宇,窦勇*,原雪峰,周文礼,尚东维
(1.天津农学院 天津市水产生态及养殖重点实验室,天津 300384;2.天津天食水产科技发展有限公司,天津 300150;3.天津现代天骄农业科技股份有限公司,天津市生态绿色饲料重点实验室,天津 301801;4.天津食品集团有限公司,天津 300074)
雨生红球藻(Haematococcus pluvialis)是一种绿藻门的单细胞微藻,其生活史主要有两个阶段,分别是游动细胞阶段和不动细胞阶段。游动细胞阶段依靠两条顶生等长的鞭毛进行运动,细胞富含叶绿素,呈绿色;不动细胞阶段没有鞭毛不能运动,细胞内合成并积累虾青素,呈红色。虾青素(astaxanthin,ASTA)是一种脂溶性类胡萝卜素,是迄今为止在自然界有机体中发现的抗氧化能力最强的物质[1],因其具有清除自由基、提高机体免疫力的作用,目前被用作保健品辅料和食品添加剂[2-4]。此外虾青素还有良好的着色效果,可以进入生物体并贮存在组织中,中国人民共和国农业农村部2003 年318 号公告中指定天然虾青素为水产动物唯一着色剂[5-6]。雨生红球藻不动孢子内虾青素含量可以占到细胞干重的1.5%~4.0%,且虾青素均为具有高生物活性的(3S,3'S)异构体,目前雨生红球藻被公认为自然界中生产天然虾青素的最佳生物。
自然条件下雨生红球藻合成虾青素的效率和对底物、能源的利用率都很低,无法支撑虾青素的工业化生产,因此调节环境因子进行人工诱导成为提高雨生红球藻产虾青素能力的常用方法。光照是微藻生命活动不可缺少的环境因子,合理调制光照条件可以促进雨生红球藻积累虾青素,同时不产生额外污染,是生产藻源虾青素经济有效的手段。研究表明,不同光照对雨生红球藻的诱导效果不同[7],红光利于雨生红球藻生长,而蓝光有助于雨生红球藻积累虾青素,此外连续光照较光暗交替更利于虾青素积累[4]。Ma 等[8]使用150 μmol/(m2·s) 的白光发光二极管(light-emitting diode,LED)和70 μmol/(m2·s)的蓝光LED 对雨生红球藻进行照射,发现两种光照条件下微藻细胞内的虾青素和总脂肪酸含量显著上升,与色素合成及脂质积累相关的多种基因表达量也明显上调。目前的研究多集中于单一光照对雨生红球藻积累虾青素的影响,混合光照的作用鲜见报道。本研究探索了蓝光混合白光条件下雨生红球藻光系统Ⅱ(photosystem Ⅱ,PSII)光化学活性和积累色素含量的变化,以期为优化光照组合提高藻源虾青素产量提供一定的数据支持。
1 材料与方法
1.1 材料与试剂
KOH、甲醇、乙醇、丙酮(均为分析纯):天津市风船化学试剂科技有限公司。
雨生红球藻(H.pluvialis)来自天津市水产生态及养殖重点实验室藻种室,使用改良Bold 基础培养基(Bold’s basal medium,BBM)培养,12 h/12 h 明暗交替,温度(22±1)℃。
1.2 仪器与设备
血细胞计数板(718620):普兰德(上海)贸易有限公司;紫外-可见分光光度计(TU-1810):北京普析通用仪器有限责任公司;浮游植物分类荧光仪(IMAGING-PAM):德国WALZ 有限公司。
1.3 方法
1.3.1 试验设计
使用培养至对数生长期的雨生红球藻进行试验,各试验组的初始细胞密度均设置为5×105个/mL。混合光照处理组为54 μmol/(m2·s) 白光基础上增加蓝光(主波长为455.8 nm,峰值波长为450.3 nm),蓝光的光照强度设置为18、36、54、72 μmol/(m2·s),对照组为54 μmol/(m2·s)白光,各试验组设置3 次平行。每天摇晃培养瓶6 次,防止藻细胞出现沉积。
试验周期为27d,每3d 取样测定雨生红球藻细胞密度、叶绿素含量、PSII 光化学活性参数以及虾青素含量。
1.3.2 藻细胞密度的测定
采用血细胞计数板法测定藻细胞密度,试验每隔3 d 取样,在光学显微镜下每个样品计数3 次,取平均值。其中细胞总数为A,计数板为80 小格,稀释倍数为D。藻细胞密度含量(T,105个/mL)参照下式计算。
1.3.3 叶绿素荧光参数的测定
使用浮游植物分类荧光仪测定叶绿素荧光参数,在测定开始前将所得样品暗处理15 min,直接测得可变荧光(Fv)、最大荧光(Fm)、平行组可变荧光(Fv’)、平行组最大荧光(Fm’)、叶绿素a(Chla),继而得出有效光能转化效率(Yield)、最大光能转化效率(Fv/Fm)、实际光能转化效率(electron transport rate,ETR)的值[9-12]。
1.3.4 叶绿素含量的测定
参照郑小恽等[13]的方法,采用分光光度计法,分别测定645 nm 和663 nm 处乙醇提取液的吸光度(A645、A663),每隔3 d 取藻液一次,5 000 r/min 离心10 min,保留沉淀,即藻泥。按1∶50(g/mL)料液比,在藻泥中加入95%乙醇,避光浸提24 h 至藻体发白,5 000 r/min 离心10 min 后取上清液,测定其A645和A663。依据下式计算叶绿素含量(C,mg/L)。
1.3.5 雨生红球藻中虾青素(astaxanthin,ASTA)含量的测定
参照韦韬等[14]以及李嘉仪等[15]的方法测定虾青素含量。取5 mL 藻液进行离心,弃上清液,加入5 mL 超纯水清洗,重复2 次。然后用5 mL 的5%氢氧化钾+30%甲醇溶液破坏叶绿素5 min,弃上清液后加5 mL超纯水清洗两次。弃去上清液后在收集到的藻泥中加入2 mL 丙酮,用细胞破碎仪处理10 min,后4 ℃离心15 min(10 000 r/min),保留上清液,测定其A480,重复以上操作,直至藻团呈白色,色素提取完全为止。依据下式计算虾青素含量(X,mg/L)。
式中:D 为稀释倍数。
1.4 数据处理
使用SPSS 22.0 统计软件对获得的试验数据进行单因素方差分析,利用Duncan’s 多重比较法检验平均值的差异显著性,显著性水平设定为P=0.05,用EXCEL 2007 软件作图。
2 结果与分析
2.1 混合光照对雨生红球藻细胞密度的影响
在白光一定的条件下,混合蓝光对雨生红球藻细胞密度的影响如图1 所示。
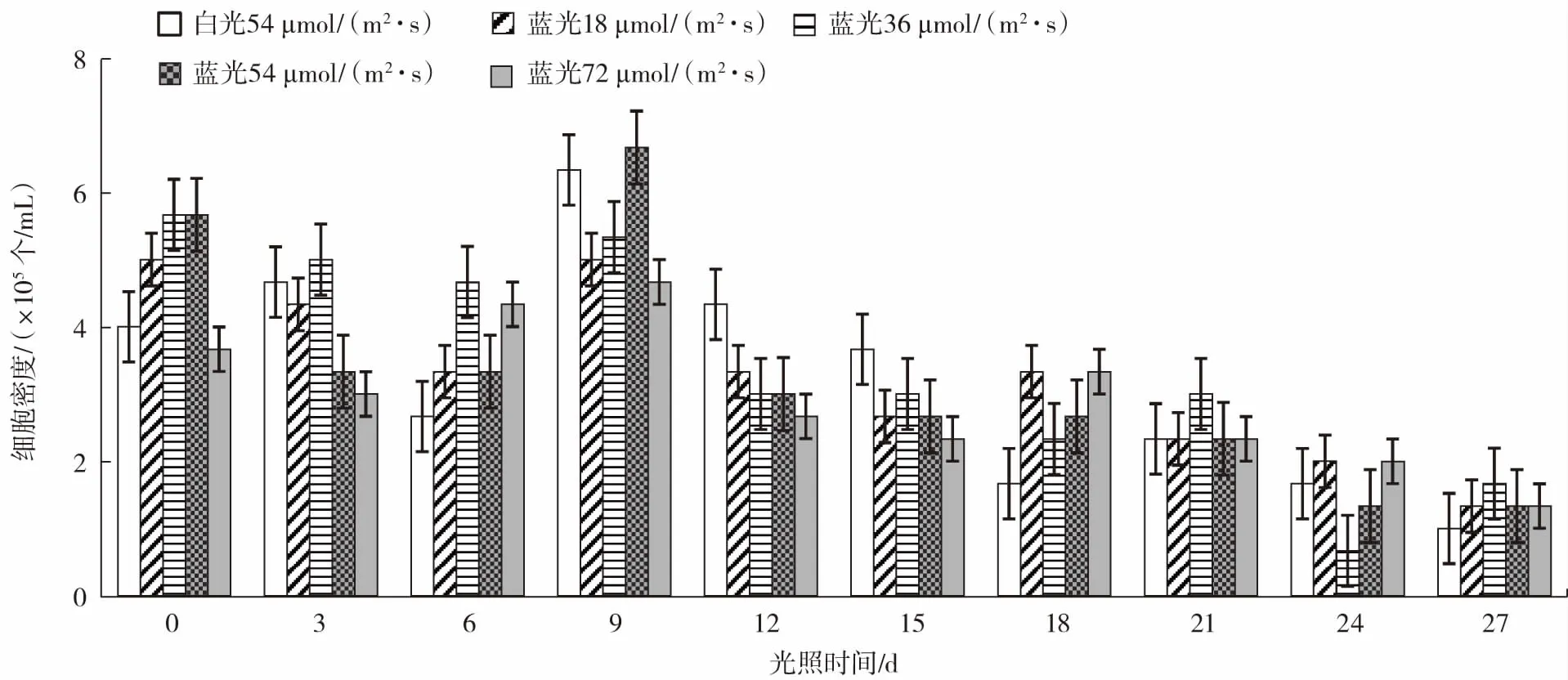
图1 混合蓝光对雨生红球藻细胞密度的影响Fig.1 Effects of mixed blue light on cell density of Haematococcus pluvialis
如图1 所示,总体藻细胞密度随着时间延长,混合蓝光试验组和白光对照组的差距逐渐减小。在第9 天之后,试验组的藻细胞密度整体呈下降趋势,表明混合蓝光对雨生红球藻细胞具有逆境胁迫作用。说明蓝光对雨生红球藻细胞密度具有胁迫影响并能抑制雨生红球藻的生长,且整体来看36 μmol/(m2·s)强度的光照抑制性更强。
2.2 混合光照对雨生红球藻最大光能转化效率(Fv/Fm)的影响
在荧光测定中,可变荧光(Fv)与最大荧光(Fm)的比值Fv/Fm 为最大光能转化效率,体现了植物PSII 潜在的最大光合能力。Fv/Fm 在植物正常生理状态下,变化非常小,几乎不受物种和生长条件的影响,但在胁迫条件下该参数会明显降低[16-17]。植物利用的光能极为有限,当植物吸收的光能超出利用范围时,会出现光抑制和光破坏现象[18]。为防止该现象损伤植物的光合系统,植物自身形成了保护系统[19]。因此,Fv/Fm 是反映微藻生长态势的一个关键性指标。图2 为雨生红球藻的Fv/Fm 值在27 d 内的变化情况。
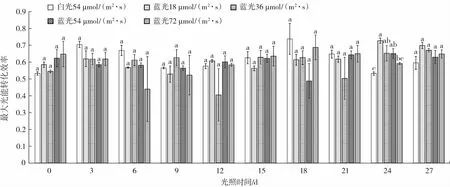
图2 雨生红球藻的最大光能转化效率变化Fig.2 Changes of maximum light energy conversion efficiency of Haematococcus pluvialis
由图2 可知,增加不同光照强度蓝光的处理组的Fv/Fm 参数整体上都低于白光对照组,这表明虾青素主要以虾青素酯的形式存在,所以Kobayashi 等[20]推测虾青素能清除活性氧分子,从而保护光合器官和光合色素,保护其不被氧自由基伤害[18-19]。就混合光照处理组的Fv/Fm 整体来看,从试验开始第0 天到第9 天之间呈现下降趋势,但在第18 天有回升现象,说明雨生红球藻的PSII 反应中心经过一段时间后对白光产生了依赖,且随时间的延长,雨生红球藻的保护机制越发成熟。试验第27 天,不同光照强度的试验组与试验第0 天比较,Fv/Fm 分别升高了0.120、0.130、0.010、0.001。结果说明在固定白光的条件下混合不同强度的蓝光处理组对雨生红球藻加强了保护作用,并且36 μmol/(m2·s)的处理组Fv/Fm 值改变幅度最大。
2.3 混合光照对雨生红球藻有效光能转化效率的影响
有效光能转换效率可以反映PSII 反应中心在有部分关闭的情况下实际原初光能捕获效率,叶片不需经过暗适应在光下可直接测得[21]。有效光能转换效率升高说明混合光照的光保护系统存在,能避免氧自由基破坏光合器官和光合色素[22]。混合光照对雨生红球藻光能转化效率的影响如图3 所示。

图3 雨生红球藻的实际光能转化效率变化Fig.3 Changes of actual light energy conversion efficiency of Haematococcus pluvialis
由图3 可知,在固定白光时,混合不同光照强度蓝光试验组的有效光能转换效率在9、12、21、24、27 d 整体上高于对照组,这表明混合光照强化了雨生红球藻的实际光和能力。到试验的第27 天,雨生红球藻混合蓝光光照强度为18、54 μmol/(m2·s)组的Yield 值与第0 天相比分别上升了22%、9%,其他光照强度均呈现下降趋势,说明18、54 μmol/(m2·s)光照强度的混合蓝光对于升高PSII 的实际光合能力更加明显。
2.4 混合光照对雨生红球藻的表观光合电子传递效率(ETR)的影响
表观光合电子传递效率又称非循环光合电子传递效率,是反映植物PSII 反应中心活性与光合电子传递效率的重要指标,转折点的大小可以反映植物对光强敏感度的强弱[23-24]。混合光照对雨生红球藻表观光合电子传递效率的影响变化如图4 所示。

图4 雨生红球藻的表观光合电子传递效率变化Fig.4 ETR changes of Haematococcus pluvialis
由图4 可知,在白光条件下混合不同蓝光处理组的ETR 值在12、21、24、27 d 整体高于对照组,说明混合蓝光有利于发挥雨生红球藻PSII 反应中心的活性,同时也使光合电子传递效率上升。试验第27 天时,与试验第0 天相比18 μmol/(m2·s) 和54 μmol/(m2·s)照度组分别升高了21%和5%,说明18 μmol/(m2·s)和54 μmol(/m·2s)光照强度的混合蓝光对增高ETR 的作用更加明显。
2.5 混合光照对雨生红球藻积累虾青素的影响
混合不同光照强度蓝光对雨生红球藻积累虾青素含量的影响见图5。
由图5 可知,随时间的延长,虾青素含量整体上呈现缓慢上升态势,但是试验第0 天对照组和试验组之间变化不显著。在第24 天处理组虾青素含量大幅增长,且达到最高峰,此时18 μmol/(m2·s)光照强度的蓝光处理组的虾青素含量达最大值,为7.32 mg/L,是对照组的1.27 倍。由图5 可以看出,混合蓝光可明显促进雨生红球藻积累虾青素,尽管峰值在18 μmol/(m2·s)光照强度组,但从不同时间点综合分析来看54 μmol/(m2·s)光照强度的蓝光对虾青素积累的作用更强。
在白光固定的条件下混合蓝光对微藻的生长具有抑制作用,试验时间内,54 μmol/(m2·s)光照强度的蓝光组,雨生红球藻单位细胞内虾青素含量累积的速度整体比其他试验组高。通过对比不同光照强度蓝光下雨生红球藻积累虾青素高峰期(24 d)总虾青素产量的变化,得出结果为总虾青素的含量显著比对照组高。但总虾青素产量并不能反映单细胞合成虾青素的能力,在本研究中根据测得的总虾青素产量和雨生红球藻的细胞密度数值,来计算单位细胞虾青素的含量[25-26]。
2.6 混合光照对虾青素和叶绿素比值的影响
利用虾青素和叶绿素的比值可以了解虾青素与叶绿素之间的关系,还可以对经过不同光照强度蓝光照射的雨生红球藻中虾青素含量的变化作进一步的分析。混合光照对虾青素和叶绿素比值的影响如图6所示。

图6 混合不同光照强度蓝光对虾青素/叶绿素的影响Fig.6 Effects of blue light with different illumination on astaxanthin/chlorophyll
由图6 可知,叶绿素的变化没有规律,该变化说明在虾青素的积累过程中无过分消耗叶绿素的现象[27]。图5 中虾青素随培养时间的延长呈上升趋势,54 μmol/(m2·s)的蓝光积累效果最好。但在图6 中,虾青素和叶绿素的比值整体呈上升趋势,虾青素和叶绿素的比值在前21 d 几乎无明显变化。分别从不同时间点单独分析,在3、6、9、21、24、27 d 时54 μmol/(m2·s)的蓝光光照强度在虾青素积累中最为明显。其中第24 天试验组虾青素和叶绿素的比值达到峰值,综合可得蓝光照强度为54 μmol/(m2·s)时可加强雨生红球藻积累虾青素的能力。
3 讨论
光是环境中重要的信号因子,对微藻的生长发育具有重要的调控作用,光不仅提供光合作用所需要的能量,自身也蕴含光质、光强和光周期等信息[28-31]。微藻通过光受体分子感知光照信号,并通过信号转导系统调控多种生理过程,包括形态建成、生物节律、趋光性以及次级代谢产物合成与积累等[32]。
不同种类微藻的生命活动对光强和光质具有明显的选择性。研究证实,北方娄氏藻(Lauderia borealis)适宜在45~63 μmol/(m2·s)光强下生长[32],而王祎哲等[33]发现,54 μmol/(m2·s)的光强最适合纤细裸藻(Euglena gracilis)生长,而蓝光与白光对纤细裸藻生长有显著促进作用(P<0.05),蓝光条件下细胞内色素质量浓度达到峰值。另有研究指出,蓝光条件下蛋白核小球藻(Chlorella pyrenoidosa)不仅生长效果最佳,而且叶绿素b 合成旺盛[31]。而本试验发现白光抑制了雨生红球藻生长,尤其是试验后期微藻细胞密度显著降低,而混合蓝光后抑制效果更加明显,说明不同微藻对光质的需求有较大差异,这可能是因为不同微藻细胞内存在着差异化的光敏色素,这些色素分子具有不同的光质和光强偏好所致[32]。
光照条件不仅影响微藻正常的生命活动,而且影响其细胞内次级代谢产物合成与积累。已有文献证实,不同光质对雨生红球藻的诱导效果不同[7],红光有利于雨生红球藻生长,蓝光有助于雨生红球藻积累虾青素[4],本研究的结果印证了这一结论。Ma 等[8]使用72 μmol/(m2·s)的蓝光对雨生红球藻进行处理,结果表明,微藻细胞内的虾青素和总脂肪酸含量显著上升,与色素合成及脂质积累相关的基因psy、crtO、bkt2、lcy、crtR-B、fata 和dgat 表达量明显上调。此外光周期也会影响雨生红球藻积累虾青素的过程,有研究说明连续光照较光暗交替更利于虾青素积累[4],江红霞等[34]发现微藻细胞内的虾青素含量随光照强度上升而提高,在270 μmol/(m2·s)条件下连续照射10 d 微藻细胞内的虾青素水平和抗氧化能力最高。
雨生红球藻的生活史受环境影响很大,条件适宜时表现为富含叶绿素的营养细胞,环境恶劣时表现为累积虾青素的休眠孢子。本研究设定的光照条件已成为雨生红球藻的胁迫因子,可以看到微藻细胞内的虾青素/叶绿素大体呈上升趋势,这与雨生红球藻应对和适应恶劣环境直接相关。
4 结论
混合蓝光处理组的细胞密度随试验时间延长呈整体下降趋势,说明混合蓝光对雨生红球藻生长具有抑制作用,其中36 μmol/(m2·s)混合蓝光的光照强度组对雨生红球藻的抑制作用最为明显。
其中蓝光试验组的Fv/Fm、Yield 和ETR 参数普遍高于对照组,说明胁迫状态下,雨生红球藻光合作用的结构和功能都受到了光损害,植物因此产生自我保护机制。但在研究的第27 天,18、36、54、72 μmol/(m2·s)光照强度组的蓝光与试验第0 天相比,Fv/Fm 值整体都有所升高,其中36 μmol/(m2·s)光照强度组变化的数值最大。
研究表明,蓝光光照强度为54 μmol/(m2·s)时对于雨生红球藻积累虾青素效果整体强于其他组,尽管18 μmol/(m2·s) 到达峰值时的积累量为7.32 mg/L,但整体看来54 μmol/(m2·s)光照强度的蓝光是雨生红球藻中积累虾青素最适宜的混合光照强度。

