特基拉芽胞杆菌KXF 6501对猕猴桃灰霉病的防控效果及诱导果实抗性研究
李绕勇,董奎奎,杨 阔,施秀梅,王梅琳,邓 佳,3,王 芳,2*
(1.西南林业大学林学院,昆明 650224;2.西南林业大学/西南地区生物多样性保育国家林业和草原局重点实验室,昆明 650224;3.西南林业大学/西南山地森林资源保育与利用教育部重点实验室,昆明 650224)
猕猴桃ActinidiachinensisPlanch.是猕猴桃科Actinidiaceae 猕猴桃属Actinidia的多年生落叶植物[1],果实营养丰富,富含维生素和多种矿质元素及氨基酸,风味较好且与大部分水果相比,Vc 含量高,是天然营养物质元素来源之一[2-4]。中国是世界猕猴桃生产大国之一,然而,由于采后猕猴桃发生的软腐病、青霉病、炭疽病及灰霉病等病害造成巨大的经济损失[5],其中由灰霉菌潜伏侵染而导致的腐烂造成的危害最为严重,腐烂率高达30%[6,7]。目前,对于猕猴桃采后贮藏保鲜技术仍以化学保鲜为主,但化学药剂长期使用引起果蔬采后病害病原菌产生抗药性,进而降低其防腐效果;另一方面产生的大量农药残留会引起食品安全和环境污染等问题[8,9]。因此,寻求安全高效的贮藏保鲜技术对果蔬的采后保鲜和人体健康有着重要的意义。拮抗微生物的生物防治技术以其高效、无农药残留且易降解等特点,逐渐成为当前水果保鲜领域中的研究热点[10,11]
已有研究表明,特基拉芽胞杆菌Bacillustequilensis对多种植物病原菌具有广谱抗性。特基拉芽胞杆菌通过产生生物表面活性剂或脂肽等多种不同的抗菌物质来抑制植物病原菌的生长,而且还能诱导植物产生抗性[12,13]。郗良卿等[14]研究发现特基拉芽胞杆菌X-16 发酵液和发酵上清液对甜樱桃褐腐病菌具有较好抑制效果,抑制率分别达到71.93%和67.14%。特基拉芽胞杆菌XT1-4 菌株对引起马铃薯黄萎病的大丽轮枝菌Verticilliumdlboatrum和黑白轮枝菌Verticilliumdahliae,防治效果均达到了 60%以上[15]。特基拉芽胞杆菌D5-8 对烟草寄生疫霉的保护防效达60%以上,治疗防效达50%以上[13]。此外,特基拉芽胞杆菌7PJ-16菌株培养96 h 的发酵滤液对核盘菌Sclerotiniasclerotiorum、桑葚核地杖菌Scleromitrulashiraiana、纹枯病菌Thanatephoruscucumeris等10 种常见供试植物病原菌具有不同程度的抑制作用[16]。芽胞杆菌不仅可以抑制植物病原菌生长,还可以通过诱导植物自身抗性而增强植物的抗病能力[17]。其中,诱导植物产生抗性反应在生理生化方面主要是通过调控植物次生代谢产物及相关酶的催化活动来实现[18,19]。如地衣芽胞杆菌POT1 能诱导马铃薯酚类、黄酮类和花青素的合成增强自身抗病能力[20]。特基拉芽胞杆菌JN-369 诱导提高了水稻的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗病防御酶活性,从而抵抗水稻稻瘟病的侵染[21]。复合接种特基拉芽胞杆菌PKDN31 和地衣芽胞杆菌PKDL10 可以通过增加防御酶,如β-1,3 葡聚糖酶(GLU)、多酚氧化酶(PPO)、过氧化物酶(POD)、苯丙氨酸解氨酶(PAL)、几丁质酶(CHI)和总酚的积累诱导番茄对尖孢镰刀菌的系统抗性[22]。本研究以前期分离自草莓果实表面对灰霉菌有较好抑菌效果的特基拉芽胞杆菌KXF 6501 作为供试菌株,通过体外平板对峙及猕猴桃果实接种试验研究了其不同培养时间发酵液对猕猴桃灰霉病的控制作用,在此基础上探究了其发酵液处理对猕猴桃果实的诱导抗病机制及果实品质的影响,以期为阐释特基拉芽胞杆菌抑制猕猴桃采后灰霉病的作用机制提供理论支撑。
1 材料与方法
1.1 试验材料
1.1.1 果实 “红阳猕猴桃”购于昆明市金马寺批发市场。选取无损伤、质量在100~120 g、无病虫害、成熟度一致的果实。
1.1.2 试验菌株 特基拉芽胞杆菌B.tequilensisKXF 6501,分离自健康草莓果实表面,后保存于西南林业大学生物多样性保育国家林业和草原局重点实验室。将其活化后,利用NA(牛肉膏3 g,蛋白胨10 g,NaCl 5 g)液体培养基于28 ℃、120 r/min 振荡培养。
灰霉菌B.cinerea(BC),引起灰霉病,为本实验室前期从贮藏蓝莓发病果实分离获得,且可以侵染猕猴桃果实致病的菌株,将其用PDA(土豆200 g,蔗糖20 g,琼脂粉15 g)培养基,置于25 ℃条件下进行培养5 d,待病原菌产孢后用无菌水配成104CFU/mL 的孢子悬浮液备用。
1.2 KXF 6501 生长曲线的测定
将活化后的芽胞杆菌KXF 6501,接种到NA 液体培养基于28 ℃、120 r/min 振荡培养24 h 后,调整浓度为1×107CFU/mL,取100 μL 至盛有250 mL NA 液体培养基的锥形瓶中摇匀,在28 ℃、120 r/min的条件下进行培养,分别于第2、4、6、12、24、48、72、96、120 和144 h 取样,采用平板菌落计数法测定其活菌菌落数,以菌落数的对数值为纵坐标,培养时间为横坐标,绘制菌株KXF 6501 生长曲线图,试验重复2 次。
1.3 KXF 6501 发酵液对灰霉菌的抑菌能力测定
根据芽胞杆菌KXF 6501 生长曲线,选取进入稳定生长期前期和末期的发酵液(该时期发酵液较稳定),即24 和96 h 的发酵液,采用平板对峙法[13]测定KXF 6501 培养时间发酵液的抑菌活性。25 ℃条件下培养灰霉菌5 d 后,用直径5 mm 的打孔器取菌落边缘的菌丝块备用。在PDA 培养基中央接种灰霉菌菌丝块,然后在距离培养皿中央3 cm 处的4 个无菌滤纸片上分别接种发酵液5 μL(浓度为1×107CFU/mL),以无菌水处理作为对照,置于培养箱中,25 ℃培养至对照组病原菌长满整个培养皿,用十字交叉法测量病原菌的直径,每个处理3 个重复。抑菌率(%)=(对照组病菌直径—处理组病菌直径)/对照组病菌直径×100。
1.4 KXF 6501 发酵液对猕猴桃抗灰霉病的效果测定
对果实进行处理,处理方法参照马电通等[23]的操作方法,略作修改,即将猕猴桃果实用75%酒精表面消毒后用蒸馏水清洗,自然晾干后分成3 组,在每个果实水平赤道的对称位置用已消毒的打孔钉打2 个孔(直径4 mm,深5 mm),待伤口晾干后,分别加入15 μL 如下溶液: ① KXF 6501 24 h 发酵液(浓度为1×107CFU/mL);② KXF 6501 96 h 发酵液(浓度为1×107CFU/mL);接种2 h 后,分别向每个孔中加入15 μL 1×104CFU/mL 灰霉菌孢子悬液,以仅接种灰霉菌孢子悬浮液的果实作为对照,完成接种后置于塑料盒中室温放置保存(22 ℃,80%~90%相对湿度)。于处理后的第1 d 开始,每天观察其发病情况,并统计发病率及病斑直径,每个处理分别为10 个果实,3 个重复,共90 个果实。
发病率(%)=果实发病孔数/果实接种总孔数×100。
果实病斑直径(cm):采用十字交叉法测量果实的病斑大小。
1.5 KXF 6501 诱导猕猴桃果实抗性生理变化
将猕猴桃果实用75%酒精表面消毒后用蒸馏水清洗,自然晾干分为两组,每组15 个果实,分别在无菌水、KXF 6501 24 h 发酵液中浸泡3 min 后自然晾干,放置于塑料盒中,室温条件下保存(22 ℃、80%~90%相对湿度),于处理后第0、7、14、21、28 d 每组随机取3 个猕猴桃果实样品,标记后,在-80 ℃条件下进行保存,用于测定相关抗性物质含量及抗性防御酶活性。
抗性物质的测定:总酚、类黄酮和花青素的测定参照曹建康等[24]的方法,取0.5 g 果实组织于研钵(高温灭菌、-20 ℃冷冻)中,加入少量预冷的1% HCl-CH3OH 溶液,研磨,后转移到刻度试管后定容至20 mL,于4 ℃避光提取20 min,过滤后取滤液分别于280、325、530、600 nm 处测定滤液吸光度,总酚、类黄酮和花青素的测定结果以吸光度值表示,单位分别为OD280/g FW、OD325/g FW、OD(530-600)/g FW。
抗性防御酶活性测定:苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、多酚氧化酶((polyphenol oxidase,PPO)、几丁质酶(chitinase,CHI)、β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)利用苏州研犀生物有限公司的试剂盒进行测定,取0.1 g 猕猴桃果实组织加入提取液在冰上研磨至匀浆,提取粗酶液,按照试剂盒步骤加入试剂后测定并计算上述酶活,单位为U/g FW。
1.6 KXF 6501 发酵液处理对果实品质的影响
果实处理及取样时间同方法1.2.4,测定果实品质相关指标,失重率用称质量法[24]测定,单位为%;可溶性固形物含量(SSC)采用手持式折光仪日本(AT-AGO 公司)直接测定,单位为%;可滴定酸含量(TA)采用NaOH 滴定法[24]测定,以质量分数(%)表示;抗坏血酸采用 2,6-二氯酚靛酚滴定法[24]进行测定,以质量分数(%)表示;还原糖含量采用3,5-二硝基水杨酸法测定[24],以质量分数(%)表示,以上果实营养品质测定均参考曹建康等[24]的方法进行测定。
1.7 数据统计与分析
使用Excel 2016 软件对数据进行处理,采用SPSS 22.0 软件进行单因素方差分析、独立样本T 检验及Duncan 多重比较分析,当P<0.05 时为显著性差异,利用Origin 2019 软件进行制图。
2 结果与分析
2.1 KXF 6501 生长曲线的测定
芽胞杆菌KXF 6501 的生长符合微生物的生长规律,其2~24 h 为对数生长期,24~96 h 为稳定生长期,96~144 h 为衰亡生长期,24 h 进入稳定期后,其菌体数量达到108CFU/mL(图1)。
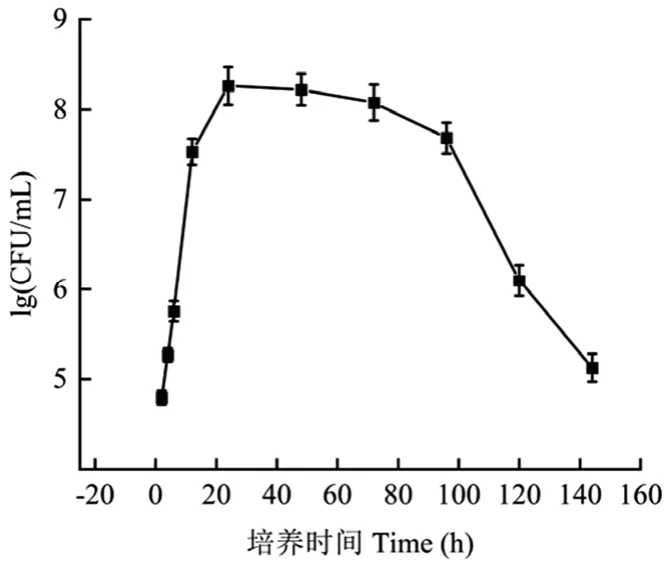
图1 芽胞杆菌KXF 6501 生长曲线Fig.1 Growth curve of B.tequilensis KXF 6501
2.2 KXF 6501 发酵液对灰霉菌的抑菌能力测定
KXF 6501 不同培养时间的发酵液均能抑制灰霉菌的生长,且其抑菌率均随着培养时间的延长而增加,但24 h 发酵液的抑菌率在整个培养周期均高于96 h 的发酵液(图2,3),且在培养前期(第2 d,第3 d)达到显著水平;第5 d 时,24 与96 h 发酵液对灰霉菌的抑菌率分别为75.96%和73.72%(图3)。

图2 KXF 6501 24 与96 h 发酵液对灰霉菌的抑制效果Fig.2 Inhibition effect of KXF 6501 24 and 96 h fermentation broth on gray mold

图3 KXF 6501 24 h 与96 h 发酵液对灰霉菌的抑菌率Fig.3 Inhibition rate of KXF 6501 24 h and 96 h fermentation broth on gray mold
2.3 KXF 6501 发酵液对猕猴桃抗灰霉病的效果测定
如表1 和图4 所示,KXF 6501 24 h 发酵液与96 h 发酵液在猕猴桃果实上,对灰霉病均有不同程度的抑制作用。24 h 发酵液处理4 d 后的发病率为65.00%,低于96 h 发酵液的发病率70.00%,二者均显著低于对照处理(P<0.05)。随着贮藏时间的延长,24 h 发酵液和96 h 发酵液对猕猴桃果实病斑直径的扩大均有不同程度的抑制作用。贮藏7~11 d,24 h 发酵液处理的猕猴桃果实灰霉病病斑直径显著(P<0.05)低于对照组,但96 h 发酵液处理的果实病斑直径与对照组无显著差异。

表1 KXF 6501 发酵液对采后猕猴桃灰霉病的抑制效果Table 1 Inhibition effect of KXF 6501 fermentation broth on gray mold of postharvest kiwifruit

图4 KXF 6501 发酵液处理第7 d 时对采后猕猴桃灰霉病的抑制效果Fig.4 Inhibition effect of KXF 6501 fermentation broth on grey mold of postharvest kiwifruit on day 7
2.4 特基拉芽胞杆菌KXF 6501 诱导猕猴桃果实抗性生理变化
2.4.1 果实抗性物质含量变化 从图5 可以看出,贮藏过程中,对照组果实总酚、类黄酮和花青素的含量变化趋势相似,呈缓慢上升,于第21 d 达到峰值,之后略有下降。KXF 6501 24 h 发酵液处理后,果实总酚、类黄酮、花青素的含量迅速上升,于第7 d 达到峰值,显著高于对照组,其含量分别为2.38 OD280/g、1.26 OD325/g、0.20 OD(530-600)/g,是对照组的1.96、4.07 和5.29 倍,之后迅速下降至最低值(第14 d),随后持续上升。
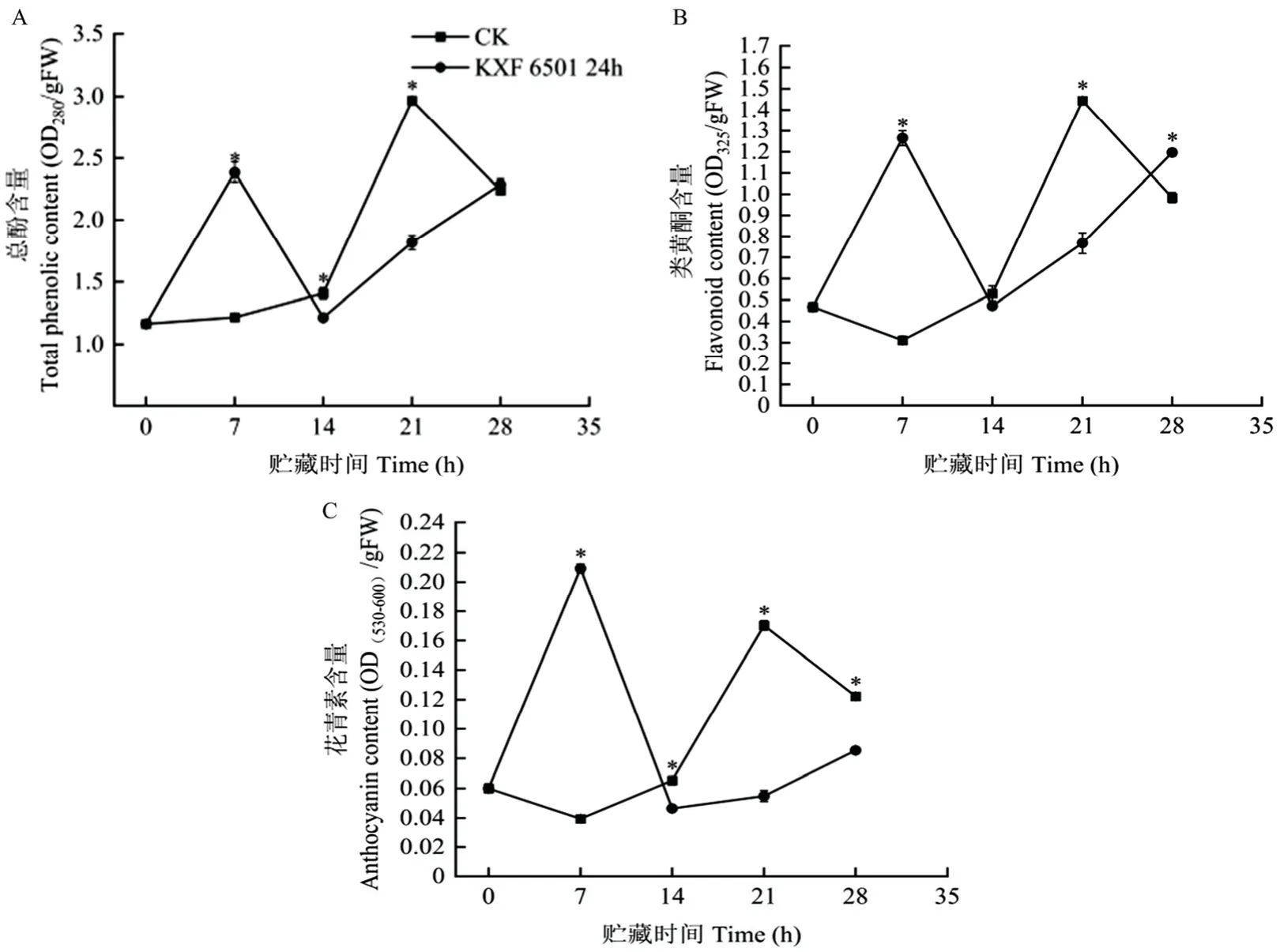
图5 KXF 6501 发酵液处理对采后猕猴桃果实总酚(A)、类黄酮(B)、花青素(C)含量的影响Fig.5 Effect of KXF 6501 fermentation broth on the content of total phenols (A), flavonoids (B) and anthocyanins (C) in postharvest kiwifruit
2.4.2 果实抗病酶活性变化 如图6A 所示,在整个贮藏期间,PAL 的活性呈现先上升后下降的趋势,处理组酶活性在贮藏前7 d 呈上升趋势,在第7 d 时酶活性达到最大,为95.04 U/g,是对照组的2.40 倍,且其活性于7~21 d 高于对照组,在7~14 d 达到显著(P<0.05)水平,之后呈波动下降趋势。

图6 KXF 6501 24 h 发酵液处理对采后猕猴桃PAL(A)、PPO(B)、CHI(C)、GLU(D)活性的影响Fig.6 Effect of KXF 6501 24 h fermentation broth on the activities of PAL (A), PPO (B), CHI (C) and GLU (D) in postharvest kiwifruit
由图6B 可知,在整个贮藏期间,处理组和对照组的PPO 活性呈现先上升后下降的趋势,下降幅度小于对照组,且仅在贮藏第28 d 时,处理组酶活是对照组的3.35 倍,为116.58 U/g,显著(P<0.05)高于对照组。
如图6C 所示,在整个贮藏期间,CHI 活性在前期的变化不大,然后呈上升后下降的趋势,处理酶活性在第7 d 急剧上升,在第14 d 达到峰值,活性为8.41 U/g,与对照相比,酶活性增加了1.15 倍,显著(P<0.05)高于对照组。
如图6D 所示,在整个贮藏期间,处理组GLU 活性总体变化趋势呈先上升后下降然后逐渐回升的趋势,且GLU 酶活性于第14 和28 d 显著(P<0.05)高于对照组,活性分别为163.88 和240.19 U/g,分别是对照组的1.57 和2.03 倍。
2.5 KXF 6501 发酵液处理对果实品质的影响
随着贮藏时间的延长,猕猴桃果实的失重率逐渐升高,KXF 6501 24 h 发酵液处理组果实失重相对较慢,显著(P<0.05)低于对照组(图7);猕猴桃果实在贮藏28 d 时,KXF 6501 24 h 发酵液处理组果实可溶性固形物含量为15.13%,显著低于对照组;处理组和对照组的可滴定酸和抗坏血酸含量无显著差异。表明KXF 6501 发酵液处理有效延缓果实失水,保持果实营养品质(表3)。

表3 KXF 6501 24 h 发酵液处理对采后猕猴桃果实品质的影响Table 3 Effect of KXF 6501 24 h fermentation broth on fruit quality of postharvest kiwifruit
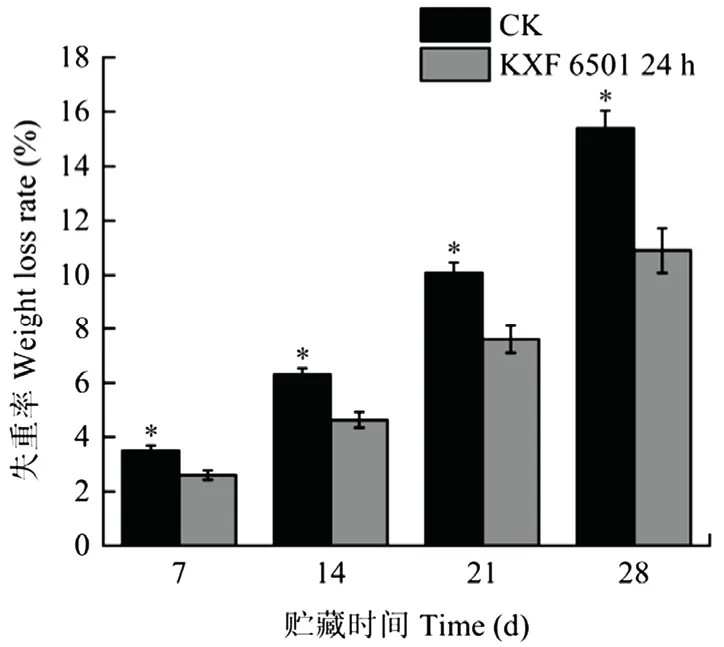
图7 KXF 6501 24 h 发酵液处理对采后猕猴桃失重率的影响Fig.7 Effect of KXF 6501 24 h fermentation broth on weight loss of postharvest kiwifruit
3 讨论
近年来,越来越多的芽胞杆菌作为生防因子应用于果蔬采后病害防治研究中,如解淀粉芽胞杆菌、枯草芽胞杆菌、地衣芽胞杆菌和特基拉芽胞杆菌等[8,25]。赵焕兰等[26]利用贝莱斯芽胞杆菌A4 发酵液浸泡樱桃番茄后,果实贮藏期间的腐烂率降低,表明该菌的发酵液处理可以提高樱桃番茄采后保鲜。本研究发现芽胞杆菌KXF 6501 24 和96 h 发酵液对灰霉病菌的菌丝生长菌具有较强的抑制作用,同时也能很好的控制猕猴桃果实灰霉病的发生,其中以24 h 的发酵液效果更佳,这可能是24 h发酵液的中的菌体处于对数期前期活力较强,相对于灰霉菌更具有空间和营养竞争优势,能够有效抑制灰霉病的入侵和繁殖。但KXF 6501 24 和96 h 发酵液中的抑菌活性成分是否存在差异,有待后续进一步深入研究。
当植物受到生防菌诱导或病原体侵染时,会启动与抗病相关的防御机制来抵抗病原菌的影响[27,28]。PAL、PPO、SOD 和POD 是植物体内与抵制病原微生物侵染相关的重要酶,酶活性升高是诱导抗性产生的重要指标之一[18]。PAL 是与苯丙烷代谢相关的途径中的第一种酶,它参与抗病物质的生物合成,如酚类物质和木质素等[29]。植物在受到生防因子诱导后,其体内PAL 活性上升及相应抗性物质含量会增加。本研究发现特基拉芽胞杆菌KXF 6501 24 h 发酵液处理组的PAL 酶活性高于对照处理且先于对照组达到峰值,总酚、类黄酮和花青素的峰值到达时间也得到进一步提前。陈刘军等[30]研究发现蜡质芽胞杆菌AR156也能通过诱导水稻体内的PAL 酶活力提高,来增强植物本身的抗病能力,这与本研究结果相一致。PPO可以催化产生木质素和酚类氧化产物来构成保护性屏障,抵御病原体的入侵,同时还可以催化酚类物质氧化形成高毒性的醌类物质,直接作用于病原菌[31]。本研究中,KXF 6501 24 h 发酵液处理诱导猕猴桃果实中的PPO 酶活性升高,在14 d 后高于对照组,之后减缓酶活性下降,有效提高了果实的抗病性。CHI 和GLU 可水解病原菌细胞壁结构的几丁质和葡聚糖,破坏其细胞壁来消灭病原菌,同时二者常共同作用,协同表达来增强植物的抗病性[32-34]。本研究结果表明,KXF 6501 24 h 发酵液处理显著提高猕猴桃果实体内CHI 和GLU 酶活性,增强其抵抗灰霉病的能力。柴庆凯等[35]报道,施用解淀粉芽胞杆菌LJ02 可以诱导黄瓜CHI 和GLU 酶活,提高了其抵抗灰霉病侵染的能力。唐文等[18]利用枯草芽胞杆菌Czk1 发酵液对橡胶树进行处理,发现其诱导了橡胶树叶片中CAT、SOD、POD、PAL 和PPO 等防御酶活性提高。因此,酶活性的提高在猕猴桃抵御病原侵染中发挥了重要作用,是芽胞杆菌KXF 6501 控制猕猴桃采后病害的重要机制之一。
本研究的结果表明,特基拉芽胞杆菌KXF 6501 可以很好的控制猕猴桃采后灰霉病,保持果实品质,诱导提高果实的抗病酶活和抗病物质含量,具有开发为生防制剂的潜力。但后续还需要进一步分析其发酵液中的抑菌活性物质及其生防作用机制,为其在将来的大规模生产应用和菌剂开发中发挥稳定防效提供理论基础和技术支撑。

