苜蓿源miR168b 跨界调控奶牛体内乳脂相关靶基因的筛选
贾晶莹,刘宝宝,马云,段红娟,蔡小艳*
(1. 宁夏大学农学院,宁夏 银川 750021;2. 宁夏回族自治区反刍动物分子细胞育种重点实验室,宁夏 银川 750021)
microRNA(miRNA)是一类内源性非编码单链RNA 分子,长度一般为18~25 nt[1-2]。miRNA 通过靶向内源性基因在动植物生命过程中发挥重要调节作用,例如调节植物抗逆性,调节细胞生长状态,参与免疫应答、进行母婴调节等,此外,miRNA 还可以作为疾病诊断的标记因子[3-9]。越来越多的研究表明,miRNA 不仅可以靶向生物体内源性基因,还可以跨界调节其他物种体内的生物过程。经典的跨界调控有水稻(Oryza sativa)来源的miR168 通过靶向小鼠肝脏内的低密度脂蛋白受体衔接蛋白(LDLRAP1)减缓血液中低密度脂蛋白的清除[10];金银花(Lonicera japonica)水煎液中的miR2911 抑制流感病毒的复制,降低H1N1、H5N1 以及H7N9 病毒的死亡率,加速SARS-CoV-2 感染患者的阴性转化[11-13];大豆(Glycine max)来源的miR159a 能够通过抑制GSK-3β 介导的NF-κB 和TGF-β1 途径预防肝纤维化[14-15]。
苜蓿(Medicago sativa)作为“牧草之王”,含有较高的蛋白质、均衡的氨基酸配比,丰富的矿物质元素及微生物活性成分[16]。早在2012 年,我国就实施了“振兴奶业苜蓿发展行动”,提倡给奶牛饲喂优质牧草苜蓿,以提高牛奶乳蛋白率和乳脂率。已有研究表明,均衡日粮条件下,适当增加反刍动物苜蓿采食量,不仅可以增加牛、羊的日增重,还能够显著增加羊羔体内多不饱和脂肪酸和共轭亚油酸的含量,提高牛奶产量,增加牛奶中乳蛋白率、乳脂率和乳糖率[17-20]。在饲草维持动物健康和高效生产的研究中,关注点往往集中于饲草中传统的营养素对动物的作用,植物源miRNA 对动物作用的研究较少。确定苜蓿来源的miRNA 对奶牛的跨界调控作用,为探究奶牛日粮的均衡配比提供了分子层面的支撑,对动物分子营养与饲料研究具有重要意义。
课题组前期试验已经筛选出在中苜1 号和新盐52 号两种苜蓿中差异表达的mtr-novel-miR54、mtr-miR156f,以及在两种苜蓿中高表达的mtr-miR166a,并且通过高通量测序手段检测了上述miRNA 在奶牛体内的确存在。本研究基于对苜蓿源miRNA 影响牛奶品质问题的思考与前期试验结果的分析,筛选了高乳脂奶牛和低乳脂奶牛中差异表达的苜蓿源miRNA,并对其进行了靶基因预测分析与验证,以期为后续研究苜蓿源miRNA 靶向奶牛内源性基因进而调控牛奶乳脂率筛选具有参考性的靶基因。
1 材料与方法
1.1 试验材料
1.1.1 奶牛血液与牛奶采集 试验材料为高乳脂和低乳脂荷斯坦奶牛的牛奶和血液,于2021 年12 月采自宁夏农垦贺兰山奶业,采集奶牛全部为生产4 胎的奶牛,产犊间隔340~381 d,泌乳天数108~187 d,采样牛编号为0001~0006,基本信息见表1。试验牛饲喂相同的平衡全混合日粮(表2)。筛选体细胞数在20 万个·mL-1以内,高乳脂组奶牛(high milk fat,HF)乳脂率>4.2%,低乳脂组奶牛(low milk fat,LF)乳脂率<3.5%,每组选择3 头奶牛进行试验。

表1 采样牛基本信息Table 1 Basic information of sampling cattle

表2 日粮组成及营养水平(干物质基础)Table 2 The dietary composition and nutrient level (DM basis)
尾静脉采血法直接将奶牛血液采集于含有抗凝剂的真空采血管内。同一奶牛每天早、中、晚采集3 个时间点的牛奶,按4∶3∶3 比例混匀。将血液和牛奶低温运送回实验室,血液置于-20 ℃冰箱保存,牛奶置于-80 ℃冰箱保存,备用。
1.1.2 细胞 奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMEC)和HEK-293T 细胞来自宁夏大学反刍动物分子细胞育种重点实验室前期保存。
1.1.3 主要试剂 Trizol 试剂、反转录试剂盒、荧光定量试剂盒由Takara 公司(大连)提供。DMEM/F 12 培养基购于Hyclone 公司,胎牛血清(FBS)购于BI 公司。双荧光素酶报告靶基因试剂盒购买自promega(货号:E1910)公司。mtr-miR168b mimics 与NC 序列委托广州锐博生物公司合成。
1.1.4 主要仪器 多功能酶标仪(SYNERGY/LX,美国)、普通PCR 仪(T100,美国)和实时荧光定量PCR 仪(CFX 96 Touch,美国)均为Bio-Rad 公司产品。
1.2 试验方法
1.2.1 牛奶DHI 检测 混匀的奶牛牛奶委托宁夏农牧厅DHI 测定中心进行奶牛生产性能测定(dairy herd improvement,DHI),具体检测指标包括乳脂肪、乳蛋白、乳糖、总固形物以及尿素氮含量等。
1.2.2 牛奶和血液中总RNA 提取与反转录 利用Trizol 试剂盒对样品进行总RNA 提取。使用多功能酶标仪测定总RNA 浓度,利用2%琼脂糖凝胶电泳检测总RNA 质量及完整性。按照反转录试剂盒说明书将提取的总RNA 反转成cDNA,保存于-20 ℃冰箱,备用。
1.2.3 氧化试验 在10 μL 提取的牛血RNA 样品中,加入10 mmol·L-1高碘酸钠进行混合,-20 ℃氧化40 min 后离心,加入1 mL 无水乙醇对沉淀进行重悬,将悬液置于-20 ℃孵育过夜后再次离心,弃去上清液后加入20 μL 无酶水溶解沉淀,对氧化后的RNA 溶液中mtr-miR168b 和bta-miR-16a 进行定量,验证植物源miRNA。
1.2.4 实时荧光定量PCR(RT-qPCR)测定miRNAs 表达量 除了前期试验结果筛选的mtr-novel-miR54、mtr-miR156f 和mtr-miR166a 外。本研究还选择了已有跨界调控功能的植物源miR168 家族的mtr-miR168b 和mtr-miR168c-3p 两个miRNAs。将上述5 个苜蓿源miRNAs 在奶牛血液和牛奶中的表达量进行实时荧光定量检测。
根据成熟miRNAs 序列设计引物,试验所需引物使用Primer 5.0 软件进行设计(表3),由通用生物系统(安徽)有限公司合成。以U6 作为内参进行RT-qPCR,反应体系为预混液 TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)10 μL,上下游引物各0.4 μL,DNA 样品(100 ng·μL-1)2 μL,加入ddH2O 将反应体系补全至20 μL。反应程序如下:95 ℃,3 min;95 ℃,5 s;60 ℃,30 s;39 个循环,95 ℃,10 s。

表3 miRNAs 引物信息Table 3 Primer information of miRNAs
1.2.5 BMEC 转染mtr-miR168b BMEC 培养基为含有10%胎牛血清,100 μg·mL-1青霉素,100 μg·mL-1链霉素的基础DMEM/F12 培养基,在含5% CO2,37 ℃的恒温加湿培养箱中进行培养。在基础培养基的基础上添加5 μg·mL-1的胰岛素,5 μg·mL-1的氢化可的松和20 ng·mL-1的催乳素即为诱导培养基。待细胞生长至60%左右融合度时,根据Lipo3000 转染试剂说明书进行转染。细胞转染在6 孔板中进行,每个转染组设3 个重复,每孔加入50 nm mtr-miR168b mimics(mimics)或mtrmiR168b NC(NC),以NC 组为对照组,mimics 组为处理组进行成脂标志基因检测。48 h 后更换为诱导培养基,此时记为诱导0 d。诱导期间每2 d 更换1 次培养基,每4 d 收集细胞对细胞内成脂标志基因进行检测,所测基因引物使用Primer 5.0 软件进行设计(表4),由通用生物系统(安徽)有限公司合成。

表4 引物信息Table 4 Primer information
1.2.6 mtr-miR168b 在牛体内的靶基因预测及功能富集分析 根据miRNAs 靶基因预测软件TargetScan 提供的牛基因信息,与联川生物平台(https://www.omicstudio.cn/index)联合分析预测mtr-miR168b靶基因。对靶基因进行GO 和KEGG 通路富集分析,筛选出参与调控乳脂合成的相关信号通路的靶基因。使用RNAhybrid 进一步对靶基因进行筛选。运用Bgee 网站查找预测靶基因在牛组织内的表达分数。
1.2.7 实时荧光定量PCR(RT-qPCR)测定表达量 对筛选出的与乳脂相关的靶基因进行定量检测。将mtrmiR168b mimics 和mtr-miR168b NC 分别转染至BMEC,48 h 后收集细胞,对细胞中预测靶基因进行定量检测。试验所需引物由Primer 5.0 软件进行设计(表4),由通用生物系统(安徽)有限公司合成。以GAPDH作为内参进行RT-qPCR,反应体系同1.2.4。
1.2.8 双荧光素酶报告靶基因 根据STARD7和CPT1A的序列,使用Primer Premier 5 软件设计包含mtrmiR-168b 种子区在内的靶基因3' UTR 区引物(表4),并在引物5'端上分别添加Xho Ι 和Not Ι 的酶切位点和相应的保护碱基。目的片段经双酶切和纯化回收后,与psiCHECKTM-2 载体连接,构建STARD7和CPT1A与Psicheck-2 野生型(WT-CPT1A)载体。基因突变型载体(MUT-CPT1A)委托上海生工生物公司合成,酶切位点与载体同上。将mtr-miR168b mimics 和mtr-miR168b NC 分别与构建好的野生型和突变型载体共转染至HEK-293T 细胞,转染试剂为Lipo 3000,转染方法与说明书一致。转染48 h 后,按照双荧光素酶试剂盒说明书步骤收集细胞,对细胞的荧光素酶活性进行检测。
1.3 数据分析
实时荧光定量PCR 结果用 2-ΔΔCt进行处理,每组数据至少设置3 个生物学重复和3 个技术学重复。使用GraphPad Prism 7 软件的t检验对RT-qPCR 结果和双荧光结果作图并进行差异显著性分析,P<0.05 为差异显著(*),P<0.01 为差异极显著(**)。
2 结果与分析
2.1 血液和牛奶采集牛的选择
根据DHI 检测结果筛选出3 头高乳脂奶牛和3 头低乳脂奶牛,对牛进行重新编号方便后续试验。上述6 头奶牛各项指标见表5。其中,3 头高乳脂奶牛牛号分别为0001、0002 和0003,牛奶中脂肪含量>4.2%;3 头低乳脂奶牛牛号分别为0004、0005 和0006,牛奶中脂肪含量<3.5%。在此说明,高乳脂奶牛为采集样品中乳脂含量相对较高且稳定的3 头奶牛,并不代表牛场中牛奶乳脂含量的最高水平。

表5 基于DHI 检测的高乳脂与低乳脂奶牛的奶产量及奶品质Table 5 Milk yield and quality of high-fat and low-fat dairy cows based on DHI detection
2.2 血液和牛奶中苜蓿源miRNA 的筛选与验证
对前期筛选出的mtr-novel-miR54、mtr-miR156f、mtr-miR166a,以及mtr-miR168b 和mtr-miR168c-3p 共5 个苜蓿源miRNAs 在牛血液和牛奶中的表达量进行检测。结果发现,上述苜蓿源miRNAs 在高乳脂奶牛(HF)和低乳脂奶牛(LF)的血液(图1a)和牛奶(图2a)中均可检测到。
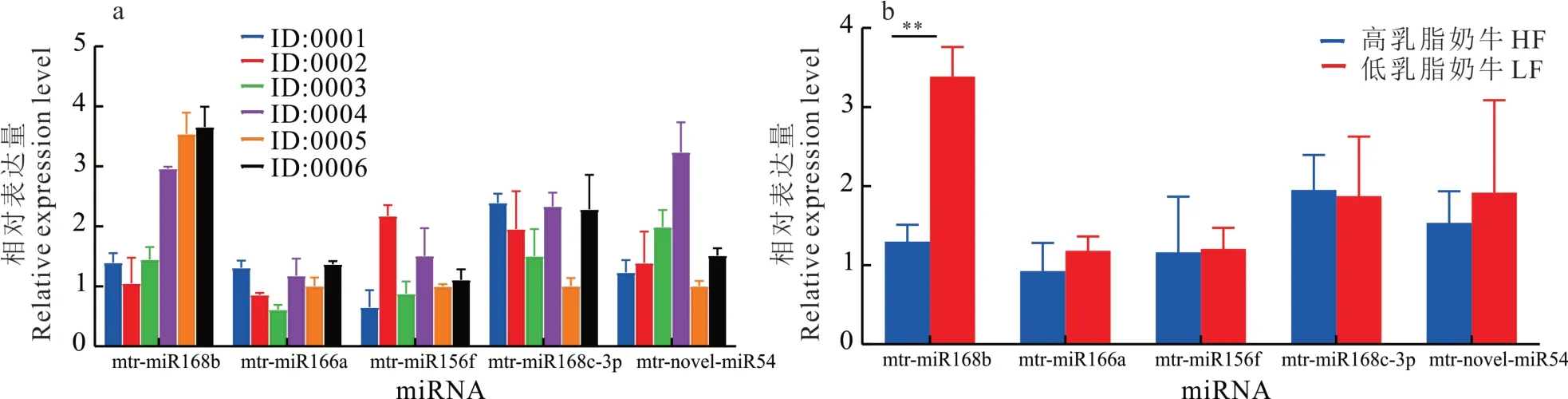
图1 苜蓿源miRNAs 在奶牛血液中相对表达量Fig.1 Relative expression level of alfalfa miRNAs in bovine blood
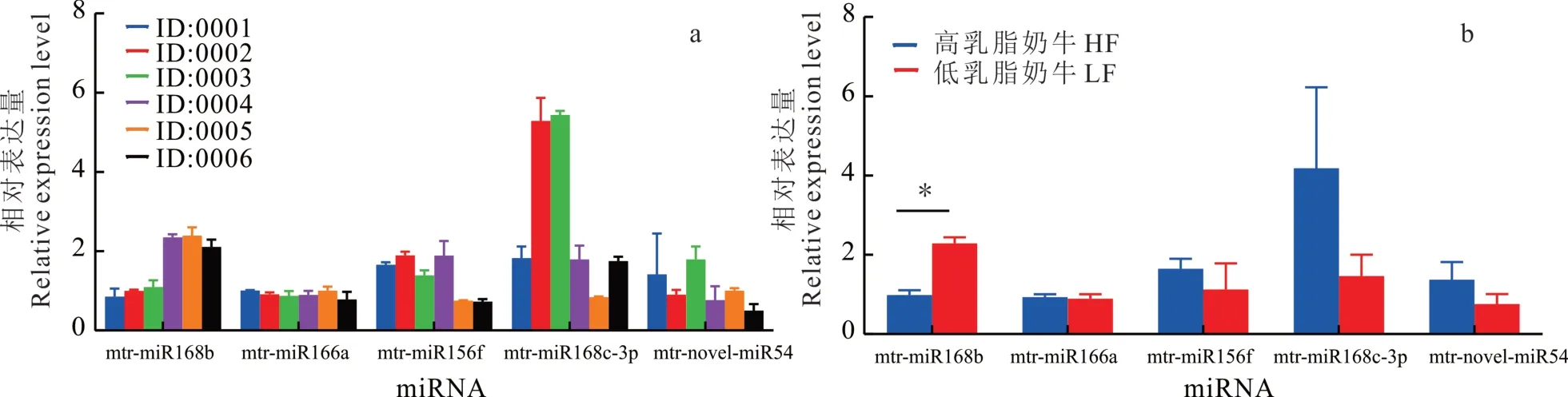
图2 苜蓿源miRNAs 在奶牛牛奶的相对表达量Fig.2 Relative expression level of alfalfa miRNAs in milk
在奶牛血液中,仅有mtr-miR168b 在低乳脂奶牛中的表达量极显著高于在高乳脂奶牛中的表达量(P<0.01;图1b)。在奶牛牛奶中,mtr-miR168b 在低乳脂奶牛中的表达量显著高于在高乳脂奶牛中的表达量(P<0.05;图2b)。氧化试验表明,与内源性bta-miR-16a 相比,植物源mtr-miR168b 在被氧化后的牛血液RNA 中仍具有较高的表达水平(图3),说明牛血液中的mtr-miR168b 来自植物,可以抵抗高碘酸钠的氧化。
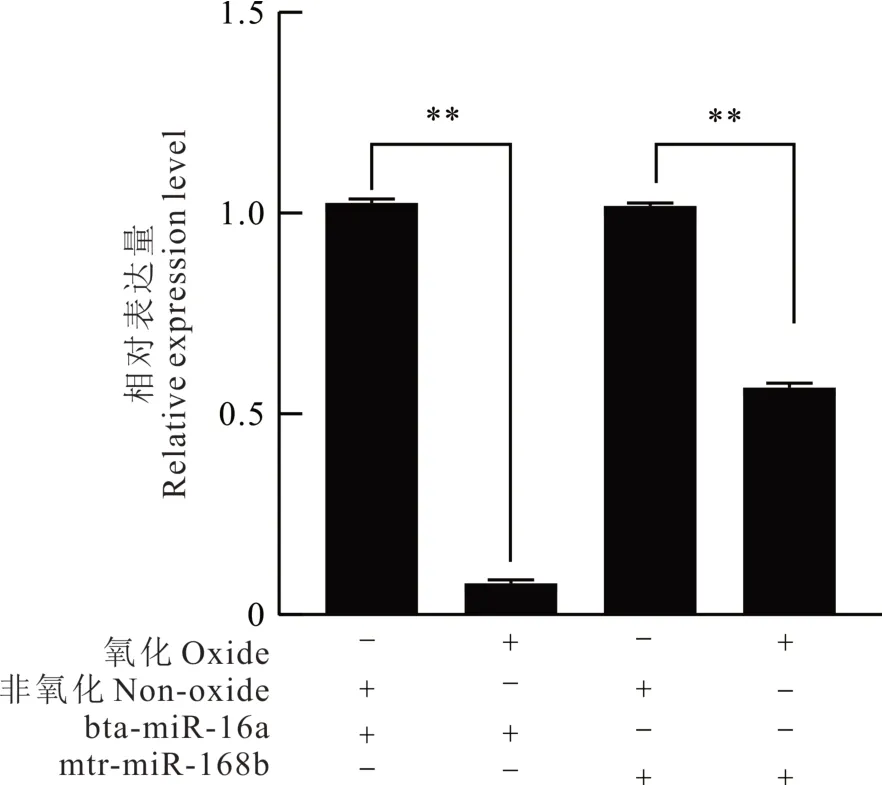
图3 氧化前后牛血液中内源性miRNA 与外源性miRNA 表达量检测Fig. 3 The expression levels of endogenous and exogenous miRNA in bovine blood before and after oxidation
定量结果显示,仅有mtr-miR168b 在高乳脂和低乳脂奶牛血液和牛奶中表达量稳定且有显著差异(P<0.05),并且氧化试验证实了miR168b 的确来自植物miRNA,故对mtr-miR168b 在奶牛体内的作用进行后续试验。
2.3 mtr-miR168b 过表达抑制BMEC 中脂代谢基因的表达
为验证mtr-miR168b 高表达对奶牛乳脂的影响,构建了mtr-miR168b mimics 处理后mtr-miR168b 在BMEC中不同诱导时间的相对表达量。发现诱导8 d 后,mtrmiR168b 的表达量仍极显著上调(P<0.01)(图4a)。脂代谢相关基因PPARγ、SCD1、CEBP/β和SREBP1的表达量在mimics 组被抑制,且抑制作用在诱导第4和8 天显著。说明mtr-miR168b 过表达抑制乳脂的合成,并且抑制作用随着时间的推移而增加(图4)。

图4 mtr-miR168b 高表达抑制奶牛BMEC 乳脂的合成Fig.4 High expression of mtr-miR168b inhibits the synthesis of milk fat in cow mammary epithelial cells
2.4 mtr-miR168b 靶基因GO 功能富集分析
通过TargetScan 和RNAhybrid 预测得到的mtrmiR168b 靶基因中,有1834 条靶基因与GO 数据库比对成功。将预测到的靶基因进行GO 功能富集分析(图5),结果显示:注释到生物过程层面显著富集的功能或代谢路径为转录调节,DNA-模板、氧化还原过程和半桥粒组装,分别有14、11 和10 条靶基因富集到上述功能。注释到细胞成分层面显著富集的功能或代谢路径为细胞质、细胞核和膜的整体成分,分别有41、34 和34 条靶基因富集。注释到分子功能层面显著富集的功能条目为ATP 结合、锌离子结合和肌动蛋白结合,分别有19、18 和14 条靶基因富集。
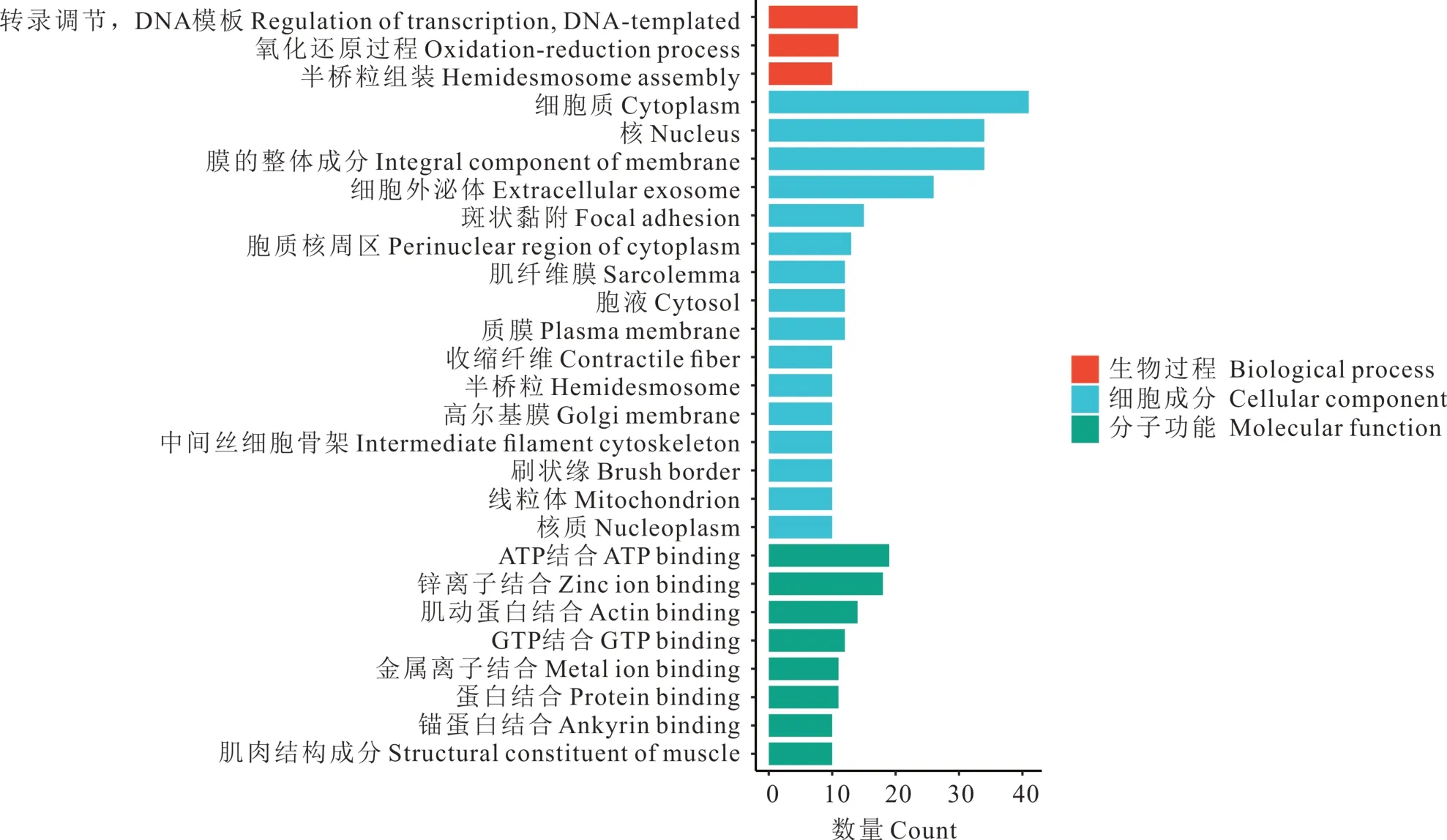
图5 mtr-miR168b 在牛体内靶基因GO 功能富集分析Fig.5 Enrichment analysis of mtr-miR168b target gene GO function in cattle
2.5 mtr-miR168b 靶基因KEGG 功能富集分析
预测得到的mtr-miR168b 靶基因中,有296 条靶基因与KEGG 数据库比对成功,获得注释。KEGG 的注释结果按照KEGG 通路类型进行分类,得到靶基因KEGG 通路类型分类图(图6)。对mtr-miR168b 的靶基因进行Pathway 富集分析,结果发现,在靶基因注释到的全部KEGG 通路中,N-聚糖生物合成(3.72%)、cGMP-PKG(环磷酸鸟苷酸-依赖性蛋白激酶)信号通路(2.37%)和血管平滑肌收缩(2.37%)为富集最显著的信号通路。另外,甘油磷脂代谢(1.69%)通路也被显著富集。

图6 mtr-miR168b 在牛体内靶基因KEGG 通路富集分析Fig.6 Enrichment analysis of mtr-miR168b target gene KEGG function in cow
2.6 脂代谢相关靶基因筛选
通过靶基因预测分析,得到部分与脂肪代谢相关的靶基因与信号通路,如SERINC1、CPT1A和STARD7等。通过网站查询预测靶基因在牛奶、乳腺以及乳腺脂肪内的表达评分。表达评分高,证明该基因在特定组织表达丰度高,具有更明显的调控作用。由表6 可知,SERINC1、CPT1A和STARD7在牛奶和乳腺脂肪中的表达评分均高于80,而CLN8和CPTP在牛奶中的表达评分较低。SERINC1与磷脂生物合成和鞘脂代谢过程相关;STARD7参与脂质代谢信号通路、甘油磷脂合成以及磷脂代谢信号通路;CPT1A参与脂肪酸β 氧化信号通路、AMPK 信号通路以及PPAR-α 信号通路。上述预测到的3 个mtr-miR168b 靶基因在牛奶和乳腺脂肪中具有较高的表达评分,且均参与脂质代谢相关信号通路,可作为载体构建的首选靶基因。

表6 mtr-miR168b 脂质代谢靶基因与组织表达评分Table 6 mtr-miR168b lipid metabolism target gene and tissue expression score
2.7 实时荧光定量检测靶基因
将mtr-miR168b mimics 和NC 分别转染到BMEC 中,对上述结果中筛选出来的SERINC1、CPT1A和STARD7进行实时荧光定量。结果表明,CPT1A和STARD7mimics 组中基因表达量与NC 组相比均有显著下调趋势(P<0.01),这为mtr-miR168b 与CPT1A和STARD7靶向关系提供了进一步佐证(图7)。
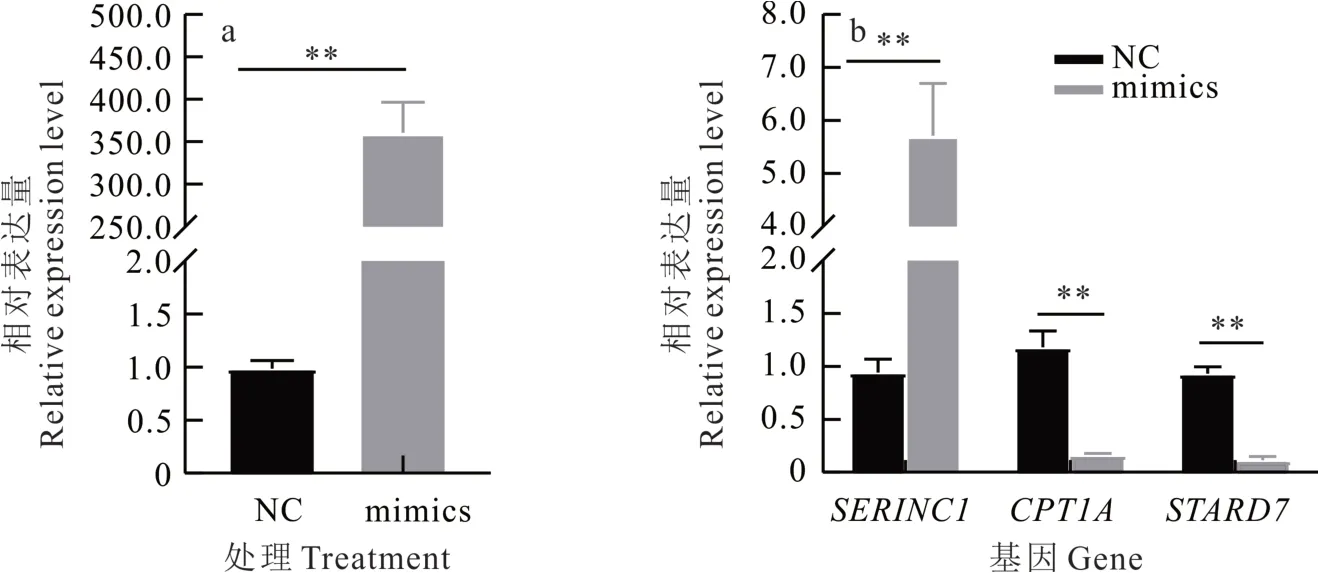
图7 转染后乳腺上皮细胞预测靶基因表达量Fig.7 Predicting target gene expression level of breast epithelial cells after transfection
2.8 双荧光素酶报告验证mtr-miR168b 和CPT1A 基因靶向关系
构建了CPT1A和STARD73' UTR-psiCHECKTM-2 重组双荧光素酶报告基因载体。将靶基因质粒与mtrmiR168b mimics 或NC 共转染293T 细胞48 h 后进行荧光素酶活性检测,结果显示:WT-STARD7+mtr-miR168b mimics 组较WT-STARD7+mtr-miR168b NC 组荧光素酶活性显著下降(P<0.01)。MUT-STARD7+mtrmiR168b mimics 组与MUT-STARD7+mtr-miR168b NC 组荧光素酶活性差异无统计学意义(图8),CPT1A与STARD7荧光结果趋势一致。这证明mtr-miR168b 与STARD7和CPT1A基因均具有靶向关系。

图8 相对荧光素酶活性Fig.8 Relative luciferase activity
3 讨论
多种植物或中草药已经被广泛应用于畜禽饲料,用以提高养殖水平,改善肉品质。已有报道称,给猪灌喂或者让其自由采食玉米(Zea mays),均可以在猪的脂肪和肌肉中检测到丰富的玉米源miRNAs[21-22]。黎梦等[23]研究表明,给小鼠灌服植物源miRNAs 导致小鼠肌肉脂代谢比例显著增加,附睾脂肪沉积显著减少。此外,植物miR167e-5p,干燥坚果中的miR159a 和miR156c 也被确定可以通过靶向动物体内源性基因调节脂肪的生成[24-25]。上述结果表明,植物源miRNAs 可以进入动物体内,并参与畜禽体内肌肉和脂肪形成的调节。本研究得到的结论与其一致,即苜蓿源miR168b 进入奶牛体内调节脂代谢。研究植物源miRNAs 对畜禽脂代谢相关靶基因的作用关系,对改善肉用家畜的肉品质及乳用家畜的乳脂率具有重要意义。
本研究在正常饲喂的高乳脂和低乳脂奶牛的血液和牛奶中均检测到苜蓿源miRNAs,这证明了苜蓿源miRNAs 可以通过采食进入牛体内。苜蓿源miRNA 随着奶牛采食苜蓿进入奶牛体内,参与奶牛体内的血液循环到达乳腺细胞,随着乳腺细胞合成牛奶的过程最终进入牛奶中,故在奶牛血液和牛奶中都可以检测到苜蓿源miRNAs 的存在。同一组不同牛的血液和牛奶中,苜蓿源miRNAs 的表达量有较大的差异,这可能与牛自身的摄入量和代谢相关。其中,奶牛自身对miRNA 的代谢差异可能是导致miRNA 在不同奶牛体内差异表达的主要原因。但mtr-miR168b 在高乳脂和低乳脂奶牛血液和牛奶中均稳定存在,并且高乳脂组mtr-miR168b 的表达量显著高于低乳脂组,故推测mtr-miR168b 在奶牛体内靶向的基因中有与脂代谢密切相关的基因。基于上述推论,通过细胞转染特异性提高了BMEC 中mtr-miR168b 的表达水平,结果表明mtr-miR168b 高表达后,脂代谢标志基因PPARγ、SCD1、CEBP/β和SREBP1在BMEC 中的表达量均被抑制,且随着时间推移,表达量下降更加明显。为了进一步阐明mtr-miR168b 对BMEC 脂肪生成影响的作用机制,对mtr-miR168b 靶基因进行了功能富集分析,并筛选出了mtr-miR168b 与脂代谢密切相关的CPT1A和STARD7两个靶基因(图9)。

图9 苜蓿源mtr-miR168b 影响奶牛乳腺上皮细胞脂质代谢Fig.9 Summary of pathway by which mtr-miR168b from alfalfa influences lipid metabolism in BMECs
STARD7蛋白是一种脂质结合蛋白,在脂质运输、甘油磷脂合成信号通路中均发挥重要作用。并且已有研究表明,嘉兴黑猪脂肪细胞内的miR-206 通过靶向STARD7抑制了脂肪细胞的增殖[26]。CPT1 是脂肪分解代谢的关键酶,也是脂肪酸β 氧化过程中的限速酶,CPT1A是其中一种亚型基因。已有研究表明,CPT1A基因表达量与各肌肉组织肌内脂肪含量呈显著正相关关系,还可以减少小鼠肝脏中的脂肪变性[27-28]。STARD7主要调节的脂类为磷脂和鞘脂,而磷脂和鞘脂是包裹乳脂的乳脂球膜(milk fat globular membrane,MFGM)的主要组成成分[29]。已有研究表明,MFGM 磷脂的变化对牛乳的乳化性、稳定性和理化性质会产生一定影响,进而改变牛乳品质,并且如果牛乳中脂肪含量增加,则会形成比较大的脂肪球,这也揭示了脂肪质量分数与脂肪球大小呈正相关的现象[30-31]。
mtr-miR168b 靶基因显著富集在ATP 结合与GTP 结合条目,甘油磷脂通路和mTOR 信号通路。ATP 与GTP 之间结合与转化可以通过三羧酸循环完成,是机体重要的供能方式,参与多种信号通路的转导,其中AMPK信号通路由于细胞内ATP 减少、AMP/ATP 增加被激活。AMPK 信号通路通过调节葡萄糖和脂肪酸的摄入,调节细胞内胆固醇、糖原、蛋白质、脂肪酸的合成与氧化,以满足能量需求,同时调节机体脂代谢[32-33]。mTOR 有mTORC1 和mTORC2 两个亚型,mTORC2 通过诱导AKT 蛋白氨基酸位点磷酸化激活AKT,激活的AKT 通过磷酸化2448 位点的苏氨酸激活mTORC1,之后被完全激活的AKT/mTOR 信号通路开始调节细胞中脂肪的生成、葡萄糖的代谢和细胞的凋亡[34-35]。mtr-miR168b 的靶基因CPT1A同时位于AMPK 信号通路和mTOR 信号通路,此外STARD7基因参与甘油磷脂合成(R-HSA-1483206)代谢通路。故本研究推测mtr-miR168b 主要通过靶向CPT1A和STARD7基因参与AMPK、mTOR 和甘油磷脂合成信号通路,进而调节奶牛体内的脂代谢。并且CPT1A和STARD7基因与牛乳中乳脂率的调节也有一定联系,这为mtr-miR168b 在基因水平调控奶牛乳脂代谢提供了验证方向。
4 结论
DHI 检测筛选出高乳脂奶牛和低乳脂奶牛,并在两组奶牛的血液和牛奶中均检测到了苜蓿源miRNAs,其中mtr-miR168b 在高乳脂奶牛血液和牛奶中的表达量与低乳脂奶牛相比具有显著差异。进一步试验发现,mtrmiR168b 高表达抑制了BMEC 中脂代谢标志基因PPARγ、SCD1、CEBP/β和SREBP1的表达量。为明确mtrmiR168b 对乳脂的调节机制,对mtr-miR168b 在牛体内的靶基因进行功能富集分析,发现预测靶基因主要与N-聚糖生物合成(3.72%)、cGMP-PKG 信号通路(2.37%)和甘油磷脂代谢通路(1.69%)显著相关。双荧光素酶报告验证了CPT1A和STARD7与mtr-miR168b 靶向关系,为后续验证苜蓿源miRNAs 调控奶牛乳脂提供了可进一步验证的基因。

