房角镜辅助的内路360 °小梁切开术治疗青光眼研究进展
王彩霞 综述,何宇 审校
(1.成都中医药大学眼科学院,成都 610075;2.成都市第一人民医院/成都市中西医结合医院,成都 610041)
青光眼是全球第一大不可逆性致盲眼病。据研究统计,2020年全球青光眼患者达到7 600万,2040年将高达1亿1 180万,全球青光眼总患病率为3.54%,其中原发性开角型青光眼(primary open-angle glaucoma,POAG)的全球患病率为3.05%[1]。青光眼的治疗目标是降低眼压、保护视神经,根据不同类型的青光眼以及眼压情况,可选择不同类型的降眼压药物和手术方式。其手术方式主要包括三大类:外引流手术、内引流手术以及房水生成减弱术。房角镜辅助的内路360 °小梁切开术(gonioscopy-assisted transluminal trabeculotomy,GATT)是传统小梁切开术的改良,该手术将微导管或缝线穿入Schlemm’s管并利用其张力实现全周小梁切开,重建生理性房水流出通道,以达到降眼压的目的。GATT主要适用于各种类型的开角型青光眼(open-angle glaucoma,OAG)和慢性闭角型青光眼。相较于传统的青光眼滤过手术,GATT具有损伤小、手术时间短、恢复快、并发症少、中远期疗效稳定、不依赖滤过泡等优势。本文将对GATT在青光眼中的应用、手术步骤、作用机制、有效性、并发症和影响疗效的因素等进行综述,为其临床运用提供参考。
1 GATT概述
2014年,Grover等[2]最先描述了一种新型微创青光眼手术——改良的内路小梁切开术,在房角镜辅助下,准确地找到小梁网和Schlemm’s管,用一根照明微导管(iTrack),识别和绕行一周穿过Schlemm’s管,然后收紧切开全周小梁网,并将其命名为GATT。iTrack微导管的特殊优势在于其头部设计有特殊的镀膜并且无创,同时拥有照明装置。因此能够全程提供指引,准确的判断微导管是否在Schlemm’s管内,从而顺利穿过狭窄的Schlemm’s管,达到360°的小梁全切开。
既往文献报道,GATT主要被用于各种OAG,包括POAG、继发性开角型青光眼(secondary open-angle glaucoma,SOAG)、原发性先天性青光眼等[2-5]。此外,国内外学者还对GATT治疗抗青光眼手术后失败的OAG的疗效进行了单独评估[6-9]。最后,关于GATT是否适用于闭角型青光眼,临床也有少量研究[10-11]。
2 GATT作用机制
OAG 的房水流出阻力部位主要在小梁网,Schlemm’s管构成青光眼房水流出阻力的50%[12]。早在50多年前,Grant发现通过切除Schlemm’s管近端组织并进入Schlemm’s管可消除75%的房水外流阻力[13-14]。此外,Epstein等[15]和Ethier等[16]的病理研究结果显示:构成Schlemm’s管内壁的内皮细胞内存在许多大空泡,这些空泡使细胞紧密连接,从而大幅度降低了液体在细胞间流动,产生房水流出阻力;在这些约20%~30%的大空泡中,末端还存在开放小孔,被称为细胞间孔,一项研究表明青光眼患者细胞间孔密度仅为正常人眼的1/5左右,推测孔密度的减少也可能与房水流出阻力产生相关[17]。Bill等[18]在猴眼中使用药物干扰细胞间接触,使Schlemm’s管内壁破裂后,房水外流阻力明显降低。Johnson等[19]用实验证实Schlemm’s管塌陷、狭窄会导致房水外流阻力增高从而眼压升高。Lewczuk等[20]的研究表明,眼压与Schlemm’s管之间存在关系,当眼压升高时,Schlemm’s管管腔变窄,小梁向Schlemm’s管管腔突出,导致管腔塌陷;在40 mmHg(1 mmHg=0.133 kPa)压力下,大部分Schlemm’s管管腔塌陷[20]。综上所述,在房水循环通路中,小梁网及Schlemm’s管存在房水流出阻力,因此,Schlemm’s管手术致力于减少小梁网房水流出道的近端阻力,帮助恢复生理性房水流出通道。GATT手术通过360 °小梁切开,实现房水避开小梁网及Schlemm’s管的阻力从前房直接进入集液管与房水静脉相通,由于集液管管腔直径与房水静脉相似,不会产生明显房水外流阻力[21],所以这种通过重建生理性房水循环通道的方式可以增加房水流出,从而达到降眼压的目的。
3 GATT手术步骤
Grover等[2-4,6]报道的手术步骤为:标准无菌消毒后,覆盖手术眼并用开睑器固定眼睑,在鼻上方或鼻下方的透明角膜缘用23 G针头做一个穿刺口,在术眼颞侧透明角膜缘制作另一个切口。通过颞侧切口将粘弹剂注入前房使前房维持一定深度,将微导管或缝线从鼻侧切口插入前房。这时需要显微镜和房角镜精准定位,正确显示房角位置,在鼻侧切口用显微切开刀行1~2 mm的前房角切开(图1)。然后从此切口插入显微手术镊抓取微导管,将微导管的头部通过前房角切开口插入Schlemm’s管(图2),并使用显微手术镊将头端发光的微导管向Schlemm’s管内推进(图3),走行360 °,然后在颞侧切口用显微手术镊抓取微导管前部,在鼻侧切口牵拉微导管的尾端,并收紧达到切开全周小梁网(图4)。利用注吸系统吸除前房内粘弹剂和积血。接近手术结束时,注入25%的粘弹剂填充前房帮助填塞Schlemm’s管,防止出血。最后用生理盐水水密切口。术毕根据医生临床经验在结膜囊内或房内注射糖皮质激素(激素)药物和抗生素滴剂。
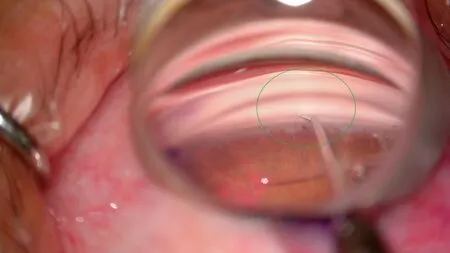
图1 用显微镜和房角镜精准定位显示鼻侧房角位置,用显微切开刀行1~2 mm的前房角切开Figure 1 The microscope and a Swan-Jacob goniolens were used to accurately locate and display the position of the nasal angle firstly,and then a 1mm~2mm incision was made on the nasal angle with a microsurgical
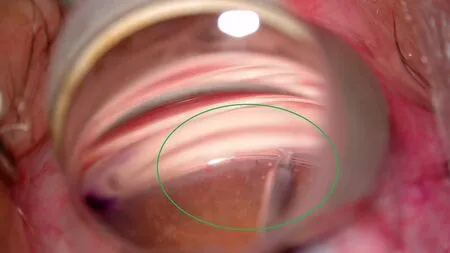
图3 使用显微手术镊将微导管向Schlemm’s管内推进Figure 3 Use the microsurgical forceps to advance the catheter in the Schlemm’s canal
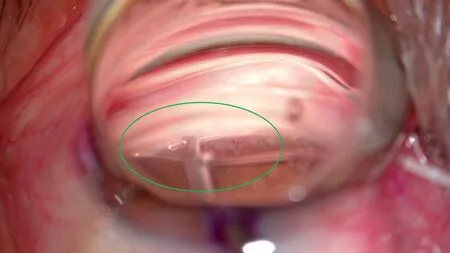
图4 微导管走行360 °后,用显微手术镊抓取微导管前部,牵拉微导管的尾端并收紧达到切开全周小梁网Figure 4 The catheter has been passed 360° around the canal,then grasp the tip of catheter with microsurgical forceps and pull the end of catheter,thus the circumferential trabeculotomy is created
Aktas等[22]报道了在GATT手术结束时,通过注吸系统吸除粘弹剂,在最大高度放置平衡盐溶液(BSS)进行前房灌注,通过加压冲洗检查巩膜外静脉是否有BSS流动和或漂白,即巩膜外静脉液流波(EVFW)。EVFW方法最先由Fellman 等[23]提出,在他们随后的研究[24]中认为EVFW阳性眼集液管通道和下游房水流出通道必须通畅,因为鼻侧是集液管密度最高的位置[25],通过对准鼻侧的集液管通道加压冲洗BSS可促进下游房水流出通道通畅,表现为巩膜浅层血管漂白。因此,在GATT手术中,通过加压冲洗观察EVFW,一方面可促使下游房水流出通道通畅,使房水通过集液管引流到巩膜深静脉丛、巩膜中丛和巩膜外丛,最终到达结膜静脉,实现房水流出;另一方面,EVFW的程度可能是GATT手术成功的一个有价值的预后指标[22]。
由于术中骚扰虹膜组织,术后炎症反应多较重,在术中应注意避免。首先需行房角镜检查筛选适合手术的病例,无法识别房角结构(特别是小梁网和巩膜突)是GATT手术的绝对禁忌证[6],若术中无法识别房角结构,则术中难以避免骚扰虹膜组织。然后,在往前房注入粘弹剂之前先向前房内注入卡巴胆碱缩瞳牵拉虹膜[26],往前房注入粘弹剂时保证粘弹剂足量以使前房维持一定深度,均可更好地暴露手术视野,避免术中损伤虹膜。最后,手术过程中的灵活处理也可避免损伤虹膜及其他组织,如果在插管过程中感到阻力,不能暴力插管,可通过小梁网切口向Schlemm’s管内注入粘弹剂使Schlemm’s管扩张后再次尝试微导管推进,如果仍不能通过,则在小梁网远端阻塞处再行一个房角切开口,并从这个房角口以相反方向插入微导管推进,完成360 °小梁切开术[27]。
4 GATT治疗青光眼的有效性
4.1 各种类型的开角型青光眼
在临床上,GATT首先应用于各种类型的OAG,包括POAG和SOAG,对于合并白内障的OAG患者,可与白内障手术联合。多项研究[2,28-33]表明,单独GATT手术和联合白内障手术的GATT在最终眼压水平和抗青光眼药物使用数量上无明显差异。但Bozkurt等[34]在关于GATT联合或不联合白内障摘除术治疗POAG和假性剥脱性青光眼(pseudosparabening glaucoma,PEX)的研究中观察到,单独的GATT对眼压的降低效果略优于联合手术。一项荟萃分析[31]表明,对于OAG合并或不合并白内障患者进行单独GATT手术或同时联合白内障手术治疗OAG的手术成功率为85%,但是这项分析并未对单独GATT手术和联合白内障手术成功率进行分别统计,同时这项分析对于GATT术后手术成功率评估的末次随访时间差异很大,在2~33个月不等。这项汇总结果[31]还显示GATT治疗各种类型的OAG在术后至少12个月的随访中降眼压滴眼液的使用数量较基线减少1.31~2.04种。
4.1.1 原发性开角型青光眼
GATT最常用于治疗POAG,并取得了明显的疗效,但大多临床研究[28-29,31-32,34-35]把其归于OAG,并未对GATT治疗POAG进行单独统计研究,只有少数学者对GATT治疗POAG进行了独立的研究。Salimi等[36]对GATT治疗POAG的中青年患者56眼进行了1年疗效分析:手术总成功率为84%(包含完全成功率和条件成功率),术后1年眼压从术前的(27.70±10.30)mmHg降至(14.04±3.75)mmHg(减少49%),药物使用量从术前(3.73±0.98)种减少至(1.82±1.47)种(减少51%)。Grover等[2]的研究显示,单独GATT、GATT联合白内障手术和既往有白内障手术史再行GATT治疗POAG,术后6个月和12个月时平均眼压下降分别为7.7 mmHg(30.0%)和 11.1 mmHg(39.8%),术后6个月及12个月时降眼压药物使用数量平均减少0.9种和1.1种。GATT前进行白内障手术或与GATT联合白内障手术与初次GATT患者相比,眼压降低程度和降眼压药物数量减少程度相近。此后,Grover同一团队[4]将先前研究进一步拓展,加大样本量,同时延长随访时间至24个月,119例POAG患者在GATT术后24个月时眼压平均下降9.2 mmHg(37.3%),降眼压药物数量平均减少了1.43种,此项研究仍显示无论是否联合白内障手术均不会影响GATT手术成功率。Smith等[37]使用GATT治疗8例POAG患者,患者年龄为63~93岁,术后3个月平均眼压和降眼压药物数量均有所减少,在术后2年,除1例失去随访外,仅2例需再次手术来控制眼压,其余患者眼压控制良好,降眼压药物数量显著减少。
4.1.2 继发性开角型青光眼
GATT还适用于SOAG,包括PEX、激素性青光眼(steroid-induced glaucoma,SIG)、色素性青光眼(pigmented glaucoma,PG)和葡萄膜炎继发青光眼(uveitis glaucoma,UG)等。其中GATT治疗PEX的效果较明显,Sharkawi等[38]观察GATT治疗PEX的疗效研究显示,84例(103眼)PEX接受GATT治疗,随访24个月,手术成功率为89.2%,平均眼压由术前27.1 mmHg下降至13.0 mmHg,降眼压药物数量由术前平均2.9种降至平均1.0种。Aktas等[28]对OAG患者行GATT手术,其中POAG占比62.5%,PEX占比24%,其他SOAG占比13.5%(包括SIG、PG和UG),虽然总体上POAG患者术后平均眼压较SOAG患者降低更多,但在这些SOAG患者中,仍能发现个别术后眼压下降效果显著的患者,特别是PEX患者。Bozkurt等[34]运用单独GATT或GATT联合白内障手术治疗POAG和PEX,随访12个月,手术成功率分别为87.5% 和 83.8%,并观察到PEX和POAG患者间最终眼压水平比较差异无统计学意义。此外,GATT对于治疗SIG也取得了较好效果,Boese等[39]对13例SIG患者行GATT手术,术后3个月及术后24个月随访时手术成功率均为100%,到术后24个月,所有患者的眼压都下降了20%以上,降眼压药物的数量显著减少。Hopen等[40]报道了一例患有春季卡他性结膜炎(vernal Keratoconjunctivitis,VKC)的8岁男性患儿,在接受局部激素治疗后,右眼继发了SIG,使用降眼压药无法控制眼压,鉴于病情较重,无法停用激素,因此对此患者行GATT手术治疗,术后在使用激素的情况下,眼压仍控制良好,术后2年,眼压仍在正常范围内,同时VKC得到改善,能够停止使用激素。Widder等[41]运用Kahook双刃刀内路小梁切除术联合GATT手术治疗一例23岁因特发性葡萄膜炎使用激素诱导的SIG女性患者,在术后12个月的随访中,其眼压控制良好,同时未出现其他眼部并发症。
最后,有学者单独报道了GATT治疗其他SOAG的相关病例。Sachdev等[42]报道了因青少年特发性关节炎引起的UG接受GATT治疗的3例年轻UG患者,眼压均成功受控。Quan等[43]回顾性分析了8例(8眼)18岁以上经GATT治疗的玻璃体视网膜手术后SOAG的病例,平均随访8.6个月,眼压从术前(32.7±5.1)mmHg降至术后(13.6±1.8)mmHg,平均用药从术前(4.8±0.9)种降低至术后(1.6±1.4)种。
4.1.3 先天性青光眼青少年型
先天性青光眼青少年型即青少年型青光眼(juvenile open-angle glaucoma,JOAG)。临床上,GATT治疗JOAG的疗效同样可观。Shi等[44]对70眼JOAG行GATT手术,平均随访时间为12个月,手术完全成功率为74.3%,合格率为91.4%,平均眼压从术前的(31.3±9.5)mmHg下降至术后(15.8±2.7)mmHg。Wang等[45]回顾性分析59眼JOAG 接受GATT治疗,术后12个月手术完全成功率和合格成功率分别为70.8%和81.2%,术后18个月分别为58.6%和81.2%。术后12个月眼压从术前(26.5±9.0)mmHg降至(14.7±3.0)mmHg,降眼压药物数量从(3.7±0.9)种降至(0.7±1.2)种;术后18个月,眼压降至(14.1±2.3) mmHg,降眼压药物数量降至(0.4±0.8)种。高传文等[46]运用GATT治疗20眼JOAG,随访时间(27.5±3.7)个月,发现手术完全成功率和条件成功率分别60%和90%,降眼压药物数量同样明显减少。
4.1.4 先天性青光眼婴幼儿型
GATT在原发性先天性青光眼婴幼儿型(primary congenital glaucoma,PCG)的治疗中也显示了良好的治疗效果。房角切开术是治疗先天性青光眼的首选手术方式,Mocan等[47]通过研究证明,房角切开术通过切开发育异常的小梁网及Schlemm’s管内壁可减少房水流出阻力降低眼压,成功率为60%~90%。GATT作为改良切开术,其小梁网切开范围较传统房角切开术更广,在理论上也能取得较好的降压效果,但是该手术中房角镜的使用要求角膜透明,而大部分PCG的患儿角膜浑浊,同时受Haab纹的影响,使手术难度加大,在临床上具有一定局限性。所以先天性青光眼婴幼儿大部分采取微导管辅助下的外路360 °小梁切开术(microcatheter-assisted trabeculotomy,MAT)。虽然MAT治疗PCG已取得了较高的手术成功率,但是该操作需要从巩膜和结膜上做切口,这可能会影响将来行滤过性手术的疗效[48-49],因此角膜情况较好的PCG更适合行GATT手术。高传文等[46]运用GATT治疗9眼PCG,年龄为(2.4±1.5)岁,随访时间为(28.1±4.2)个月,手术成功率为100%,术前用药为[3(2,4)]种,在末次随访时所有患者均未使用降眼压药物。Davinder等[3]回顾性分析了行GATT的4例PCG患者,患者年龄2个月~ 16岁,随访>12月(12~30个月),平均眼压从31 mmHg下降到19.25 mmHg,平均需要的降眼压药从1.5种减少到0种。石砚等[5]对17眼PCG行GATT治疗,患者发病年龄为0~3岁,末次随访时间为6个月,眼压从术前的(33.3±6.2)mmHg降至(14.7±2.5)mmHg,降压幅度为(49.7±15.8)%,术后用药数量较术前明显减少。
4.1.5 抗青光眼术后失败的开角型青光眼
GATT用于既往抗青光眼术后失败的OAG,要求既往青光眼手术未破坏小梁网结构。但在已发表的文献中,GATT对既往有抗青光眼手术失败史的OAG患者疗效有限。Mehmet等[7]研究显示:既往有小梁切除术失败史的26例OAG患者共26只眼,随访时间为(17.8±4.1)个月,手术完全成功率为61.5%。李海军等[8]将行GATT治疗的POAG分为两组,即初次手术组(18眼)和多次手术组(已行多次滤过手术失败的POAG39眼),术后12个月,两组患者的完全成功率分别为 55.6%和38.5%,条件成功率分别为22.2%和20.5%。Voykov等[9]运用GATT治疗31眼既往有Schlemm’s管成形手术史的OAG患者,在术后12个月时,手术完全成功率和条件成功率分别为25%和75%,其中6眼需要在术后行进一步手术控制眼压。
4.2 慢性闭角性青光眼
GATT在闭角型青光眼的应用主要为慢性闭角型青光眼,在目前少量的研究报道[10-11]中其疗效可靠。Sharkawi等[10]认为该亚型青光眼的房水流出主要是因为周边虹膜阻塞小梁网而受阻,GATT可以解决虹膜阻塞问题,同时切开小梁网与内层Schlemm’s管促进生理性房水流出,通过双重机制降低眼压。同时,他们团队报道了88例PACG患者共103眼行GATT治疗,其中45只眼行单独GATT手术(GATT组),58眼联合白内障手术(GATT+Phaco组),随访24个月,组间眼压降低比较差异无统计学意义,总成功率为78%,术前平均眼压从(21.4±7.4)mmHg降至术后(12.1±2.4)mmHg,青光眼药物从(2.5±1.1)种降至(1.2±0.8)种。此外,Fontana等[11]回顾性研究了运用GATT治疗的15眼慢性闭角型青光眼,随访6个月时GATT手术的完全成功率为73%,合格率为20%,随访12个月,完全成功率为73%,合格率为27%,术后12个月眼压与基线检查时相比,眼压降低的百分比为(49%±9.41%),抗青光眼药物数量从术前[3(3,4)]种下降至术后[0(0,2)]种。
5 并发症
5.1 前房积血
国外多项研究[2-4,6,9,29,35,37,50-51]表明,GATT术后很少发生威胁视力的并发症,其中前房积血是GATT术后最常见的并发症,发生率为12.5%~80.6%。一项荟萃分析[31]显示,GATT术后前房积血的综合发生率高达36.0%。国内相关研究[8,52-53]报道,GATT术后前房积血发生率几乎为100%。Sato等[35]的研究表明,GATT术后前房积血是因为Schlemm’s管与房水静脉相通,当眼压降低后,在上巩膜静脉压的作用下,静脉血会自然回流到前房中,前房积血实际上是来自静脉的回血,同时前房积血是手术成功的标志。但Rahmatnejad等[29]的一项研究表明GATT手术成功组和手术失败组的前房积血发生率相当。为减少术后前房积血的发生,Grover等[2-4,6]建议在手术结束时用粘弹剂填充25%的前房,帮助填塞Schlemm’s管,并头抬高30 °持续1~2周,减少术后早期回血。
Grover等[4,6]发现前房积血通常发生在术后第1周,2周后通常不会出现肉眼可见的前房积血,术后1个月出现的前房积血通常是轻微积血,一项荟萃分析结果显示,大多数的前房积血在1个月内可被吸收[31]。GATT术后前房积血大多不需要干预,若前房积血持续不吸收则需行前房冲洗,Grover等[4]主张如果术后7~10 d仍有明显的前房积血,应行前房冲洗;Sharkawi等[38]认为,如果在术后1周内观察到血凝块、积血超过前房容积50%,在术后第2周应行前房冲洗并复查;Bozkurt等[34]甚至在手术室行前房冲洗来处理比较严重的积血。Shi等[48]主张患韦伯综合征的青光眼患儿在行GATT手术治疗后,若在术后第3天前房内仍有明显的积血,应行前房冲洗。
5.2 眼压骤升(IOP-Spike)
眼压骤升(IOP-Spike)也是GATT术后较常见的并发症,研究[2,9,35,51]报道术后出现眼压骤升的概率为8.2%~32.3%,但关于眼压骤升并没有标准定义,同时其机制尚未阐明。Mehmet等[7]认为术后早期眼压骤升可能是由于外科医生为控制前房积血而留下的粘弹剂所致,晚期眼压骤升通常与术后局部使用激素有关。Shi等[44]在JOAG经GATT治疗后手术失败的危险因素分析中发现,术后出现睫状体裂口或睫状体上腔积液消退的眼睛常发生眼压骤升,猜测这两者与眼压骤升可能存在关系。睫状体裂口很可能是由做鼻侧小梁切口时切开刀引起的直接创伤,导致睫状体脱离,出现暂时性的低眼压。而当睫状体上腔积液消退后,便会出现即时的眼压骤升,但所有眼压骤升的出现时间均不是在睫状体上腔积液消退的当天,所以考虑睫状体上腔积液可能只是推迟了眼压骤升发生的时间,而积液的消退并非导致术后眼压骤升的原因。
目前关于术后出现眼压骤升需要观察多久尚无统一标准,除了加强观察外,学者们主张同时进行积极干预。Sharkawi等[38]认为术后出现眼压骤升(IOP≥26 mmHg),应持续观察至少2周。Aktas等[28]的研究表明,术后早期出现眼压骤升(IOP>25 mmHg),在立即静脉输注20%甘露醇和外用降眼压眼液控制后,高眼压持续的时间通常不会超过1 d。Shi等[44]主张,对于出现眼压骤升的患者,应给予最大限度地局部和全身药物治疗,对于IOP>40 mmHg的患者,应行前房穿刺术,同时每天监测这些患者的眼压,直至眼压恢复正常。此外,GATT术后可常规使用3个月的缩瞳药[44-45],用于拉伸虹膜防止粘连,使前房积血通过房水引流通道代谢吸收,避免血凝块阻塞房角引起眼压骤升。术后若出现眼压骤升,还应观察房角情况,若是血凝块阻塞房角,则应行前房冲洗术;若是房角粘连,可考虑行房角分离术。由于GATT术后常使用激素类滴眼液局部抗炎,一部分患者可出现激素相关的眼压变化,这类患者则应立即停用激素类滴眼液[44]。
5.3 罕见并发症
临床研究显示,GATT术后还可能出现一些罕见并发症。有报道显示[9,50-51],GATT术后出现了一过性低眼压,其发生率为4.5%~6.5%。Shi等[44]的研究发现,术后早期较低的眼压与较多的睫状体上腔积液存在关系,睫状体上腔积液可能是由于术中切开刀牵引导管形成小梁切开口时对睫状肌纤维的牵拉所产生,其产生可导致睫状体脱离造成眼压降低。GATT术后还可能出现一过性视力下降,Aktas等[54]报道了2例继发于睫状体上腔积液的GATT在术后出现一过性视力下降,这2例患眼超声生物显微镜(ultrasound biomicroscope,UBM)均提示睫状体上腔积液,积液吸收后视力明显提高,在6个月的随访中眼压控制良好。Yalinbas等[55]报道了2例GATT联合超声乳化术后出现的罕见并发症:晶体囊袋内血肿导致急性视力下降,术后不久,2例患者均发现人工晶状体后囊内血肿,血肿清除后视力明显提高,并指出囊袋内血肿所致视力下降可能是GATT联合超声乳化术的早期并发症。Aktas等[56]报道了一例GATT术后的罕见并发症:全巩膜炎,此病例有前葡萄膜炎病史,因此他建议葡萄膜炎患者应在GATT术前至少3个月控制葡萄膜炎。临床研究还报道了GATT术后的其他罕见并发症,如角膜水肿、后弹力层脱离、虹膜炎、虹膜根部离断、玻璃体积血、周边虹膜前粘连(PAS)、前房角粘连、脉络膜皱襞和黄斑囊样水肿(CME)等[2,4,6,35,51]。
6 GATT疗效的影响因素
6.1 青光眼类型
GATT对不同类型的青光眼治疗效果有一定差异,综合已发表的文献分析[28-30,33-34,38-39,44-46,52,57],降眼压效果最好的青光眼类型是OAG,总体上POAG患者的眼压下降幅度高于SOAG患者,其中降压幅度最高的是SIG,其次是JOAG,然后是PEX,最后是其他类型OAG。但是GATT在抗青光眼术后失败的OAG中治疗成功率明显降低,既往青光眼切口手术引起的集液管异常结构、Schlemm’s管塌陷及中断可能是导致失败的原因[37,57]。在GATT运用于PCG的研究中,Grover等[3]认为GATT治疗JOAG和PCG的效果相当。而Quan等[58]的研究表明,在儿童患者中,GATT治疗JOAG比治疗PCG的失败率更低,并认为JOAG和PCG之间的疗效差异可能是因为PCG的儿童相比JOAG的儿童在小梁网远端有更异常的流出系统,在PCG儿童患者中行GATT手术时,Schlemm’s管内部固有的解剖异常可能会导致无法完全通管,从而手术容易失败。GATT在慢性闭角型青光眼的应用中,手术成功率要低于OAG,并且应用范围有限,在周边虹膜前粘连形成狭窄的角度阻碍房角结构的观察时,GATT会被认为是治疗闭角青光眼的禁忌证,因为它会导致微导管难以或不可能插入Schlemm’s管。
6.2 眼压骤升后持续性高眼压
眼压骤升后的持续性高眼压是影响GATT疗效的一大因素。Chen等[59]研究发现术后眼压骤升(被定义为在GATT术后前3个月内的随访中,手术眼的眼压升高到高于术前眼压水平)后持续性高眼压存在会影响GATT手术疗效。接着,该团队将这项研究扩展到评估儿童GATT失败风险因素[58],发现经历眼压骤升眼的失败率高于未经历眼压骤升眼。但这仅在没有前房积血的术眼中显著,而在有前房积血的术眼中未见明显差异,在经历眼压骤升眼中,有前房积血眼的失败风险降低了5倍,所以无前房积血眼出现眼压骤升可能是手术失败的预警。同时,研究表明术后接受激素治疗眼比接受非甾体抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs)治疗的眼睛更容易发生眼压骤升,术后仅使用NSAIDs治疗可能会增加手术成功率。性别、种族、治疗角度、使用的器械类型和术前平均眼压与眼压骤升无关。Shi等[44]的研究中同样显示术后高眼压持续时间较长是GATT失败的危险因素,Rahmatnejad等[29]研究中发现严重病例的高眼压持续时间更长,并建议GATT术后早期进行频繁的眼压监测,以监测这些患者是否存在眼压骤升及持续性高眼压。
6.3 遗传背景
在Rahmatnejad等[29]的研究中,GATT治疗OAG的手术结果跟遗传背景相关,白种人和非裔患者的GATT总成功率分别为69%和42%,其原因尚不明确。Taubenslag等[60]研究表明非裔患者在几种青光眼手术(包括小梁切除术、XEN引流术和Schlemm’s管成形术)中,成功率也较白种人明显降低。Nguyen等[61]发现青光眼非裔患者的结膜活检比欧裔患者有更多的成纤维细胞和巨噬细胞,这表明青光眼术后更严重的炎症反应可能是导致更非裔患者手术成功率更低的原因。虽然GATT避开了结膜,但炎症反应增加可能不限于结膜,这可能是结果有差异的原因。近年来,GATT手术在国内广泛开展,几项研究[5,8,33,46,52-53]均表明GATT在我国青光眼治疗中具有较好疗效。
6.4 前房积血
前房积血作为GATT术后最常见的并发症,关于其是否会影响手术疗效,临床上已有大量研究。Shi等[44]在运用GATT治疗JOAG的研究中发现术后早期出现广泛的前房积血可能会对远期手术结果产生影响。GATT术中纤维两端的张力使微导管在管腔中向前移动,与Schwalbe线并列,一旦被切开,小梁切口通常在Schwalbe线的正后方,而不是在Schlemm’s管的中间,这导致连接在巩膜突上的小梁组织 “像吊桥一样”打开,延伸到虹膜周围[4],被称为小梁架,它表明小梁切开与集液管相通,与良好的术后结果相关[2]。而GATT术后小梁架闭合几乎总是与血凝块相关,血凝块改变了小梁架角度,导致虹膜粘连或小梁闭合,从而可能影响GATT术后疗效[44]。此外,Quan等[58]认为尽管术后发生前房积血的眼睛的失败率并不比没有前房积血的眼睛高,但术后前房积血的眼睛更可能发生眼压骤升,增加手术失败的风险。Yalinbas等[55]报道了2例GATT联合白内障手术后不久出现了晶体囊袋内血肿引起的视力下降,分析血肿的原因是由前房积血引起的,手术结束后留在前房的粘弹剂,不仅填塞Schlemm’s管预防出血,而且可能会阻碍前房积血,使出血走向晶体囊袋内。因此GATT联合白内障术后更要注意干预前房积血,如果出血走向人工晶状体后方,吸收期可能比预期的要长,导致视力持续下降,影响手术疗效。
临床上大多数研究表明,GATT术后前房积血似乎对手术疗效不会有太大的影响,一方面术后前房积血程度大多较轻,另一方面学者们重视对前房积血进行积极干预,避免了其进一步发展影响手术疗效。
6.5 年龄
年龄似乎也是影响GATT手术疗效的因素。Bozkurt等[34]的一项回顾性研究在评估单独GATT和联合白内障手术治疗OAG的疗效性时观察到单独的GATT对眼压的降低效果略优于联合手术,相反,多项研究[2,28-33]认为的白内障手术不会影响GATT手术疗效。随后Bozkurt[34]通过分析数据发现联合白内障手术组的年龄为(69.37 ± 11.50)岁,明显高于单独GATT组的年龄(60.18 ± 17.95)岁,较高的平均年龄可能与较长的青光眼诊断期相关,晚期青光眼由于小梁网内壁突出至集液器通道开口[22],导致集液器通道萎缩。因此,GATT手术的疗效可能在老年患者中较低,联合白内障手术可能并不是直接影响GATT手术疗效的原因。Quan等[58]在研究GATT 治疗儿童青光眼患者的失败因素中发现:57例患者的74只眼,手术时平均年龄为7.1岁(2个月~17.4岁),手术时年龄每增加5岁,失败风险降低37%。此外,Shi等[44]关于在GATT治疗JOAG研究中表示,年龄较大是GATT治疗JOAG失败的相关因素,其机制尚不明确。
7 总结和展望
GATT通过重建生理性房水流出通道达到降眼压的目的,其适应证广泛,主要应用于各种类型的OAG,尤其适用于POAG,同时适用于SOAG患者(包括SIG、PEX、UG、PG等)。对于先天性青光眼,GATT可作为JOAG和角膜情况较好PCG患者的首选手术方式。此外,GATT手术可运用于能观察到房角结构的慢性闭角型青光眼。GATT手术的绝对禁忌证包括凝血功能障碍、人工晶体不稳定、不能识别房角结构、房角闭合、角膜情况较差等。相对禁忌证为既往角膜移植病史和术后前2周无法将头部抬高30 °等。目前该手术还存在局限性,临床上报道的大多数研究为回顾性病例研究,尚缺乏GATT手术的随机对照试验研究。同时GATT手术的成功标准尚无统一定义,有关操作、随访、基线IOP和原发病等存在差异,影响结果汇总和比较。综合国内外研究现状,GATT治疗效果确切、微创、安全性高,极少发生威胁视力的并发症,因此在青光眼领域有很好的应用前景,但GATT在各种类型的青光眼的运用中疗效有差异,其治疗不同类型青光眼的具体机制尚有待探索。在并发症方面,学者对GATT术后常见并发症(包括前房积血、眼压骤升、一过性低眼压等)的发生机制进行了解释,但尚缺乏前瞻性试验进一步阐明,而其他并发症(包括罕见并发症和潜在并发症)的发生机制则需要更大样本量、更长随访时间的研究。
利益冲突所有作者均声明不存在利益冲突
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。详情请访问:https://creativecommons.org/licenses/by-ncnd/4.0/。

