威远页岩气区块某平台配液用水与采出水细菌群落演替规律
张庆 景于娣 陈祉伊 岳明 补成中 张腾 谭鹏 孙玉 徐波
1.中国石油集团川庆钻探工程有限公司页岩气勘探开发项目经理部 2.西南石油大学化学化工学院 3.中国石油塔里木油田分公司监督中心 4.中国石油集团川庆钻探工程有限公司安全环保质量监督检测研究院
随着页岩气的开发,川南威远页岩气区块长期出现集输管道腐蚀、穿孔等现象,造成了严重的经济损失[1]。刘乔平[2]和李鑫[3]等在对页岩气和油田中集输管道的腐蚀原因进行分析研究中发现微生物腐蚀(microbiologically influenced corrosion,MIC)是造成管道腐蚀穿孔的主要因素。有研究认为,在页岩气生产过程中,压裂液的使用会使得微生物进入集输管道,从而发生微生物腐蚀作用,引起集输管道穿孔失效[4-6]。因此,页岩气开采中对微生物有关的研究十分必要。Cluff和Zhong等[7-8]在对Duvernay,Marcellus等地区的研究中,发现在水力压裂过程之后,返排液和采出水中大多数群落与发酵、碳氢化合物氧化和硫循环代谢相关的耐盐细菌有关。一些研究发现,造成集输管道腐蚀的微生物主要包括硫酸盐还原菌(sulfate-reducing bacteria,SRB),铁氧化菌(iron-oxidizing bacteria,IOB),产酸菌(acid-producing bacteria,APB)与产黏液菌(slime-producing bacteria,SPB)[9-12]。目前,对川南威远页岩气区块微生物的相关研究甚少,特别是对关键腐蚀细菌的分析及菌群演替规律更少涉及。
以威远页岩气区块某平台页岩气开采过程中的配液用水与采出水(清水配液、回用返排液和采出水)为对象,研究了配液用水与采出水中细菌的多样性,探究了其关键的腐蚀细菌,初步解析出配液用水与采出水间细菌的演替规律,从而为细菌引起的管道腐蚀提供依据,并为后续有效的防护提供参考。
1 实验部分
1.1 试剂与仪器
1.1.1试剂
DNA提取试剂盒FastDNA○RSPIN Kit For Soil,MP Biomedicals公司;引物314F和806R,北京诺禾致源科技股份有限公司;6×DNA loading buffer,北京索莱宝科技有限公司;AxyPrep DNA凝胶提取试剂盒,美国爱思进公司。
1.1.2仪器
5810R高速冷冻离心机,德国eppendorf股份公司;Nanodrop 2000核酸测定仪,美国Thermo Fisher公司;T100 PCR仪、 PowerPac1645050电泳仪,美国Bio-rad公司;MiSeq PE300高通量测序平台,美国Illumina公司;QuantiFluor-ST荧光计,美国Promega公司。
1.2 方法
1.2.1样品的采集
四川威远地区页岩属于五峰-龙马溪组,页岩储层主要在缺氧条件成藏,储层温度为90~120 ℃[13-14]。在此区块某平台上共采集7个配液用水与采出水样品,其中配液用水是回用返排液与清水的混合物,而清水是附近江河湖泊水,平台采用清水与返排液混合配液进行压裂。样品瓶在取样前预先使用N2吹扫排出空气,样品采集后于4 ℃保存,并立即带回实验室进行后续分析。样品信息如表1所列。

表1 样品信息采集表样品编号样品性质取样时间L1配液用水(清水)2019-02-16L2配液用水(回用返排液)2019-02-22L3配液用水(回用返排液)2019-02-19L41井采出水2019-04-04L51井采出水2019-04-15L61井采出水2019-04-20L71井采出水2019-04-30
1.2.2DNA的提取
取样品500 mL,使用孔径为0.22 μm的无菌滤膜抽滤,将抽滤后的滤膜使用灭菌的剪刀剪碎,并收集滤膜碎片于灭菌的离心管中,使用FastDNA○RSPIN Kit For Soil试剂盒提取样品中的总DNA,之后使用核酸测定仪检测DNA的纯度和含量。
1.2.3PCR扩增及目标产物检测
以稀释后的基因DNA为模板,使用特异引物进行PCR扩增,用质量分数为2%的琼脂糖凝胶对PCR产物进行电泳检测,条带清晰且无明显非特异性扩增,即PCR成功。
1.2.4Illumina MiSeq测序
对目标条带进行切割,利用AxyPrep DNA凝胶提取试剂盒将其条带回收和纯化,利用QuantiFluorTM-ST荧光计对PCR产物含量进行定量检测,将目的扩增片段构建文库(PE 2×300)进行16S rRNA基因的高通量测序。
1.2.5细菌多样性数据分析方法
下机数据进行过滤、筛选和均一化处理后用于OTU聚类分析、Alpha和Beta多样性分析。选取高频数出现序列作为该OTU的代表序列,利用数据库进行物种注释分析[15],获得分类学信息并分别在门、属等分类水平上统计各样本的群落组成[16]。
2 结果与讨论
2.1 基本数据统计分析
清水、回用返排液和采出水7个样品共获得高质量的优化序列528 450条,进一步与物种注释数据库比对检测并去除嵌合体序列后获得有效序列共468 663条。通过97%相似度聚合后,共获得1 940个OTU,对所有OTU进行物种注释分析,样品结果共鉴定出42门76纲197目357科743属1 124种。
2.2 细菌多样性分析
2.2.1OTU聚集分析
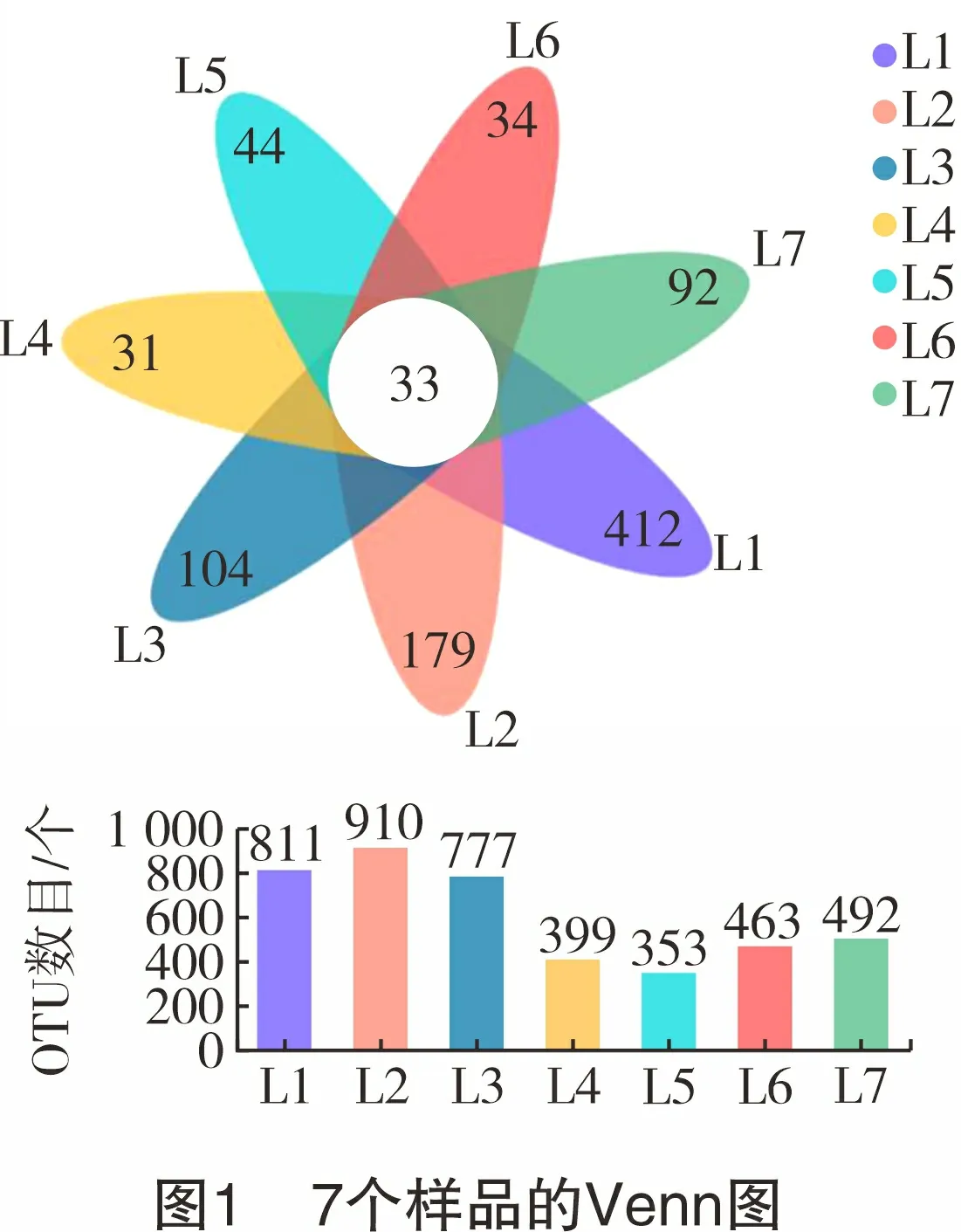
图1所示为7个样品的OTU数目柱状图及Venn图。从图1可看出:配液用水样品L1、L2和L3中OTU数目均较多,其中L2中OTU数目最多;采出水样品L4、L5、L6和L7中OTU数目在350~500个之间,其中L5样品中OTU数目最少。说明配液用水中的物种丰富度高于采出水。Venn图中展示了所有样品共有和各样品特有的OTU数目,可以看出配液用水样品特有OTU数目比采出水样品多。
2.2.2Alpha多样性
为研究7个样品细菌群落的丰富度和多样性,在97%相似水平下对各样品的Alpha多样性指数进行计算[17],结果见表2。Chao1和ACE指数用于评价样品的物种群落丰富度,指数越高,样本物种群落的丰富度就越高。物种群落多样性用Shannon和Simpson来评价,Shannon指数越高,Simpson指数越低,说明样本群落多样性就越高[18]。由表2可知:配液用水(L1、L2和L3)的ACE和Chao1指数明显高于其他样品,说明配液用水(L1、L2和L3)中物种丰富度更高;配液用水(L1和L2)的Shannon指数明显高于其他样品,Simpson指数低于其他样品,说明配液用水(L1和L2)中物种多样性也更高。
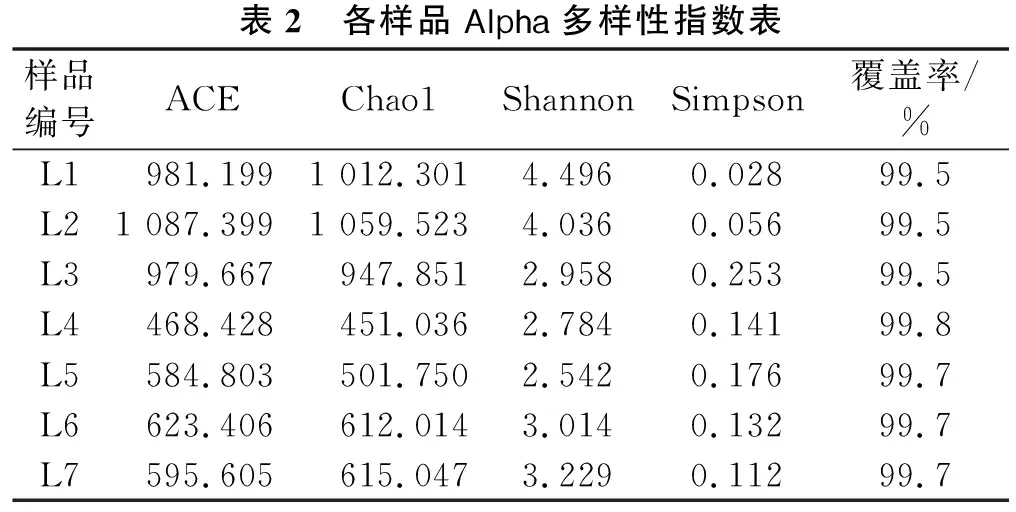
表2 各样品Alpha多样性指数表样品编号ACEChao1Shannon Simpson覆盖率/%L1981.1991 012.3014.4960.02899.5L21 087.3991 059.5234.0360.05699.5L3979.667947.8512.9580.25399.5L4468.428451.0362.7840.14199.8L5584.803501.7502.5420.17699.7L6623.406612.0143.0140.13299.7L7595.605615.0473.2290.11299.7
图2所示为7个样品稀释曲线图。由图2可知,所有样品的稀释曲线后期趋向平缓,覆盖率均大于99.5%(见表2),表明本研究测序深度足够,基本覆盖到样品中的所有物种,且能够反映各样品的真实情况,测序数据可满足后续要求。
OTU分析及Alpha多样性说明压裂过程中物种的丰富度降低,多样性减少。这可能是由于配制压裂液时会加入杀菌剂等化学药剂进行杀菌处理,随后在地层高温、高压、厌氧极端条件下,物种的生长受到极大的抑制甚至死亡,从而一直保持在较低水平,并使得采出水中物种的丰富度和多样性也降至较低水平,但返排回地面后,由于较长时间在地面储水池或液罐中储存,细菌开始大量生长繁殖,导致返排液在回用时细菌的丰富度大幅上升[19]。这与Struchtemeyer等[20]的研究结果一致。
2.2.3Beta多样性
图3所示为样品间基于unweighted-unifrac距离计算的PCoA图,用于反映样品群落结构间的差异大小[21]。PCoA图中两个样本间距离越近,表明两个样品的群落组成越相似,反之群落组成差异越大。如图3所示,回用返排液(L2、L3)和采出水(L4、L6)聚集在左侧,采出水(L5、L7)聚集在中下部,而清水L1与其他所有样品明显地分隔开,聚集为3个聚类,各聚类内样品细菌群落组成较相似,各聚类间存在显著性差异。
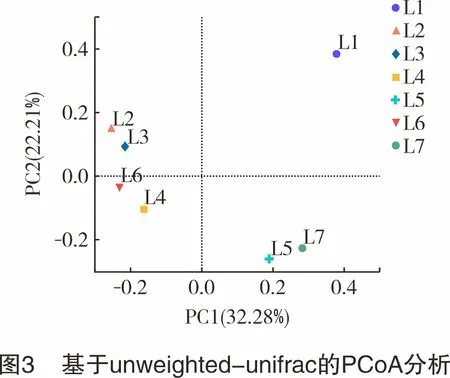
清水配液(L1)与采出水(L4、L5、L6、L7)的细菌群落结构完全不同,这与Struchtemeyer等[20]的研究一致。采出水(L4、L5、L6、L7)间细菌群落组成有相似,也有显著差异,这可能与采出时间有关。这与Cluff等[8]在美国宾夕法尼亚州Marcellus页岩井进行的水样微生物群落动态跟踪研究结论一致。回用返排液(L2、L3)与部分采出水(L4、L6)间细菌群落组成较相似,这是因为现场压裂采出水也会返排回地面进行回用[22]。
2.3 细菌群落结构变化关系
2.3.1门水平上群落结构分析
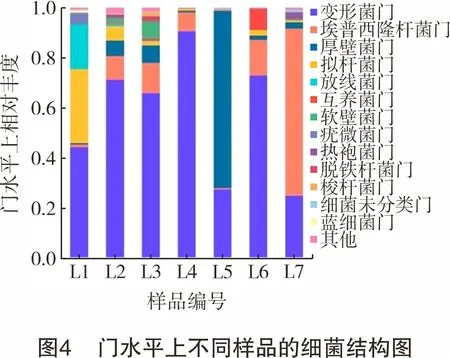
图4所示为在门水平上不同样品的细菌结构。由图4可知,在门水平上,变形菌门(Proteobacteria)、埃普西隆杆菌门(Epsilonbacteraeota)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)等是优势细菌群类(在所有样品中平均相对丰度大于5%)。其中,变形菌门是相对丰度最高的菌门,平均相对丰度为56.85%;埃普西隆杆菌门也普遍分布于各样品中,平均相对丰度为15.91%;厚壁菌门主要存在于L5中,拟杆菌门主要存在于L1中,其相对丰度分别为78.36%、21.29%。清水样品L1中以好氧的变形菌门下α-变形菌纲 (Alphaproteobacteria)为主,采出水(L4、L5、L6、L7)以兼性厌氧的埃普西隆杆菌门、变形菌门下γ-变形菌纲(Gammaproteobacteria)和严格厌氧的δ-变形菌纲(Deltaproteobacteria)为主。这说明,生产过程中微生物群落变化可能是由好氧菌门往厌氧菌门方向演替。
2.3.2属水平上关键腐蚀细菌及菌群演替规律分析
图5所示为属水平上各样品共有细菌中的核心细菌占比情况。核心细菌包括了弓形杆菌属(Arcobacter)、海细菌属(Marinobacterium)、嗜氢菌属(Hydrogenophilus)、假单胞菌属(Pseudomonas)、硫磺螺旋菌属(Sulfurospirillum)、脱硫微菌属(Desulfomicrobium)。
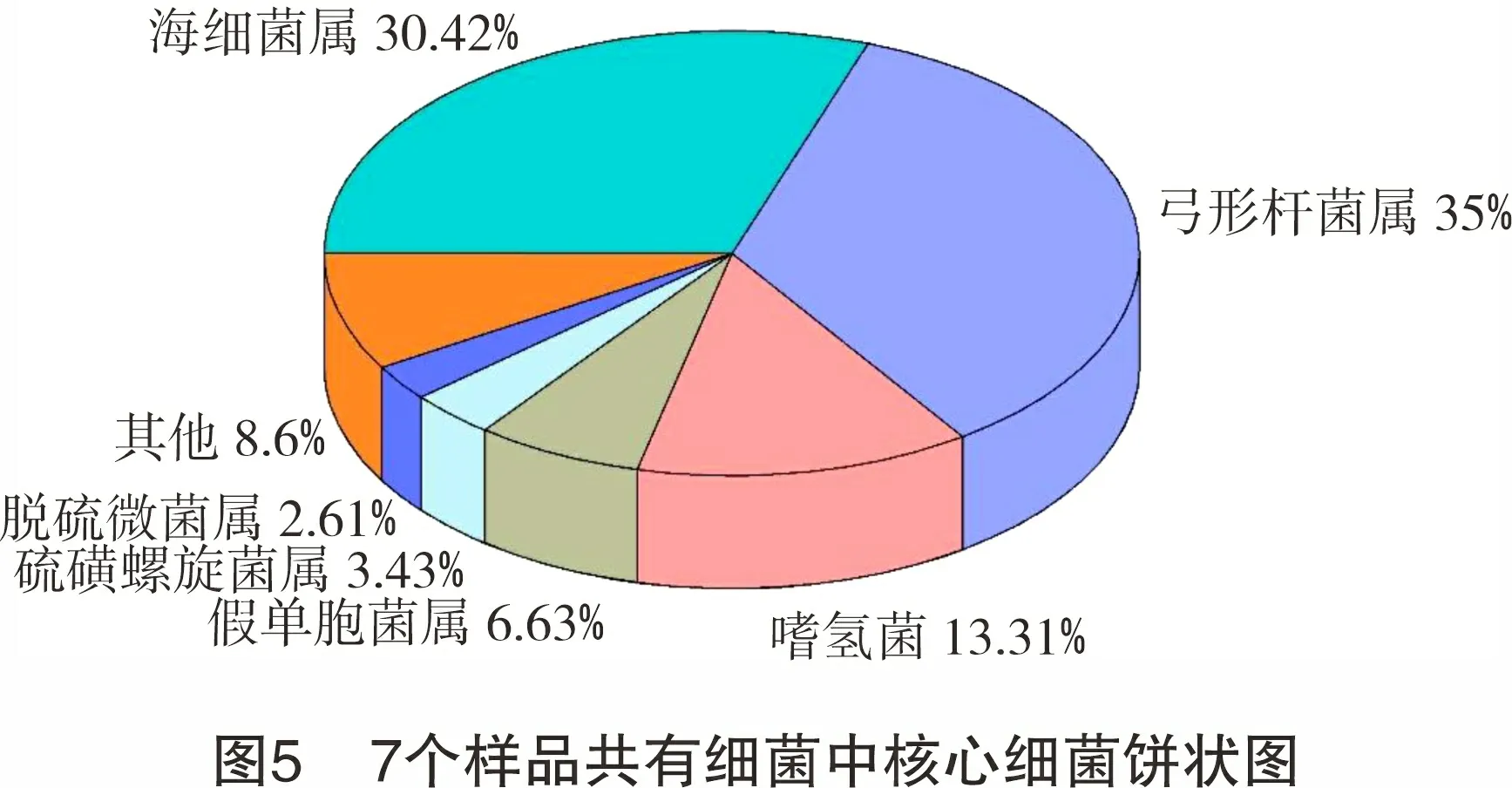
弓形杆菌属广泛存在于油田土壤和采出水中,是一种兼性厌氧细菌[23],Ross等发现弓形杆菌属能够分泌胞外聚合物 (extracellular polymeric substances,EPS),并形成生物膜[24],假单胞菌属也能分泌EPS[25]。因此,弓形杆菌属和假单胞菌属的存在可能会利于SRB等腐蚀细菌在管道内壁的附着,从而加速管道腐蚀。海细菌属是一种兼性厌氧的SRB,广泛存在于油田采出水中,能够利用脂肪酸、氨基酸、糖类和芳香族化合物等作为碳源生长,还原硫酸盐进行生长代谢[26]。脱硫微菌属能够利用硫单质作为电子受体产生硫化物,同时也能够将硫酸盐还原为硫化物,从而推动系统中的硫循环,是油气开采中导致腐蚀的最主要的细菌[27]。硫磺螺旋菌属属于硫氧化细菌,参与了硫循环[28]。这些核心细菌属于嗜温细菌,大都是腐蚀细菌,可直接造成或促进管道腐蚀,被认为是关键腐蚀细菌。

图6所示为7个样品属水平上的热力图。从图6可看出,关键腐蚀细菌在回用返排液(L2、L3)和采出水(L4、L5、L6、L7)中的占比极大,并且清水配液(L1)中也存在。
对图6及图3分析可知,清水L1样品与其他6个样品的物种构成有较大的区别。Limnohabitans、norank-CladeIII、CL500-29_marine_group、hgcI_clade、噬冷菌属(Algoriphagus)、沉积小杆菌属(Sediminibacterium)、黄杆菌属(Flavobacterium)和Fluviicola等菌属仅在L1中有着较高相对丰度(>75%),这些细菌几乎均为江河湖泊中常见的好氧菌群,其硫酸盐还原、产酸等功能非常弱,因此,对管道腐蚀有较小的风险。在压裂液注入地层后,采出水群落结构发生改变,鉴定出更多的是与腐蚀相关的细菌,如嗜温的脱硫芭蕉菌属(Desulfuromusa)、弧菌属(Vibrio)、希瓦氏菌属(Shewanella)、海旋菌属(Thalassospira)、海神单胞菌属(Neptunomonas)、寡养单胞菌属(Stenotrophomonas)和嗜热的芽孢杆菌属(Bacillus)、Thermovirga、热袍菌属(Thermotoga)等。关键腐蚀细菌的相对丰度也在急剧增加,可能是由于配制压裂液时加入的化学添加剂中的有机物提供了碳源,以及受地层环境因素的影响。采出水样品中的菌群大多数为嗜温细菌,也有少部分为嗜热菌,但它们大多数(>90%)都属于兼性厌氧、厌氧或严格厌氧细菌,且具有硫酸盐还原、硫还原、硫氧化、产酸、产生物膜、铁还原等功能,这些细菌一旦在管道内大量富集,可能会对现场集输管道造成严重的腐蚀。特别是在回用返排液L2和L3中,存在大量的硫代谢、产酸和产生物膜的细菌,腐蚀细菌在L2中的相对丰度超过75%,L3中也超过67%。
3 结论
(1) 威远页岩气区块某平台配液用水与采出水中细菌的高通量测序共鉴定出42门76纲197目357科743属1 124种。Alpha多样性及Beta分析结果显示,清水配液的物种组成与其他样品差距很大,压裂后物种丰富度降低,多样性减少。
(2) 门水平清水样品以好氧的变形菌门下α-变形菌纲为主,采出水样品以兼性厌氧的埃普西隆杆菌门、变形菌门下γ-变形菌纲和严格厌氧的δ-变形菌纲为主;属水平采出水样品主要以弓形杆菌属和海细菌属为主;各样品关键腐蚀细菌主要包括弓形杆菌属、海细菌属、假单胞菌属、硫磺螺旋菌属、脱硫微菌属,这些细菌属于嗜温细菌,可直接造成或促进管道腐蚀。
(3) 清水配液中细菌群落是由嗜温、好氧、硫酸盐还原、产酸等功能较弱的细菌为主,回用返排液中存在大量具有硫代谢、产酸和产生物膜功能的细菌,经压裂后,采出水中以兼性厌氧、厌氧或严格厌氧,即具有硫酸盐还原、硫还原、硫氧化、产酸、产生物膜、铁还原等功能的细菌为主,并鉴定出部分嗜热细菌。回用返排液与采出水细菌群落结构相似。

