硫酸亚铁-过硫酸钾体系深度处理含镍废水
苗侨伟,王晓丽,刘军海*,李 鹏,邓利华,段 欢
(1.陕西理工大学 化学与环境科学学院,陕西 汉中 723001; 2.陕西理工大学 陕西省催化基础与应用重点实验室,陕西 汉中 723001; 3.汉中石门固体废物处置有限公司,陕西 汉中 723001)
重金属镍因其独特的性质被广泛应用于电镀行业[1-2],但其作为一种常见的致癌物质,其污染具有不可降解性和生物富集性,所以经济高效地处理含镍废水就变得尤为重要[3-5]。废水中游离的镍离子易与EDTA、柠檬酸、酒石酸等有机络合剂的配位体螯合形成稳定性极强的络合物[6-10],制约了镍的进一步处理。络合镍需要先进行破络合处理使其变为游离的镍离子,然后通过絮凝沉淀进行处理[11-13]。
目前破络合的方法主要有电解法[14]、Fenton氧化法、臭氧氧化法[15-16]、H2O2氧化法[17]等。相对于工业级应用较为成熟的Fenton氧化法,硫酸根自由基(·SO4-)氧化法因其氧化效率高、pH范围宽、半衰期长、选择性强的特点逐渐成为废水处理技术的研究热点[18-21]。本文以高浓度含镍废水为研究对象,在已有研究的基础上,对比直接沉淀法、H2O2氧化沉淀法、Fenton氧化沉淀法和硫酸亚铁-过硫酸钾体系氧化沉淀法4种方法对镍的处理效果。并对硫酸亚铁-过硫酸钾体系氧化沉淀法做出工艺优化,该工艺为基于硫酸根自由基的高级氧化工艺的应用提供了一条绿色且有前景的途径。
1 材料与方法
1.1 试剂与仪器
1.1.1 主要试剂
高浓度含镍废水(汉中石门固体废物处置有限公司);铬酸钾(AR,北京市红星化工厂);氯化钡(二水)(AR,成都市科隆化学品有限公司);氨水(AR,上海麦克林生化科技有限公司);氯化钠(AR,寿光市荣丰化工有限公司);硝酸银(AR,萍乡市白狮化学试剂有限责任公司);碳酸钙(AR,天津市天力化学试剂有限公司);无水硫酸钠(AR,天津市光复科技发展有限公司);单元素标准溶液(铁、锰、镍、铬、镉、铜、锌、铅);硫酸亚铁(AR,天津市大茂化学试剂厂);过氧化氢(AR,天津市科密欧化学试剂有限公司);过硫酸钾(AR,天津市盛奥化学试剂有限公司);聚氯化铝(AR,西安耀皇化工有限公司);聚丙烯酰胺(AR,上海市麦克林生化科技有限公司)
1.1.2 主要仪器
S600型电感耦合等离子发射光谱仪(南京博越分析仪器有限公司);LD5-10低速离心机(北京京立离心机有限公司);722型可见分光光度计(上海仪电分析仪器有限公司);SZCL-T型数显智能控温磁力搅拌器(杭州瑞佳精密科学仪器有限公司);GW1030超声波清洗机型(深圳市冠博科技实业有限公司)
1.2 含镍废水成分分析
使用电感耦合等离子体发射光谱仪测定配制好的金属离子标准液(浓度分别为0、5、10、15、20、25 mg·L-1),做出浓度与特征光谱吸收强度拟合曲线和线性回归方程。在不同波长下(Fe3+:259.939 nm;Ni2+:231.604 nm;Cd2+:228.802 nm;Zn2+:206.200 nm;Cu2+:327.393 nm;Cr3+:267.716 nm;Pb2+:220.353 nm;Mn2+:257.610 nm;Ca2+:317.933 nm)测定含镍废水的特征光谱吸收强度,通过线性回归方程得出金属离子浓度。
1.3 镍的处置研究
1.3.1 4种方法对含镍废水的处置效果对比
(1)直接沉淀法取75 mL水样,用氢氧化钠溶液调节溶液pH为12,加入絮凝剂PAC 3.0 g,静置沉淀12 h后测定Ni2+浓度,记为a组。
(2)氧化-沉淀法
取75 mL废水样品于烧杯中,用稀硫酸溶液调节溶液pH为3,加入过氧化氢0.1 mL,搅拌反应1 h,用氢氧化钠溶液调节溶液的pH为12,加入絮凝剂PAC 3.0 g,静置沉淀12 h后测定Ni2+浓度,记为b组。
(3)Fenton氧化-沉淀法
取75 mL废水样品于烧杯中,用稀硫酸溶液调节溶液pH为3,向其中加入质量比为2的硫酸亚铁/过氧化氢(硫酸亚铁0.34 g),搅拌反应1 h,用氢氧化钠溶液调节溶液的pH为12,加入絮凝剂PAC 3.0 g,静置沉淀12 h后测定Ni2+浓度,记为c组。Fenton氧化沉淀法机理如下(式1):
(4)硫酸亚铁/过硫酸钾氧化沉淀法
取75 mL废水样品于烧杯中,用稀硫酸溶液调节溶液pH为3,向其中加入质量比为2的硫酸亚铁/过硫酸钾(硫酸亚铁0.34 g),搅拌反应1 h,用氢氧化钠溶液调节至溶液的pH为12,加入絮凝剂PAC 3.0 g,静置沉淀12 h后测定Ni2+浓度,记为d组。硫酸亚铁-过硫酸钾氧化沉淀法机理如下(式2):
1.3.2 硫酸亚铁-过硫酸钾氧化沉淀法工艺参数的优化
在75 mL的水样中,调节溶液初始pH为2,硫酸亚铁-过硫酸钾投入质量比为2(硫酸亚铁0.34 g),搅拌反应1 h,调节溶液pH为12,加入絮凝剂(PAC)3 g,沉淀静置12 h,在此条件下,静置沉淀完成后,取上层清液测定Ni2+浓度。在上述工艺的研究基础上,分别改变絮凝剂种类、搅拌反应时间、投入硫酸亚铁-过硫酸钾质量比、初始pH、沉淀pH进行进一步研究,优化各项工艺参数。
2 结果与讨论
2.1 含镍废水主要成分分析
表1为实际检测高浓度含镍废水样品中常见的污染物种类以及具体含量。由表1可知,含镍废水样品中含量最高的污染物为镍,其浓度为1.52×104mg·L-1。
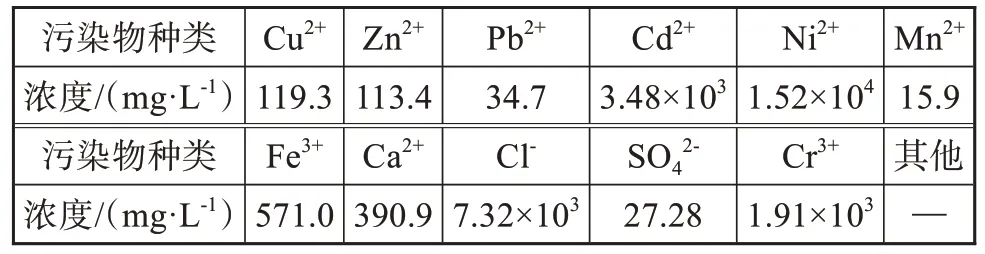
表1 含镍废水水质分析Tab.1 Analysis of water quality of nickel-containing wastewater
2.2 4种方法对含镍废水的处置结果分析
图1为根据1.3.1中实验方法及条件对含镍废水进行处理后Ni2+含量及Ni2+去除率。由图1可知,通过化学沉淀法处置后,含镍废水中镍的含量有所降低,说明还有部分镍以络合物的形式存在,简单的化学沉淀法达不到镍的处置要求。在对比3种氧化沉淀方法时得出硫酸亚铁-过硫酸钾氧化沉淀法处置效果最佳,说明使用pH范围宽、选择性高、氧化性较强的硫酸根自由基效果最佳。

图1 4种处理方法对Ni2+的去除效果Fig.1 Effect of four treatment methods on Ni2+ removal
2.3 硫酸亚铁-过硫酸钾氧化沉淀法最佳工艺参数的探究
(1)分别取2份75 mL高盐废水于烧杯中,用稀硫酸调节溶液初始pH为3,向其中投加质量比为2的硫酸亚铁/过硫酸钾(硫酸亚铁0.34 g),搅拌反应1 h后,用氢氧化钠溶液调整溶液pH为12,分别加入絮凝剂PAC、PAM 3.0 g,静置沉淀12 h。当反应结束,静置沉淀后,观察到当投入絮凝剂为PAC时,上层溶液近似透明,下层生成浅绿色沉淀。当投入絮凝剂为PAM时,静置沉淀后,溶液呈胶状,不利于废水排放。而且工业用絮凝剂PAC价格比PAM便宜,所以选择PAC为絮凝剂时,处理效果最优。
(2)分别取5份75 mL高盐废水于烧杯中,按照1.3.2中实验方法,改变静置沉淀时间,分别静置沉淀4 h、8 h、12 h、18 h、24 h。最后测定Ni2+含量如图2所示。
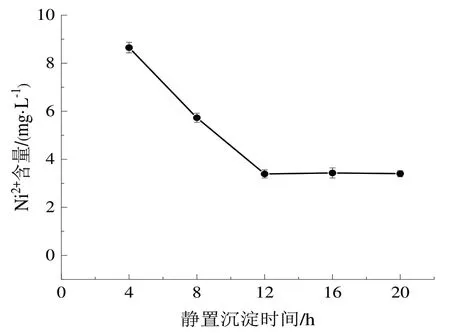
图2 静置沉淀时间对Ni2+去除效果的影响Fig.2 Effect of sedimentation resting time on Ni2+ removal effect
由图2可知,当静置沉淀时间为12 h时,镍离子处置效果较优,在12 h后继续增加静置沉淀时间,镍离子浓度无明显变化,说明此时静置12 h时几乎完全沉淀。在应用于实际工业生产中,可用压滤机代替静置沉淀时间,提高生产效率。
(3)分别取5份75 mL高盐废水于烧杯中,按照1.3.2中实验方法,改变搅拌反应时间,分别搅拌0.25 h、0.5 h、1.0 h、1.5 h、2.0 h,最后测定Ni2+含量如图3所示。

图3 搅拌反应时间对Ni2+去除效果的影响Fig.3 Effect of stirring reaction time on Ni2+ removal effect
由图3可知当搅拌反应时间为1 h时,镍离子处置效果较优,在1 h后增加静置时间,镍离子浓度无明显变化,说明此时反应已达平衡。综合考虑成本与效率,选择条件为搅拌反应1 h。
(4)分别取5份75 mL高盐废水于烧杯中,按照1.3.2中实验方法,改变硫酸亚铁-过硫酸钾投入质量比,分别投入质量比为0.5、1、2、4、6的硫酸亚铁-过硫酸钾,最后测定Ni2+含量如图4所示。
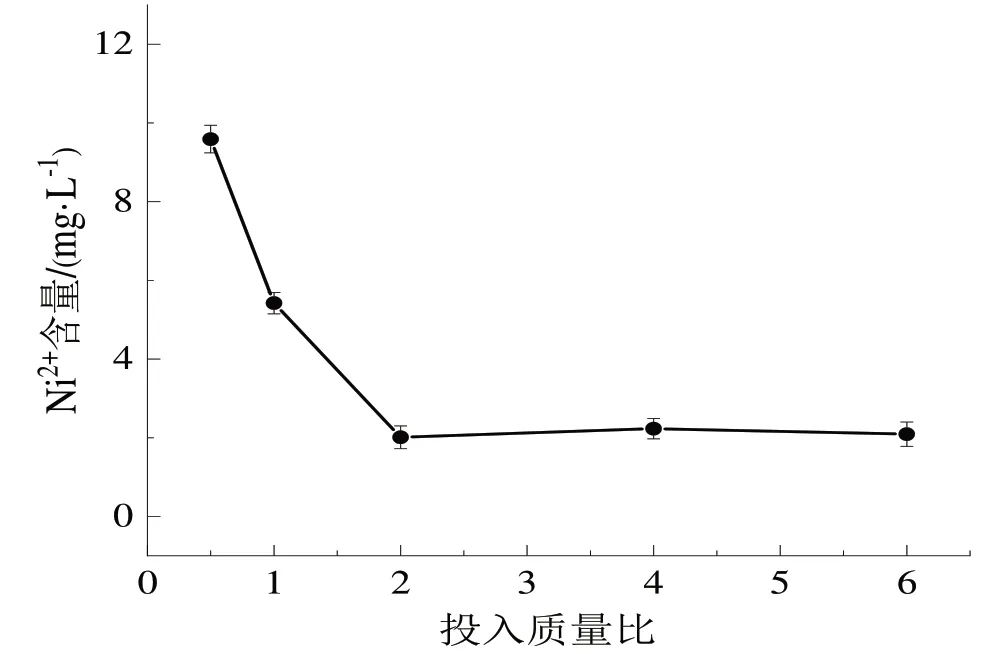
图4 投入质量比对Ni2+去除效果的影响Fig.4 Effect of input mass ratio on Ni2+ removal effect
由图4可知,当增加硫酸亚铁-过硫酸钾投入质量比时,溶液中Ni2+的含量呈现出先下降后略微提升的趋势,这是因为过硫酸钾的投入量增大虽然会产生大量的·SO4-,发生自猝灭反应(式3),而Fe2+的投入量加大虽然能提高·SO4-的浓度,但是过量的Fe2+会与·SO4-发生氧化还原反应(式4)。当投入硫酸亚铁-过硫酸钾质量比为2时,镍离子处理效果较优。说明当投入硫酸亚铁的质量为过硫酸钾质量的2倍时,此时体系中产生的强氧化性硫酸根自由基数目较多,对络合镍的破络效果较优。
(5)分别取5份75 mL高盐废水于烧杯中,按照1.3.2中实验方法,改变溶液初始pH,分别为1、2、3、4、5,最后测定Ni2+含量如图5所示。
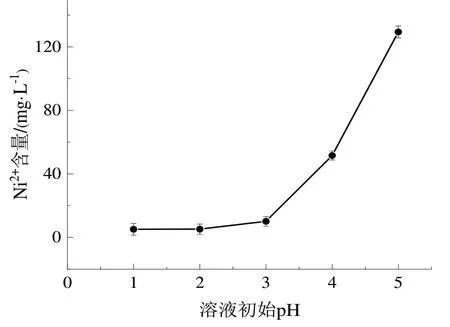
图5 初始pH对Ni2+去除效果的影响Fig.5 Effect of initial pH on Ni2+ removal effect
由图5可知,当溶液初始pH为1或者2时,镍离子处置效果较优,说明硫酸亚铁-过硫酸钾体系在酸性条件下会使过硫酸根通过质子催化形成具有强氧化性的硫酸根自由基,考虑到成本问题,选择反应条件为溶液初始pH为2。
(6)分别取5份75 mL高盐废水于烧杯中,按照1.3.2中实验方法,改变溶液的pH,分别调节溶液pH为10、11、12、13、14,最后测定Ni2+含量如图6所示。
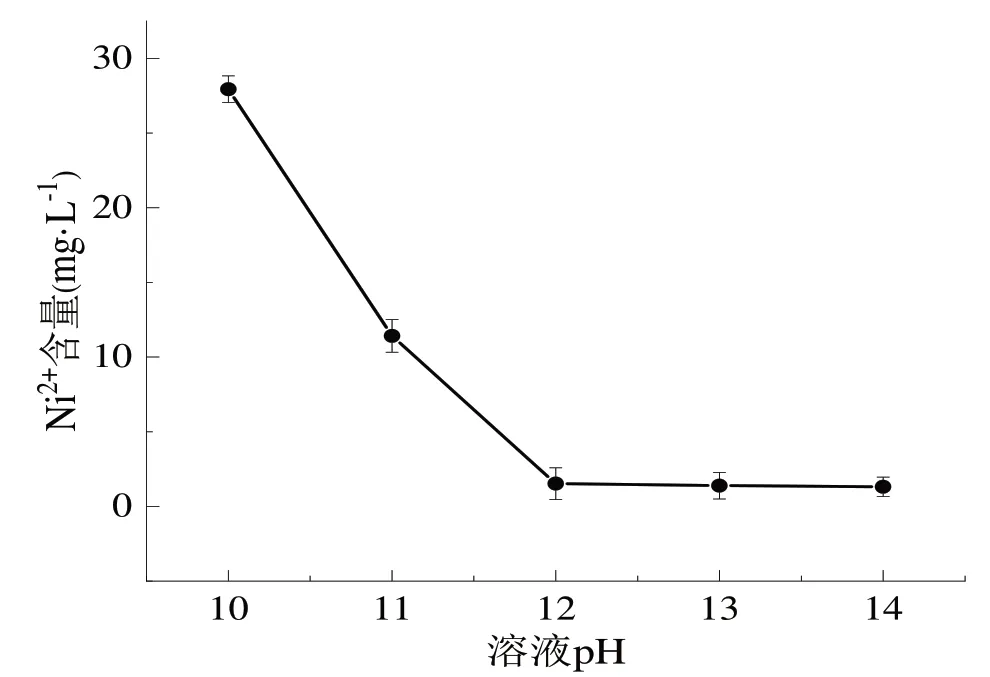
图6 溶液pH对Ni2+去除效果的影响Fig.6 Effect of pH of solution on Ni2+ removal effect
由图6可知,当溶液pH为12时,镍离子处置效果较优,在溶液pH为12后继续增加溶液pH,镍离子含量变化不明显,说明此时溶液中以离子形式存在的镍几乎全部沉淀,但是验证实验中发现当溶液pH为12时,溶液中的Cd2+浓度达不到排放标准,当溶液pH为13时,Cd2+浓度下降至0.078 mg/L(排放标准GB 8978—1996:Cd2+≤0.1 mg/L),综合考虑成本等条件选择沉淀pH为13。
2.4 含镍废水中镍的处置最佳工艺验证实验
取75 mL含镍废水于烧杯中,用稀硫酸调节溶液初始pH为2,向其中加入质量比为2的硫酸亚铁/过硫酸钾(硫酸亚铁0.34 g),用磁力搅拌器搅拌反应1 h,待反应结束后,用氢氧化钠溶液调整溶液pH为13,加入絮凝剂PAC 3.0 g,静置沉淀12 h。取上层清液按照1.2中实验方法与条件对含镍废水水质进行分析,结果如表2所示,其中Ni2+含量为0.830 mg·L-1,Ni2+的去除率达到99.5 %,符合排放标准(排放标准GB 8978—1996:Ni2+≤1.0 mg·L-1)。

表2 含镍废水水质分析(处理后)Tab.2 Analysis of water quality of nickel-containing wastewater (after treatment)
3 结 论
经过分析检测得出含镍废水样品中镍的含量,使用简单的化学沉淀法处理效果差,说明含镍废水中的镍多数以络合物形式存在。通过对比4种不同的处置方法得出,硫酸亚铁-过硫酸钾氧化沉淀法处理效果最佳,在此基础上进行硫酸亚铁-过硫酸钾氧化沉淀法的最佳工艺参数探究。得出结论:在75 mL高浓度含镍废水时,调节溶液初始pH为2,向其中加入质量比为2的硫酸亚铁-过硫酸钾(硫酸亚铁0.34 g),搅拌反应1 h后,调节溶液pH为12,絮凝剂PAC的投入量为3.0 g,沉淀静置时间为12 h,在此条件下,含镍废水处理后的镍离子浓度为0.830 mg·L-1(符合国家排放标准GB 8978—1996:Ni2+≤1.0 mg·L-1),而且其他金属离子污染物的含量也下降明显。该研究结果可为实际工业生产提供理论参考。

