煤气化渣活化过硫酸盐降解水中1-萘酚
郭 凯,李亚男,王嘉琪,张国凯,牛莫男
(1. 太原理工大学 环境科学与工程学院,山西 晋中 030600;2. 中海国亚环保工程有限公司,山西 太原 030012)
1-萘酚(1-NAP)属于多环芳烃(PAH)化合物,具有难生物降解、高毒性(遗传毒性、生殖毒性和蛋白质毒性)的特点,广泛用于塑料、农药、合成橡胶等产业,产生大量1-NAP废水,若不经处理直接排放会污染生态环境[1-4]。目前常见的1-NAP废水处理方法有物理吸附法、光催化氧化法、化学氧化法等,其中化学氧化法是降解1-NAP的主要方法,该方法反应速率快、降解彻底。
基于过硫酸盐(PS)的高级氧化技术因具有适用范围广、氧化能力强、对环境友好等特点而被广泛应用于废水处理中[5-6]。过渡金属、热、超声波、紫外光、碱等均可活化PS产生硫酸根自由基(SO4-·)[7-11]。SO4-·的氧化还原电位为2.5~3.1 V,半衰期长[12]。Fe2+因具有无毒、低成本、对环境友好等特点,常被用作活化剂,但直接投加Fe2+易产生大量铁泥,且自由基形成速率过快,而利用天然含铁废弃物缓释Fe2+活化PS的非均相活化可以较好地克服这些缺点[13-14]。煤气化渣(CGS)是煤气化过程中生成的固体废弃物,其经济价值较低,露天堆放占用大量土地,但它是一种天然含铁物质,具有活化PS的潜力。
本研究选取1-NAP为目标污染物,利用CGS活化PS产生自由基降解水中的1-NAP,考察了CGS投加量、PS投加量、初始pH和共存物质等因素的影响,并对降解机理进行了分析,以期为CGS活化PS降解1-NAP的实际应用提供一定的理论依据。
1 实验部分
1.1 试剂、材料和仪器
1-NAP(C10H7OH),纯度大于等于99%;乙腈(CH3CN),纯度大于等于99.95%;过硫酸钠(Na2S2O8)、甲醇(MeOH)、异丙醇(IPA)、叔丁醇(TBA)、腐殖酸(HA)、NaHCO3、KI、H2SO4、NaOH,均为分析纯;CH2Cl2为色谱纯;实验用水均为去离子水。
CGS取自于山西省运城市某煤化工企业,实验前用玛瑙研钵研磨后过60目筛,用去离子水多次冲洗,干燥后密封保存备用。
RF-6000型荧光分光光度计,日本岛津公司;UV-1100型紫外-可见分光光度计,中国美析仪器有限公司;HJ-6A型多头磁力搅拌器,金坛区西城新瑞仪器厂;SB-5200DT型超声波清洗仪、PHS-3C型pH计,上海雷磁仪器厂;JSM-IT700HR型场发射电子显微镜,日本电子公司;K-Alpha型X射线光电子能谱仪,Thermo Fisher公司;8890-7000D型气相色谱-质谱联用仪,安捷伦科技公司。
1.2 实验方法
将0.062 5 g 1-NAP溶于250 mL乙腈中,得到0.25 g/L的1-NAP储备液。取2 mL 1-NAP储备液,用去离子水定容至100 mL(1-NAP 5 mg/L),并转移至250 mL烧杯中。将烧杯置于磁力搅拌器上,控制转速为250 r/min,用稀硫酸或NaOH调节pH至3,加入1.0 g/L的CGS和0.5 mmol/L的PS,反应25 min。实验过程中定时取样后放入预先加入1 mL甲醇的离心管中,用0.22 μm滤膜过滤后测定1-NAP浓度,计算其去除率。
1.3 分析方法
采用SEM-EDS和XPS技术对CGS进行表征。
采用荧光分光光度计测定1-NAP剩余浓度,激发波长294 nm,发射波长470 nm[15]。
取0.25 mL反应液加入到6 mL NaHCO3-KI混合溶液(0.4 g NaHCO3和8.0 g KI,去离子水定容至100 mL)中,振荡摇匀反应15 min后,采用紫外-可见分光光度计在波长352 nm处测定吸光度,由工作曲线得到PS剩余浓度[16]。
采用气相色谱-质谱联用仪分析1-NAP降解的中间产物。气相色谱参数:HP-5ms色谱柱(30 m×0.25 mm×0.25 μm);升温程序为100 ℃保持1 min,以5 ℃/min的速率升温至200 ℃并保持15 min,以10 ℃/min的速率升温至280 ℃并保持5 min;不分流,氦气为载气,流量1.0 mL/min。质谱参数:离子源为电子轰击源(温度230 ℃),发射电子能量70 eV,接口温度280 ℃,进样口温度280 ℃,扫描范围质荷比50~500。
2 结果与讨论
2.1 CGS的表征
图1的SEM照片表明,CGS粉末呈块状,表面光滑但不规则,尺寸范围为2~10 μm。由EDS(表1)和XPS(图2)结果可知,CGS由O、C、Fe、Si、Al等元素组成,还含有少量的Ca、K元素。过渡金属具有催化PS的能力,其催化活性排序为Co2+>Ru3+>Fe2+>Ce3+>V3+>Mn2+>Fe3+>Ni2+。CGS中Fe元素的质量分数达11.9%,这使得CGS具有活化PS的潜力。

表1 CGS的EDS表征结果

图1 CGS的SEM照片
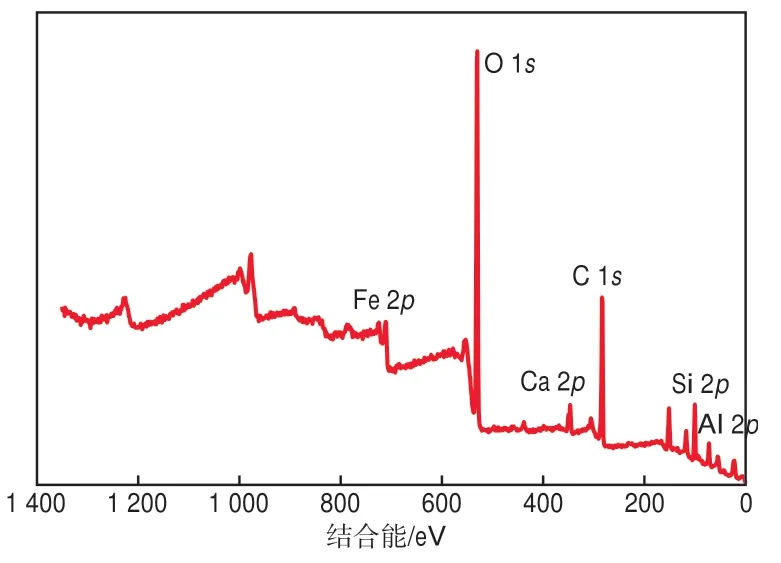
图2 CGS的XPS谱图
2.2 CGS活化PS体系降解1-NAP的效果
2.2.1 不同体系的比较
不同体系对1-NAP的去除效果如图3所示。体系中CGS和PS单独存在时,1-NAP的去除率均较低。CGS单独存在时,反应25 min后1-NAP的去除率仅为6.77%,说明仅使用CGS对1-NAP的处理效果不明显。PS在常温常压下化学性质相对稳定,仅有少量的SO4-·产生,单独存在时对1-NAP的去除率仅为9.21%。在CGS-PS体系中,1-NAP的去除率在反应25 min后达到100%,这主要是因为CGS中所含铁元素催化PS产生SO4-·和HO·,促进了1-NAP的氧化降解。反应原理如式(1)和式(2)所示。
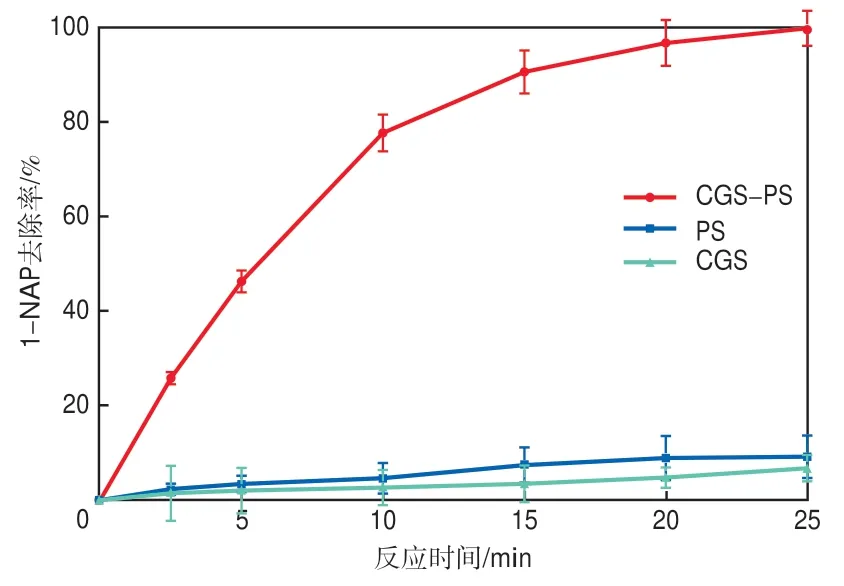
图3 不同体系对1-NAP的去除效果
2.2.2 CGS投加量的影响
方程右边,有关格林函数的方程,是利用了震源和观测点可以互为替换的特性。鉴于无限介质在放射条件下无限远传播的波动场为零,因面积分的影响可以忽略,仅用体积分就可以表示如下:
其他条件不变,仅改变CGS投加量,考察CGS投加量对1-NAP去除效果的影响,结果如图4所示。增加CGS的投加量,可以提高1-NAP的去除率。当CGS投加量为0.1 g/L时,25 min后1-NAP的去除率仅为40.92%。而CGS投加量为1.0,1.5,3.0 g/L时,分别在反应25,25,20 min后对1-NAP的去除率达到100%。这主要是因为CGS投加量增大,提供了更多的反应位点,在增加CGS与PS碰撞概率的同时也加快了自由基的产生速率。
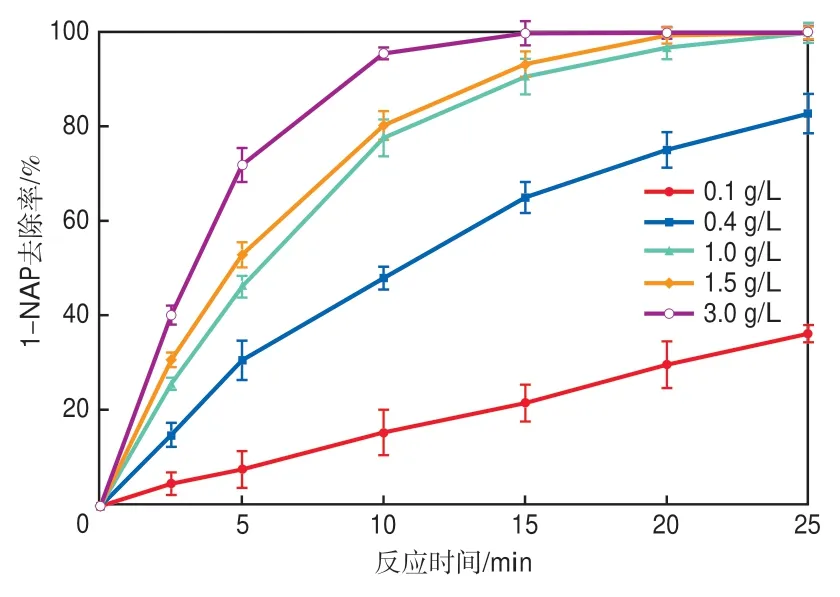
图4 CGS投加量对1-NAP去除效果的影响
不同CGS投加量(ρ)下的反应动力学参数见表2。当CGS投加量从0.1 g/L增至3.0 g/L时,反应速率常数(K)随之从0.017 9 min-1升至0.457 1 min-1,反应符合准一级动力学模型。研究表明,PS氧化降解多环芳烃类物质时的反应多符合准一级动力学模型[17-18]。
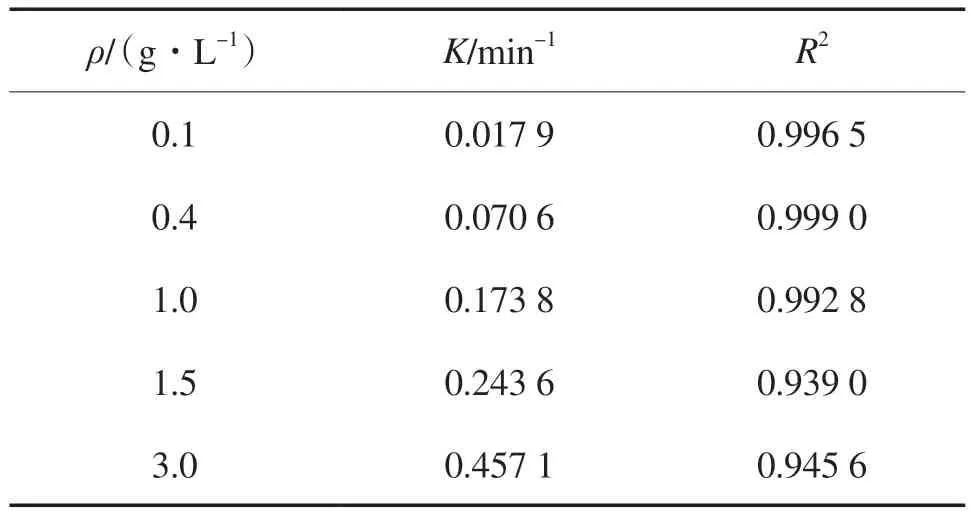
表2 不同CGS投加量下的反应动力学参数
CGS投加量对PS利用效果的影响如图5所示,PS利用率为反应消耗的PS占初始PS的百分比,由其剩余浓度和初始浓度计算得到。当CGS投加量增大时,被利用的PS量随之增加,这意味着更多PS被活化产生活性自由基,从而提高了1-NAP的去除率。当CGS投加量较少时,溶液中Fe2+含量少,难以有效活化PS产生活性自由基。在实际应用中应考虑提高CGS的初始投加量,以达到对1-NAP的快速去除和提高PS利用率的双重目的。
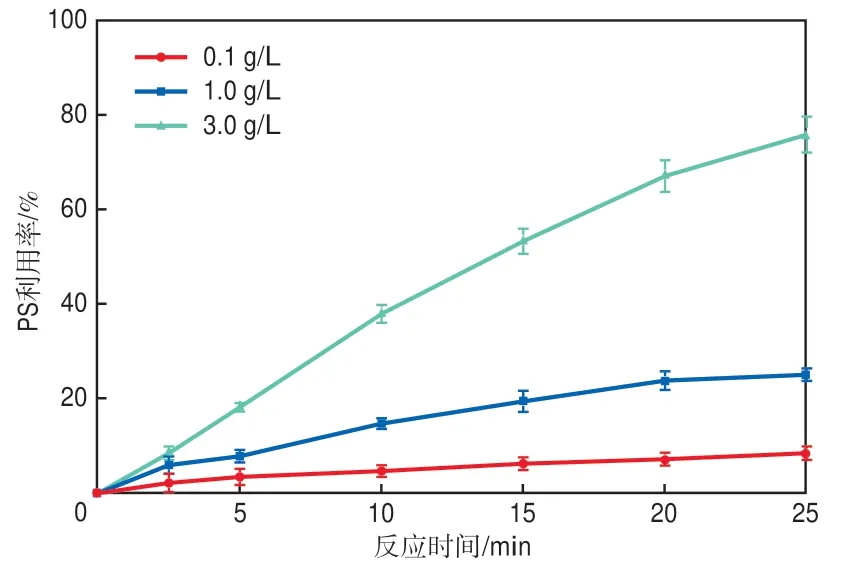
图5 CGS投加量对PS利用效果的影响
2.2.3 PS投加量的影响
其他条件不变,仅改变PS投加量,考察PS投加量对1-NAP去除效果的影响,结果如图6所示。增大PS投加量可以提高1-NAP的去除率。当PS投加量增至0.5 mmol/L时,反应25 min后对1-NAP的去除率可达100%。当PS投加量达到1.0 mmol/L后,对1-NAP的降解速率并无明显加快,因此在实际应用中应考虑避免投加过多的PS。

图6 PS投加量对1-NAP去除效果的影响
不同PS投加量(c)下的反应动力学参数见表3。PS投加量从0.1 mmol/L增至5.0 mmol/L,反应速率常数也随之从0.033 3 min-1升至0.298 9 min-1。这是因为CGS活化PS体系中当PS初始浓度提高时,会产生更多的活性自由基,从而促进1-NAP的氧化降解,使得1-NAP的去除率提高[19]。
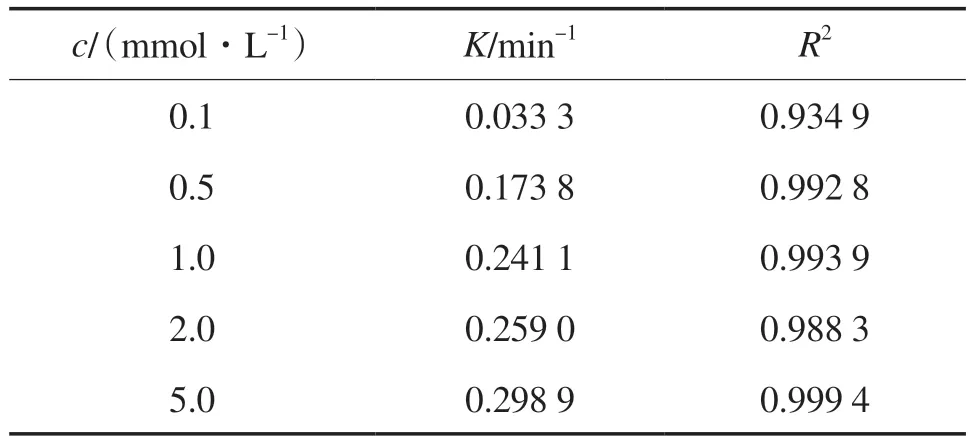
表3 不同PS投加量下的反应动力学参数
2.2.4 初始pH的影响
其他条件不变,仅改变初始pH,考察初始pH对1-NAP去除效果的影响,结果如图7所示。1-NAP的去除率明显受初始pH的影响。在pH为3时,25 min后去除率达100%。随着pH的增大,去除效果变差,当pH达到5后1-NAP去除率显著下降。pH为4和5时,1-NAP去除率分别为58.68%和23.70%;当pH达到7后,1-NAP去除率均低于15%。这是因为pH对自由基的产生和有机物的氧化降解有很强的影响[20]。酸性条件下,Fe2+的溶解度大[21],会释放更多的Fe2+离子,有利于对PS的催化,这将在一定时间内加速PS的活化以降解1-NAP[22]。另外,SO4-·在酸性反应体系中占主导地位,如式(3)和式(4)所示。碱性条件不利于Fe2+的释放[23],Fe2+很容易通过溶解氧转化为Fe3+,Fe3+会沉淀并覆盖于催化剂表面进而形成电子屏障,抑制催化剂表面Fe2+和e-的释放[24]。同时,测定了反应过程中pH的变化(见图8)。由于PS活化过程中不断产生H+[25],溶液的pH随着反应的进行缓慢减小。
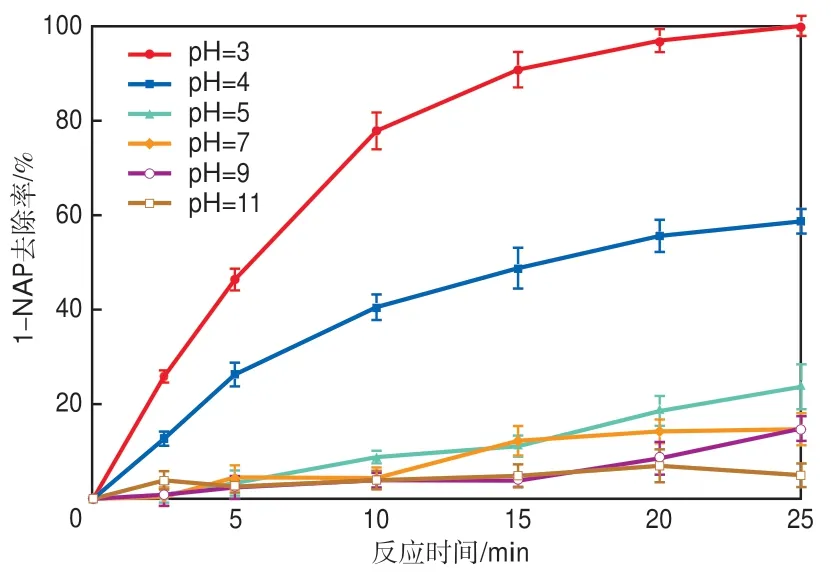
图7 初始pH对1-NAP去除效果的影响

图8 不同初始pH下反应过程中pH的变化
2.2.5 共存阴离子的影响
实际水体中常含有各种天然的阴离子,这些阴离子的存在会对高级氧化技术处理废水产生影响。因此,选取HCO3-、SO42-和Cl-(浓度分别选取10 mmol/L和50 mmol/L),考察阴离子存在时对1-NAP去除效果的影响,结果如图9所示。可以看出,HCO3-、SO42-、Cl-对1-NAP的降解均有抑制作用,抑制效果排序为HCO3-> SO42-> Cl-。HCO3-主要通过影响溶液的pH抑制反应,加入浓度为10,50 mmol/L时均可使溶液pH高于9,而在碱性条件下CGS活化PS体系去除1-NAP的效果较差。当SO42-浓度分别为10 mmol/L和50 mmol/L时,25 min后CGS活化PS体系对1-NAP的去除率分别下降了18.61%和39.24%,这是因为SO42-的存在抑制了式(1)和式(2)所示反应的进行,减少了SO-·4和HO·的产生。当Cl-浓度为10 mmol/L时,对CGS活化PS体系氧化去除1-NAP的影响较小;当Cl-浓度为50 mmol/L时,1-NAP的去除率降低4.27%,原因是少量的SO4-·和HO·会与Cl-发生反应生成活性较低的自由基[26],如式(5)和式(6)所示。

图9 共存阴离子对1-NAP去除效果的影响
2.2.6 HA的影响
在PS高级氧化技术应用于实际水体时,有研究表明HA会影响其氧化去除污染物的过程[27]。因此,选择3个阶梯浓度的HA,研究其对1-NAP氧化去除过程的影响,结果见图10。当HA质量浓度为1 mg/L时,反应开始10 min内对1-NAP的去除表现出促进作用,原因是HA的存在可以加快Fe3+/Fe2+的循环[28],如式(7)所示(式中,HAprod代表HA的降解产物)。当溶液中HA质量浓度分别为2 mg/L和5 mg/L时,对降解过程产生抑制作用。一方面,HA会消耗体系中的PS(见式(8)),进而抑制1-NAP的降解反应;另一方面,HA也会与活性自由基发生化学反应(见式(9)和式(10)),消耗一定量的活性自由基[29]。
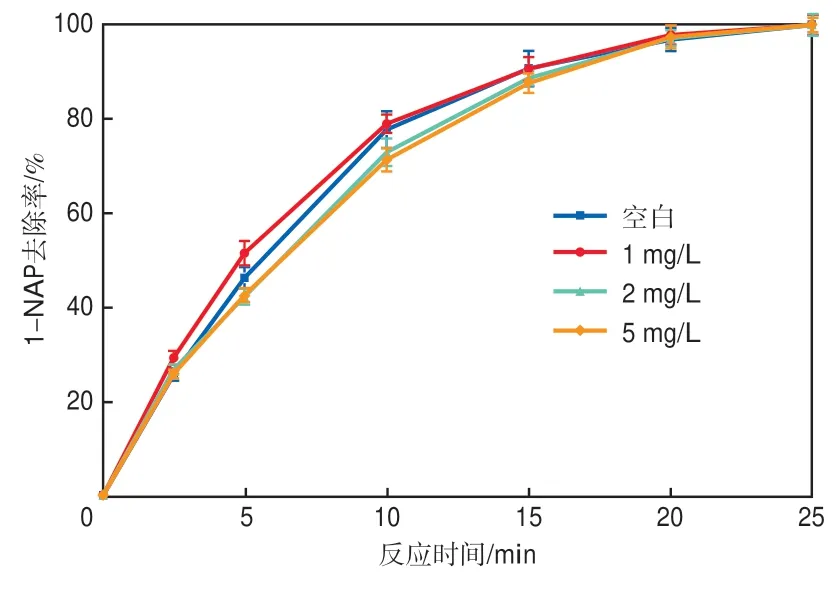
图10 HA对1-NAP去除效果的影响
2.3 活性物种分析
为进一步探究CGS活化PS体系氧化去除1-NAP的反应机制,选用MeOH和IPA作为SO4-·和HO·的猝灭剂[30],TBA作为HO·的猝灭剂[31],浓度均为100 mmol/L,确定体系中起主要作用的活性自由基,结果如图11所示。当溶液中加入MeOH和IPA后,CGS活化PS体系对1-NAP的去除均被抑制,25 min后1-NAP的去除率分别为76.32%和75.65%,较空白组分别降低了23.68%和24.35%。而加入TBA后,1-NAP的去除率仍可达94.52%,仅降低了5.48%。上述结果表明,在CGS活化PS氧化去除1-NAP的过程中产生了SO4-·和HO·,且SO4-·在1-NAP的降解去除过程中起主要作用。
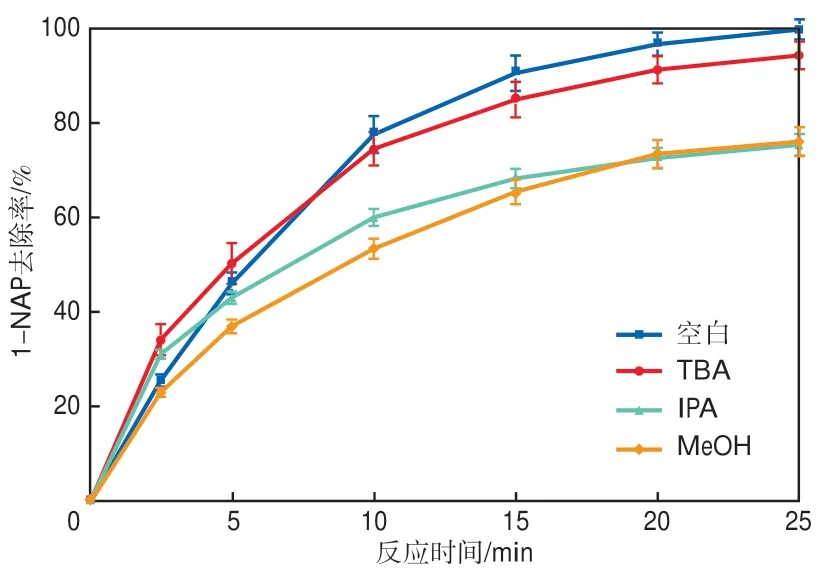
图11 自由基猝灭剂对1-NAP去除效果的影响
2.4 1-NAP降解中间产物分析
经GS-MS分析得到了3种1-NAP降解中间产物,分别为2-氯-1,4-萘醌(P1)、1,2-萘醌(P2)和1,4-萘醌(P3),详见表4,并推测了1-NAP的两条降解路径,如图12所示。路径Ⅰ中,活性自由基迅速与萘基团发生反应,产生P1(含Cl化合物,Cl可能是二氯甲烷萃取时引入),其被氧化后生成P3,最终转化为CO2和H2O[32-33]。路径Ⅱ中,1-NAP发生羟基化反应生成1,2-二羟基萘,之后通过自由基氧化反应生成P2,最后矿化为CO2和H2O[34]。
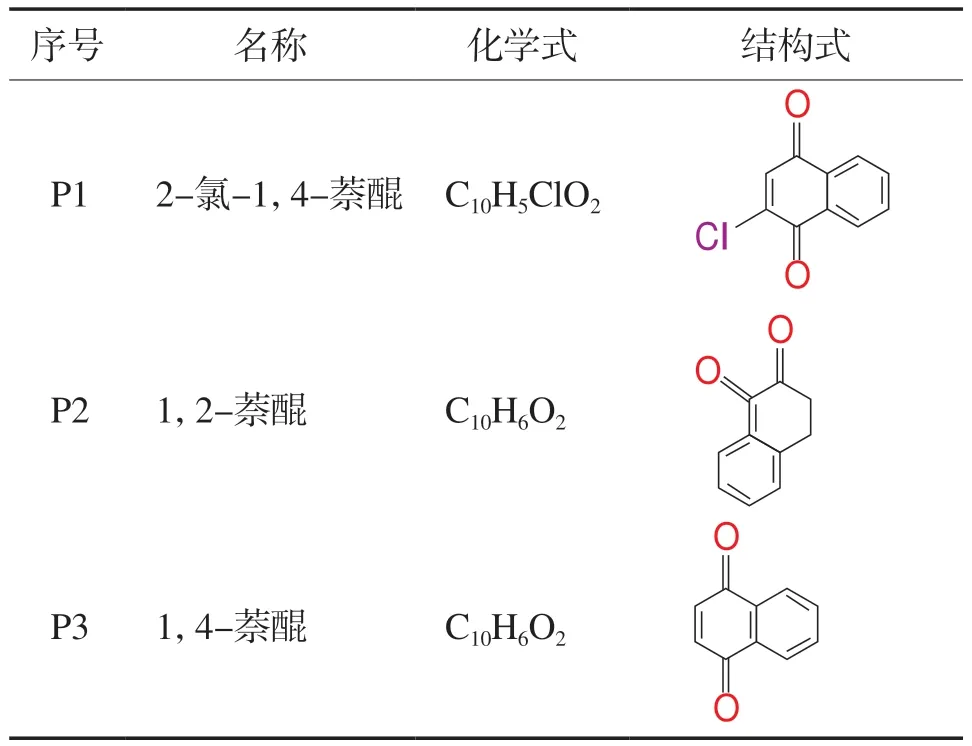
表4 1-NAP反应的中间产物基本信息
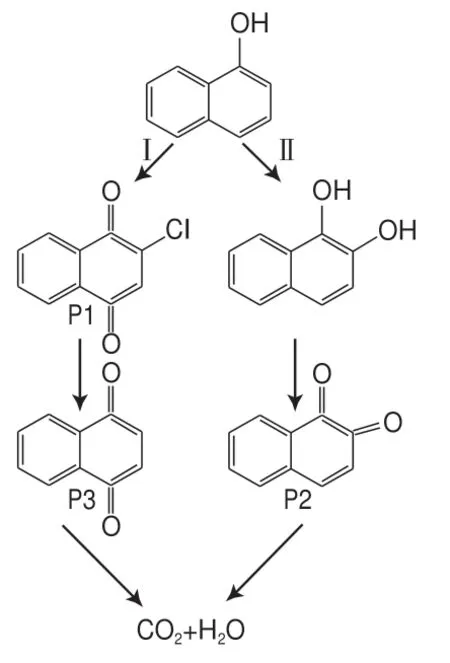
图12 1-NAP的降解路径图
3 结论
a)在初始pH为3、CGS投加量为1.0 g/L、PS投加量为0.5 mmol/L的条件下反应25 min,1-NAP(5 mg/L)的去除率可达100%。降解反应过程符合准一级动力学模型。在一定范围内,提高CGS和PS投加量均可有效提高1-NAP的去除率。
b)共存阴离子HCO3-、SO42-和Cl-对CGS活化PS降解1-NAP产生抑制作用,抑制作用强弱排序为HCO3->SO42->Cl-。
c)CGS活化PS产生活性自由基SO4-·和HO·,在降解1-NAP的过程中SO4-·起主要作用。

