改造枯草芽孢杆菌的乙醛酸旁路合成乙醇酸
刘宇飞,伏 聪,谢雨康,史吉平,3,孙俊松,3,
(1.中国科学院上海高等研究院,上海 201210;2.中国科学院大学,北京 100049;3.上海科技大学,上海 201210)
乙醇酸(glycolate,GA)又称作甘醇酸、羟基乙酸,是最小的α-羟基酸、分子量最小的果酸,最初是由甘蔗萃取所得的天然有机酸[1]。由分子结构可知,乙醇酸既有羧基又有羟基,拥有羧酸和醇的双重性质,因此,具有易降解吸收、强水溶性和穿透性等特点。乙醇酸及其聚合物具有良好的生物降解性与生物相容性,可以在生物体内降解、代谢为水和二氧化碳,从而排除生物体外,所以乙醇酸及其聚合物可用来释放多肽和蛋白质类药物[2-5]。乙醇酸还可作为药物中间体,用于薄荷脑与奎宁的酯类制备及其它药品的合成;乙醇酸低聚物或衍生物可以作为食品添加剂,通过酸化方式减少有害微生物繁殖[6]。基于其优异的化学性能,乙醇酸被越来越多地应用于食品加工和制药行业中。
目前,国内外乙醇酸的生产主要通过化学合成实现。其中,甲醛氰化法、氯乙酸水解法和甲醛氢羧基化法等化学合成途径是目前主要的生产工艺[7-10]。但是,上述工艺存有反应条件剧烈、原料含剧毒、成本高、后续分离困难以及环境污染等问题,这些问题限制的乙醇酸生产规模的扩大,也不符合绿色生产理念。因此,迫切需要找到一种绿色可持续的可以大规模生产乙醇酸的方法。近年来,生物法合成乙醇酸引起了越来越多的关注。生物法合成乙醇酸的方法分为微生物酶催化法和全生物合成方法。其中,微生物酶催化法[11]需要使用有毒且价格较高的乙二醇或者乙醇腈为原料,不能满足工业生产的需求。相比之下,全生物合成方法在未来乙醇酸生产市场具有很好的前景。利用微生物代谢工程,已经在大肠杆菌、谷氨酸棒杆菌和酵母中建立了不同的乙醇酸代谢途径[12-14]。目前,乙醇酸合成宿主菌研究主要集中于大肠杆菌。Pereira 等[15]在大肠杆菌中构建木糖代谢途径并加强乙醛酸循环来合成乙醇酸;Zhu 等[16]通过引入外源酶解决了NADPH 不平衡问题,通过失活异柠檬酸脱氢酶和过表达乙醛酸还原酶等,进一步提高了大肠杆菌利用葡萄糖合成乙醇酸的效率。Xu等[17]在大肠杆菌中设计并构建乙醇酸响应的生物传感器,建立乙醇酸的高通量筛选方法并获得一株乙醇酸高产菌株。这些研究有望实现乙醇酸化学法生产的替代,但是由于生物安全性和纯化成本等因素,上述研究合成的乙醇酸在食品和医药领域的大规模运用会受到限制。
枯草芽孢杆菌作为“公认安全”、“食用安全”的工业生产微生物,具有生长快、蛋白分泌能力强、不会产生内毒素以及不易受噬菌体感染等优点[18-20],被广泛运用于食品酶、N-乙酰氨基葡萄糖、透明质酸、岩藻糖基乳糖等工业应用产品的微生物制造[21-25]。本研究以枯草芽孢杆菌为宿主,通过表达外源异柠檬酸裂解酶基因(aceA),构建完成了以甘油为碳源,经三羧酸循环和乙醛酸循环途径合成乙醇酸的生物代谢途径,对乙醇酸的绿色安全生产和大规模全生物法合成具有重要意义。
1 材料与方法
1.1 材料与仪器
质粒、菌株 如表1 所示,菌株均保藏于-80 ℃冰箱。PCR 所用模板为Bacillus subtilis164MCT 基因组和质粒pMK4-T7;PCR 清洁试剂盒、质粒小剂量提取试剂盒 杭州爱思进生物技术有限公司;2×Phanta Flash Max Master Mi、2×Rapid Taq Master Mix 南京诺唯赞生物科技股份有限公司;DNA合成 上海生工生物工程公司;DNA 测序 北京擎科生物科技有限公司;酵母提取物、胰蛋白胨OXOID;琼脂粉 上海麦克林生化科技股份有限公司;甘油、硫酸、氯化钠以及其他培养基成分 国药集团化学试剂有限公司。

表1 菌株和质粒Table 1 Strains and plasmids
PCR 仪器 美国BIO-RAD 公司;RID-10A/SPD-20A 高效液相色谱仪 日本岛津公司;恒温培养振荡器 上海智城分析仪器制造有限公司;WFJ-2100可见分光光度计 尤尼柯(上海)仪器有限公司。
1.2 实验方法
1.2.1 培养基配制 菌株构建过程使用的培养基为Luria-Bertani(LB)培养基,其组分为10 g/L 胰蛋白胨、10 g/L NaCl 以及5 g/L 酵母粉,在LB 培养基中加入1.5%~2.0%的琼脂粉得到固体培养基。发酵培养基为M9Y 培养基[26],其组分为6.8 g/L Na2HPO4,3 g/L KH2PO4,0.5 g/L NaCl,1 g/L NH4Cl,0.015 g/L CaCl2·2H2O,0.49 g/L MgSO4·7H2O、2.8×10-4g/L FeSO4·7H2O、2 g/L 酵母粉。枯草芽孢杆菌抗生素筛选时,在培养基中添加抗生素的终浓度为红霉素10 μg/mL,氯霉素10 μg/mL。
1.2.2 基因表达盒构建 基因表达盒构建主要是通过融合PCR 方法获得用于整合到基因组的DNA 片段[27]。首先,以PCR 扩增方式获取目的基因片段、抗性基因片段、上游同源臂片段和下游同源臂片段,PCR 扩增获取DNA 片段时,使用高保真酶2×Phanta Flash Master Mix。菌株改造过程所用引物见表2。
扩增条件如下,PCR 配置体系为:2×Phanta Flash Master Mix 25 μL,上游引物(10 μmol/L)2.5 μL,下游引物(10 μmol/L)2.5 μL,模板DNA 0.5 μL,ddH2O 19.5 μL,共计 50 μL。PCR 反应条件为预变性95 ℃5 min,然后变性95 ℃ 15 s,退火55 ℃ 15 s,延伸时间据片段的长度来设置温度为72 ℃,循环数30。扩增得到的DNA 片段添加限制性内切酶Dpn I 以消除模板DNA。接着,用AxyPrep PCR 清洁试剂盒进行目的DNA 片段的纯化回收。
测定回收DNA 片段浓度后,通过overlap PCR对DNA 片段进行拼接组装:第一步,PCR 反应配置体系为10 μL 2×Phanta Flash Master Mix,片段添加量200 ng,加入ddH2O 至终体积为20 μL,进行第一轮PCR 反应,循环数10。将第一步来获取DNA 片段拼接模板进行新一轮PCR 反应,循环数30。然后通过DNA 凝胶电泳检测PCR 产物,根据PCR 条带的大小来鉴定片段融合情况。
1.2.3 枯草芽孢杆菌重组菌株构建 枯草芽孢杆菌的感受态的制备和转化方法如文献所述[28]。但是感受态的诱导物为甘露醇。感受态细胞经转化后,将其孵育菌液涂在相应抗性平板上进行筛选;长出的转化子菌落PCR 后,送至公司测序验证。验证正确的转化子进行抗性基因消除,以获得无抗突变株,以便于后续的遗传改造,消除抗性的具体方法如下:把质粒pMK4-cre 转化到阳性转化子中,涂布于有氯霉素的抗性平板上,置于37 ℃恒温箱培养过夜;接着,挑取氯霉素平板上长出的菌落,接种在装有3 mL 液体LB 的试管中。传代4 次后,将菌液梯度稀释并涂布到固体LB 平板上。37 ℃过夜培养后,用接种环挑取在长出的转化子,同时印章到氯霉素抗性平板和红霉素抗性平板上。筛选在两种抗性平板上均不能生长的转化子,进一步通过菌落PCR 鉴定抗性是否敲除或者送至公司测序验证,最后将阳性菌株命名保藏。
1.2.4 重组菌株摇瓶发酵培养 挑取单菌落接种到装有3 mL 新鲜液体LB 培养基的试管中,37 ℃、200 r/min 培养12 h;然后将上述菌液转接至装有50 mL M9Y 培养基的摇瓶中,接种量为1%。在37 ℃、200 r/min 的条件下,振荡培养6 h 后,添加甘油至终浓度为5 g/L。培养过程中,每12 h 取一次样并进行甘油和乙醇酸浓度测定。
1.2.5 发酵产物检测 样品制备:发酵液样品经12000 r/min 高速离心10 min 后,取上清液稀释(稀释倍数根据预计产量不同进行调整)。用0.22 μm 的水相滤膜过滤至液相衬管内并放入液相小瓶中。
样品分析条件:标准品和样品均使用高效液相色谱仪检测。色谱柱型号为Aminex HPX-87H(安捷伦),检测器为RID-10A 折光示差检测器(岛津),色谱柱温箱温度为65 ºC,流动相为5.0 mmol/L 的H2SO4,流速为0.8 mL/min,进样体积为20 μL,单个样品的检测时间为20 min。
乙醇酸标准曲线的绘制。首先,称量乙醇酸标品,用去离子水稀释得到0.02、0.04、0.06、0.08、0.1、0.2、0.4、0.6、0.8、1.0 g/L 十个浓度,根据上述检测方法进行液相分析。收集数据后,以乙醇酸浓度为纵坐标,对应的液相色谱峰面积为横坐标,绘制标准曲线。发酵液样品经上述同样的方法测定后,根据公式将峰面积换算得出对应乙醇酸浓度。
1.3 数据处理
每组实验数据重复3 次,结果用平均值±标准偏差表示,并利用OriginPro 2022 软件对实验数据进行显著性分析(P≤0.05)和作图。
2 结果与分析
2.1 枯草芽孢杆菌中乙醇酸合成途径构建与优化
乙醇酸合成相关的代谢通路如图1 所示,枯草芽孢杆菌理论上可以通过其内源乙醛酸还原酶(YvcT)将乙醛酸还原成乙醇酸,但其缺乏乙醛酸的合成能力。因此,实验首先将来自地衣芽孢杆菌的异柠檬酸裂解酶基因(aceA)转入枯草芽孢杆菌164MCT,同时敲除乙醇酸氧化酶基因(glcD、glcF),在枯草芽孢杆菌中构建了乙醇酸合成通路,获得菌株164MCT-GA,作为出发菌株。具体的改造菌株构建过程如下:a.利用融合PCR 的方法构建了T7-aceA(B)表达盒(图2A):首先,以U-glc-F、U-glc-R 为上下游引物扩增得到片段U-glc(1000 bp),如图2B 泳道1 所示;以D-glc-F、D-glc-R 为上下游引物扩增得到片段D-glc(1000 bp),如图2B 泳道4 所示;以erm-T7-F1、erm-T7-R1 为上下游引物扩增得到片段ermC-T7(1500 bp),如图2B 泳道2 所示;以aceA(B)-F、aceA(B)-R 为上下游引物扩增得到片段aceA(B)(1300 bp),如图2B 泳道3 所示;b.将PCR扩增所得片段U-glc、D-glc、ermC-T7 和aceA(B)按照方法1.2.2 通过融合PCR 手段构建T7-aceA(B)表达盒(4800 bp),融合片段验证如图2C 泳道1 和2所示;c.按照1.2.3 的方法将构建好的T7-aceA(B)表达盒转化至菌株164MCT,将转化菌液涂布至红霉素抗性平板筛选。随机挑取8 个转化子,以U-glc-F 和D-glc-R 分别为上下游引物进行菌落PCR 验证,阳性转化子会扩增出长度约为4800 bp 的片段,如图2D 的泳道2、4、6、7 所示,阳性转化子进行测序验证,经验证获得有红霉素抗性的突变菌株164MCT-GA。d.按照方法1.2.3,利用cre/lox系统将164MCT-GA 的抗性基因消除,将转化子印章到无抗、红霉素抗性和氯霉素抗性平板上,抗性基因敲除的转化子只能在不含抗生素的LB 平板上生长,如图2E 所示。将转化子1 送至测序公司进一步验证,最终可得到无抗的突变菌株164MCT-GA。

图1 乙醇酸代谢通路Fig.1 Metabolic pathways related to the synthesis of glycolate

图2 164MCT-GA 的构建及验证Fig.2 Construction and verification of 164MCT-GA
基于出发菌株164MCT-GA,本研究开展了进一步代谢优化,具体菌株构建流程及验证方法与出发菌株164MCT-GA 的构建类似,并且所有菌株均经过测序验证,后续不再赘述。首先,因为三羧酸循环到乙醛酸循环需要充足的前体代谢物供应,所以用强启动子T7 替换柠檬酸合酶基因(citA)的原始启动子,促进柠檬酸合酶的表达以增加流向三羧酸循环的乙酰辅酶A(乙酰-CoA)的通量,从而增加柠檬酸的供应,获得了工程菌株GA3-1,菌株可以用引物对Ucita-F、D-cita-R 验证(图3A),突变株的PCR 产物长度为3631 bp,对照组为2110 bp,如图3B 泳道1 和2 所示;由于乳酸脱氢酶催化丙酮酸产生乳酸,会带来碳源转换过程中的碳流失,所以敲除了乳酸脱氢酶基因(ldh),得到工程菌株GA3-2,菌株可以用引物对U-ldh-F、D-ldh-R 验证(图3A),突变株的PCR产物长度为3319 bp,对照组为2936 bp,如图3B 泳道3 和4 所示;在此基础上,为减少乙酰-CoA 的损耗,使其更多的流向三羧酸途径,进一步敲除了枯草芽孢杆菌胞内的乙酰-CoA 转乙酰酶基因(mmgA、yhfs),鉴于该酶有两个同工酶,先敲除mmgA(验证见图3B 泳道 5、6、7),后敲除yhfs,得到了工程菌株GA3-3 菌株,菌株可以用引物对U-yhfs-F、D-yhfs-R 验证(图3A),突变株的PCR 产物长度为3411 bp,对照组为3052 bp,如图3B 泳道8 和9 所示;敲除磷酸乙酰转移酶基因(pta)完成GA3-4 的构建,菌株可以用引物对U-pta-F、D-pta-R 验证(图3A),变突株的PCR 产物长度为3361 bp,对照组为3028 bp,如图3B 泳道10 和11 所示;过表达乙醛酸还原酶基因(yvcT)以提高枯草芽孢杆菌合成乙醇酸的效率,最终获得工程菌株GA3-5,菌株可以用引物对U-yhfs-F、D-yhfs-R 验证(图3A),变突株的PCR 产物长度为4628 bp,对照组为2200 bp,如图3B 泳道12 和13 所示。

图3 改造菌株验证结果Fig.3 Verification results of modified strains
2.2 改造菌株摇瓶发酵结果分析
在摇瓶中利用M9Y 培养基发酵枯草芽孢杆菌改造菌株,验证乙醇酸的合成能力,发酵结果如图4 所示。通过分析发现,过表达基因citA后,菌株GA3-1 的乙醇酸产量相较于出发菌株164MCTGA 提高了81.8%,证明增加乙酰辅酶A 进入三羧酸循环的流量,可以间接增强乙醛酸循环支路;而敲除基因ldh、mmgA和yhfs并没有显著提高改造菌株的乙醇酸产量(P>0.05),这可能是由于在以甘油为碳源发酵过程中,枯草芽孢杆菌本身乳酸合成途径不活跃,也没有大量乙酰-CoA 流失;发酵过程中会有少量乙酸累积,敲除基因pta后,菌株GA3-4 乙醇酸产量相较于菌株GA3-1 提高了28.4%;而过表达基因yvcT则会显著提高枯草芽孢杆菌乙醇酸合成量(P<0.05),菌株GA3-5 乙醇酸产量相较于菌株GA3-4 进一步提高了29.8%,最终产量为0.352 g/L,是出发菌株164MCT-GA 的3 倍左右。综合上述分析,乙醛酸还原酶和异柠檬酸裂解酶是枯草芽孢杆菌乙醇酸合成的关键酶;增加柠檬酸合酶表达量,可以增加前体的供给提高乙醇酸产量。

图4 不同重组菌株在M9Y 培养基中摇瓶发酵乙醇酸产量对比Fig.4 Comparison of glycolate production by different recombinant strains in shake flask fermentation in M9Y medium
2.3 表达不同来源异柠檬酸裂解酶
异柠檬酸裂解酶在乙醇酸的合成中十分重要,但是枯草芽孢杆菌缺乏表达该酶的基因(aceA),以致于利用三羧酸循环和乙醛酸循环合成乙醇酸的途径不完整,因此,外源异柠檬酸裂解酶的表达或匹配度是需要进一步了解的关键因素。Kabisch 等[29]证明地衣芽孢杆菌的异柠檬酸裂解酶基因(aceA)可以在枯草芽孢杆菌中正常表达,所以本研究首先选择了地衣芽孢杆菌来源的外源基因aceA。鉴于枯草芽孢杆菌对外源基因的包容性很高,大肠杆菌的基因也常被用于枯草芽孢杆菌的异源表达,因此,本研究进一步在枯草芽孢杆菌GA3-5 基因组上整合了来源于大肠杆菌的异柠檬酸裂解酶基因(aceA),构建了菌株GA3-52,基因表达盒如图5A 所示。重组菌株GA3-52和GA3-5 的发酵对比结果,如图5B 所示,两株菌的生长情况和甘油消耗情况区别不大,但GA3-52 的乙醇酸的最高积累量达到0.572 g/L,产率约为0.175 g/g甘油,相较于GA3-5,其产量提高了62.5%。这一现象可能是不同来源的异柠檬酸裂解酶在枯草芽孢杆菌中重组表达后的酶学性能的差异造成的,也可能是aceA拷贝数增加引起的。因此,研究又将GA3-52 中整合的大肠杆菌来源的aceA替换为地衣芽孢杆菌来源的aceA,所获得的菌株GA3-53 乙醇酸产量没有显著变化(P>0.05),如图5C 所示,说明GA3-52 的乙醇酸产量的提高只是因为aceA基因拷贝数的增加。
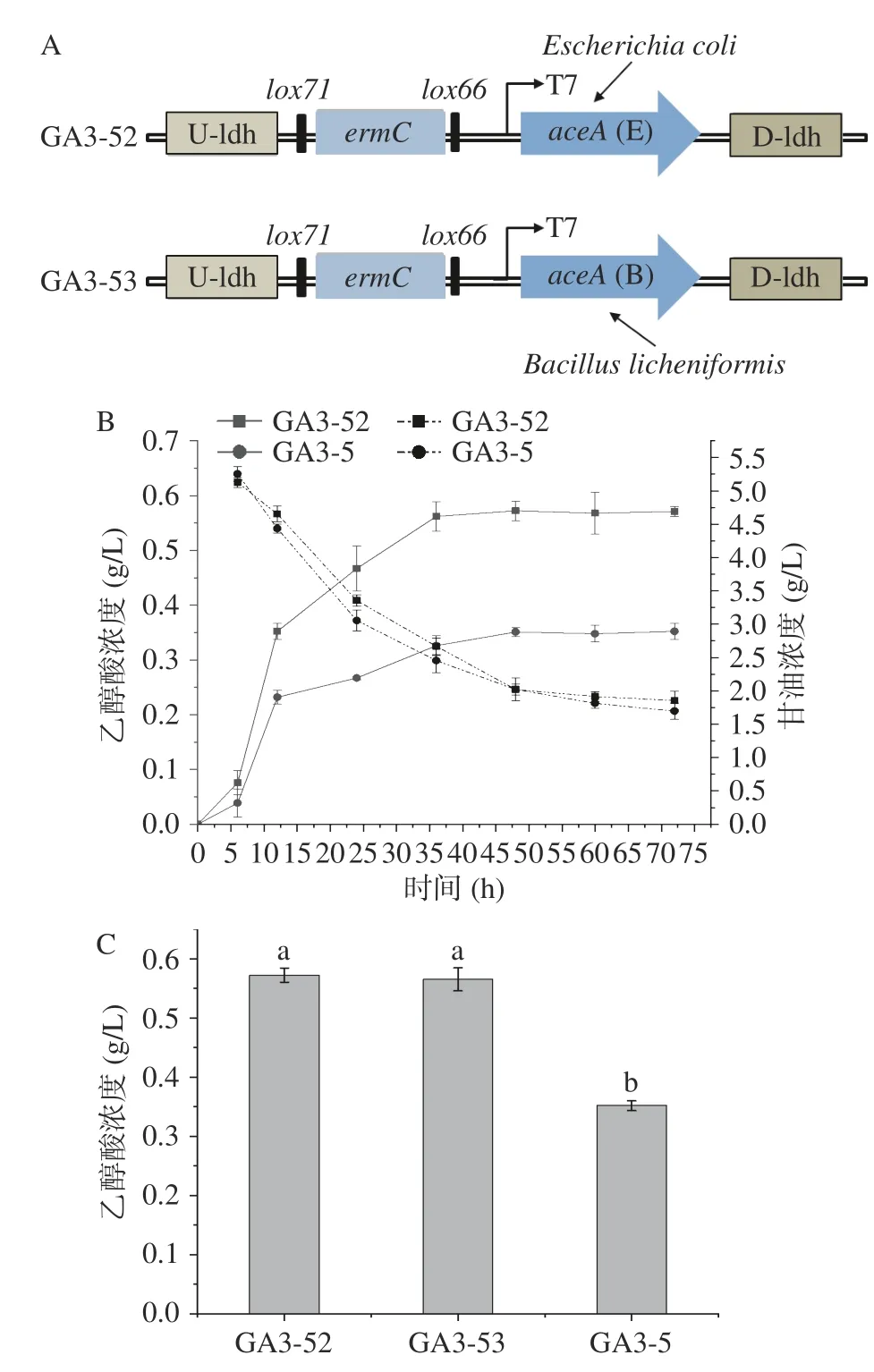
图5 重组菌株GA3-5、GA3-52 和GA3-53 在M9Y 培养基中摇瓶发酵结果Fig.5 Results of shake flask fermentation of recombinant strains GA3-5,GA3-52 and GA3-53 in M9Y medium
3 讨论与结论
本研究首次在枯草芽孢杆菌中通过表达外源异柠檬酸裂解酶基因(aceA),构建了以甘油为碳源,经过三羧酸和乙醛酸循环途径合成乙醇酸的生物途径。研究通过加强三羧酸循环、过表达关键酶基因,增加关键基因拷贝数,获得一株乙醇酸产量为0.572 g/L,产率为0.175 g/g 甘油的枯草芽孢杆菌,完成了枯草芽孢杆菌中乙醇酸生物合成的初步研究,为后续该化学品的绿色安全生产技术的进一步完善奠定了基础。
虽然本研究通过对枯草芽孢杆菌碳代谢途径的改造和加强,大幅提升了其乙醇酸的合成能力,但是目前相比大肠杆菌的合成效率还有较大差距。例如,Alkim 等[30]以大肠杆菌为宿主,以D-木糖和葡萄糖为混合底物,通过乙醛酸途径生产乙醇酸,最终糖酸转化率分别为 0.31 g/(g 葡萄糖),0.29 g/(g 木糖),0.37 g/(g 葡萄糖+木糖)(混合比例为33:66%);马宁等[31]在大肠杆菌 MG1655(DE3)中敲除了ldhA(乳酸脱氢酶基因),通过调节乙醇酸合成途径的关键酶,乙醇酸产率为0.24 g/g 葡萄糖(占理论产率的 28.2%)。然后在过量表达柠檬酸合成酶基因(gltA),并敲除基因glcB和aceB(苹果酸合成酶基因),最终获得的工程菌株Mgly335 的乙醇酸产率达到 0.522 g/g 葡萄糖(占理论产率的 61.4%);Xu 等[17]在大肠杆菌中建立乙醇酸生物传感器,筛选得到的菌株Mgly6-H1 可在5 L 发酵罐中产出40.9 g/L 左右的乙醇酸,产率为0.66 g/g 葡萄糖。上述研究表明,本研究只在枯草芽孢杆菌建立并初步优化了乙醇酸合成途径,后续需要进一步提高菌株代谢合成效率。接下来,可以对乙醛酸还原酶基因和异柠檬酸裂解酶的表达进行优化,以提高乙醇酸的生物转化量及底物转化率;还需要开展宿主细胞三羧酸循环的微调,尝试调节异柠檬酸脱氢酶的表达[32],减少异柠檬酸流向α-酮戊二酸,间接促进异柠檬酸流向乙醛酸循环。此外,还可以利用代谢组学分析,探明乙醇酸合成途径中的碳源分配,从而针对性地开展代谢改造,增加乙醇酸合成途径的代谢流/碳通量[33]。同时,高密度培养及发酵优化也是本研究后续为提高乙醇酸生物合成所需要进行的研究。

