极低出生体重儿肺出血临床转归影响因素分析
朱 雯 邹芸苏 吴 越 卢刻羽 程 锐 童梅玲 杨 洋
1.南京医科大学附属儿童医院新生儿科(江苏南京 210008);2.南京市妇幼保健院儿童保健科(江苏南京 210000)
近年来,随着高龄产妇增多和辅助生殖技术的提高,小胎龄早产儿越发常见。但由于肺发育不成熟,许多早产儿罹患呼吸窘迫综合征(respiratory distress syndrome,RDS)、呼吸暂停和肺出血等呼吸系统疾患,从而需要机械通气治疗[1-3]。其中极低出生体重(very low birth weight,VLBW)儿由于胎龄和出生体重更小,易罹患肺出血而产生呼吸衰竭、死亡等严重后果[4-5]。目前有关肺出血的临床研究多集中于其发生的高危因素[6-7],但关于肺出血后患儿预后影响因素的报道较少。为探求影响VLBW儿肺出血后预后的危险因素,本文对近4 年来南京医科大学附属儿童医院新生儿重症监护室(NICU)收治的VLBW儿肺出血病例进行回顾性分析。
1 对象与方法
1.1 研究对象
本研究为单中心、非随机、回顾性病例对照研究。选择2018 年1 月1 日至2021 年12 月31 日南京医科大学附属儿童医院NICU 收治的所有发生肺出血的VLBW 儿作为研究对象。纳入标准:①入院日龄<生后24 h;②出生胎龄<37 周;③出生体重<1 500 g;④符合肺出血诊断标准[8-9]。排除标准:①有威胁生命的严重先天畸形和遗传性代谢疾病;②病例报告表填报信息不全。研究对象根据肺出血后结局分为死亡组和存活组。
本研究获得医院医学伦理委员会批准(No.NJCH 202107071-1)。患儿资料在分析前已做匿名处理。
1.2 方法
1.2.1 临床资料收集 所有纳入对象数据由两名新生儿科医师收集,并由第3人查对。临床资料包括母亲疾患,围生期糖皮质激素使用情况,羊水情况,复苏,胎膜早破,出生体重,胎龄,性别,Apgar评分,临床诊断,呼吸支持和辅助通气参数包括吸入氧浓度(FiO2)、呼气终末正压(PEEP)和气道峰压(PIP),咖啡因和肺泡表面活性物质(pulmonary surfactant,PS)应用情况,肺出血后吸入一氧化氮(iNO)治疗情况,血气分析包括动脉血pH 值、碱剩余(ABE)、二氧化碳分压(PaCO2),凝血常规包括凝血酶原时间(PT)、部分凝血活酶时间(APTT)和凝血酶时间(TT),临床结局等。
1.2.2 诊断标准 肺出血定义为临床症状恶化相关的气管插管内涌出或吸引出血性分泌物(吸引量≥1 mL),包括呼吸机支持时FiO2增幅>0.3 或红细胞压积急剧下降>10.0%,另外伴有胸片上多小叶浸润[8-9]。RDS 诊断和分期按照2019 年欧洲RDS 管理共识指南(ECGMRDS)[10]。根据文献和相关书籍,对支气管肺发育不良(bronchopulmonary dysplasia,BPD)[11]、早产儿视网膜病变(retinopathy of prematurity,ROP)[12]、脑室内出血(intraventricular hemorrhage,IVH)[13-14]、新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)[15]、早发型败血症和动脉导管未闭(patent ductus arteriosus,PDA,含症状性PDA)[16]进行定义和分类。
1.2.3 生后复苏 所有VLBW儿生后复苏遵循中国新生儿复苏指南进行[17]。生后给予保暖的同时进行面罩或鼻塞正压通气,并由T 组合复苏器提供呼吸支持。是否产房进行插管由产房新生儿科医师决定[17]。复苏后转入NICU 进一步评估,进行有创或无创通气,并根据RDS严重程度补充PS。
1.2.4 呼吸系统主要治疗 NICU 住院过程中,由高年资主治及以上职称医师决定有创通气、拔管时间及无创通气的应用。行气管插管的指征使用两种标准进行评估[16]。绝对适应症:①持续性呼吸暂停;②PaCO2>60 mmHg伴持续性酸中毒;③氧分压(PaO2)<50~60 mmHg,FiO2>60.0%~70.0%。相对适应症:①间歇性呼吸暂停,药物治疗无效;②严重呼吸困难;③血气分析急剧恶化,PaCO2升高,PaO2降低。咖啡因和PS 使用根据2019 年ECGMRDS指南[10]。治疗BPD实施的地塞米松随机试验(DART)方案依据《实用新生儿学(第5版)》[15]。
1.3 统计学分析
采用SPSS 17.0 统计软件进行数据分析。计量资料符合正态分布的以均数±标准差表示,两组间比较采用两独立样本t检验;非正态分布的以M(P25~P75)表示,组间比较采用Wilcoxon 秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher 精确概率法检验。根据本研究样本量,参照文献[18],进入回归分析的自变量数控制在样本量的1/10~1/5较为合适。因此,以单因素分析P<0.01的变量纳入二分类多因素logistic回归分析(Forward LR法)。并将连续变量进行分层[19],出生体重分为<1 000 g、1 000~1 250 g和≥1 250 g,出生胎龄分为<28 周、28~30 周和≥30 周,肺出血前FiO2分为<30%、30%~50%和≥50%,PT分为<20 s、20~30 s、30~40 s和≥40 s,TT分为<20 s、20~30 s、30~40 s和≥40 s。生存分析采用生存Kaplan-Meier曲线,组间中位生存时间比较采用log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 死亡组与存活组围生期资料比较
研究期间共收治新生儿15 743例,其中早产儿4 641例、VLBW儿895例。共69例出生胎龄<37周的肺出血VLBW儿,占同期住院新生儿的0.4%,占同期住院早产儿1.5%、占同期住院VLBW儿7.7%。排除严重先天畸形2例、严重遗传代谢病1例、资料信息不全2 例,最终64 例VLBW 新生儿(胎龄≤35周)纳入分析,死亡组39例、存活组25例。39例死亡VLBW新生儿中,胎龄<28周21例、28~31+6周17例、32~33+6周1例;出生体重<1 000 g 17例、1 000~1 250 g13例、1 250~1 500 g9例。不同胎龄和出生体重儿的死因分布见表1。
与存活组相比,死亡组出生体重和出生胎龄较小,肺出血发生日龄较小,出生胎龄<28 周以及气管插管复苏的比例较高,差异均有统计学意义(P<0.05)。见表2。

表2 两组患儿围生期资料比较
2.2 死亡组与存活组主要诊断、治疗和监测指标比较
与存活组相比,死亡组Ⅲ~Ⅳ级RDS、症状性PDA、早发型败血症的比例较高,差异均有统计学意义(P<0.05)。见表3。

表3 两组患儿主要诊治情况比较
与存活组相比,辅助通气参数中,死亡组生后24 h内PIP较高,肺出血前FiO2较高,肺出血后FiO2和PIP较高;血气分析指标中,死亡组出生后动脉血ABE<-5 mmol/L的比例较高,肺出血时动脉血pH值<7.1、ABE<-5 mmol/L、PaCO2>50 mmHg的比例较高;肺出血时PT和TT延长,差异均有统计学意义(P<0.05)。见表4。

表4 两组患儿监测指标比较
2.3 多因素logistic回归分析
二分类logistic回归分析显示,气管插管复苏和肺出血时PT ≥30 s 是肺出血患儿死亡的独立危险因素(P<0.05)。见表5。
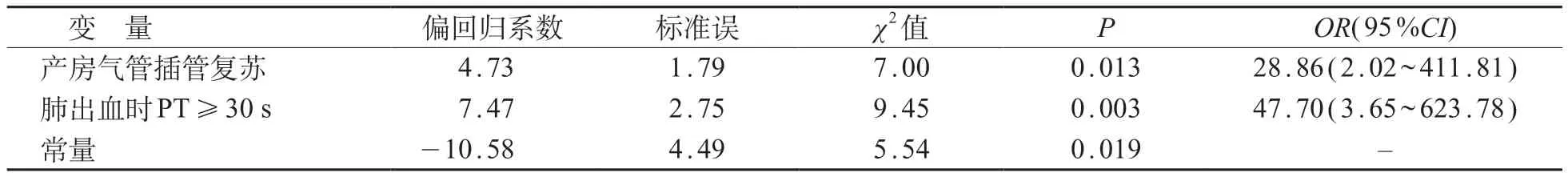
表5 二分类logistic回归分析肺出血患儿死亡影响因素
2.4 肺出血生存曲线分析
生存曲线分析显示,气管插管复苏组中位生存时间4.0 d、标准误4.7,非复苏组中位生存时间48.0 d、标准误5.4。Log-rank检验发现两组间中位生存时间差异有统计学意义(χ2=18.21,P<0.001)。PT≥30 s组中位生存时间2.0 d、标准误6.9,PT<30 s组中位生存时间44.0 d、标准误4.9。Log-rank检验发现两组间中位生存时间差异有统计学意义(χ2=22.79,P<0.001)。
3 讨论
由于早产儿胎龄小、出生体重低,肺脏发育多不完善,易罹患肺出血。根据不同中心报道,VLBW儿肺出血的发生率介于0.5%~11.0%,而病死率则高达50.0%~82.0%[20-22]。本研究显示VLBW儿肺出血发生率为7.7%,病死率60.9%。目前关于VLBW儿肺出血发生时间的现有流行病学资料较缺乏,大样本多中心的数据更是少见。本研究显示死亡组肺出血发生的中位时间为2.0(2.0~4.0)d,存活组为6.0(3.0~11.0)d。相关研究报道在58例肺出血VLBW儿中,死亡组肺出血中位时间为35 h,而存活组肺出血中位时间为50 h[23],同样提示肺出血发生时间越早,存活率越低。本研究显示死亡组出生体重、出生胎龄均显著小于存活组,提示死亡组肺出血发生时间较早与肺发育不成熟密切相关。
本研究显示,两组患儿Ⅲ~Ⅳ级RDS、症状性PDA 发生率差异有统计学意义。RDS 病变越重,显示肺发育的成熟度越低,而此类患儿往往合并症状性PDA,进一步增加了肺出血的可能性及严重性。既往研究也已表明RDS 和PDA 是肺出血发生的重要诱因[24],其引起肺出血的发生机制主要与肺淤血、肺水肿和肺小血管栓塞有关[25],因此VLBW 儿生后给予合适的PEEP可减轻肺淤血、肺水肿,同时针对症状性PDA给予非甾体抗炎药关闭,可减少肺出血的机会。本研究显示死亡组肺出血前后PIP、FiO2高于存活组,也说明死亡组肺部病变重于存活组。由于肺出血造成了急性换气、通气障碍,故应用高频通气较高的每分通气量能更好地改善CO2潴留,也能募集更多的有效肺泡。有研究表明相比常频通气组,高频通气组的肺出血及住院、上机和氧疗时间明显缩短[26]。因此VLBW 儿生后给予合适的呼吸机参数,及时合理应用外源性PS可减少肺出血的发生。
此外,进行产房气管插管复苏及发生早发型败血症患儿在肺出血死亡组显著增多,本研究多因素分析显示产房气管插管复苏患儿的死亡风险是非气管插管复苏患儿的28.86 倍,推测此种高风险有以下两种可能解释。其一,需要积极复苏的VLBW 儿肺发育成熟度更差,尤其是合并早发型败血症的患儿,其在肺发育不成熟的基础上可能合并急性肺损伤,在某种程度上增加了肺出血的可能。相关研究发现肺出血组早发型败血症发生率显著高于无肺出血组(37%对12%)[6]。另有研究在肺出血患儿肺泡灌洗液中发现炎症因子TNF-α 较对照组显著升高[27],提示急性肺损伤炎症机制的参与。其二,气管插管属于有创操作,也是包括肺出血在内多种肺部疾病的危险因素。一项单中心研究发现产房气管插管复苏与肺出血密切相关(OR=7.16)[28]。针对早发型败血症,VLBW 是其高危因素且多为母亲病原菌垂直传播[29],由于国内常见病原体为大肠埃希菌及B 族链球菌,因此早期选用三代头孢菌素联合青霉素类进行抗感染较为合适[30]。
在监测指标中,血气分析示死亡组高碳酸血症、代谢性酸中毒病例显著多于存活组,提示内环境稳定与否也是肺出血患儿能否存活的重要因素。凝血功能在两组肺出血患儿中均提示异常,而死亡组PT延长更为明显,多因素分析显示PT≥30 s的患儿死亡风险是PT<30 s的47.70倍,生存曲线进一步显示PT ≥30 s 患儿的中位生存时间仅2 d。凝血时间延长造成肺部通气障碍以及继发严重颅内出血是影响肺出血后能否存活的关键。有研究表明,大量肺出血的16 例患儿中严重颅内出血(Ⅲ及Ⅳ级)发生率达37.5%,而无肺出血对照组严重颅内出血发生率仅13.4%(P<0.01)[29]。本研究中Ⅲ及Ⅳ级IVH发生率为29.7%(19/64),虽然组间差异无统计学意义,但死亡组Ⅲ及Ⅳ级IVH发生率仍高于存活组(38.5%对16.0%)。关于肺出血与凝血因子补充之间的关系目前研究较少,有研究报道生后积极输注新鲜冰冻血浆是超低出生体重儿发生肺出血的危险因素[31]。由于PLT、凝血功能测定并不能及时准确地预测临床出血事件,因此并不推荐预防性使用血浆[32]。然而肺出血一旦发生往往伴有凝血功能异常,此时及时输注新鲜血浆及冷沉淀等进行补充仍是积极、必要的。
综上,单变量分析提示气管插管复苏史、出生体重、出生胎龄、肺出血发生日龄、Ⅲ-Ⅳ级RDS、症状性PDA、早发型败血症、肺出血前后PIP值、FiO2值、血气及凝血异常在死亡和存活组间差异显著。多变量分析则显示产房气管插管复苏和PT ≥30 s 是VLBW儿肺出血后死亡的独立危险因素。本研究的局限性在于为回顾性研究设计,部分变量如肺出血前的凝血功能、肺出血前后超声心动图的血流动力学数据等无法准确获得。另外,本研究样本量较小,一定程度上影响了结果的准确性,有待于后期扩大样本量进一步研究。

