环糊精包合物的制备及性能研究
任晓燕
(淮南联合大学 制药与材料学院,安徽 淮南 232038)
环糊精是D-(+)-吡喃葡萄糖单元通过α-1,4-葡萄糖苷键连接而成的一类环状低聚糖[1],由于具有特殊的中空圆锥形结构,使其具有疏水空腔和亲水外表面[2].环糊精包合物是一种分子复合体,其他分子可以进入空腔中,主客体分子通过范德华力、疏水相互作用、氢键等作用力形成包合物,从而使这些客体分子的物理化学性质得到明显改善[3].环糊精包合物在生物医学和新型功能材料领域具有较好的应用前景,因此受到人们的广泛关注.
作为负载药物的载体,环糊精负载在包合物上可以改善药物的稳定性、溶解性和气味[4].包合物通常有饱和溶液法、溶液搅拌法、研磨法、超声波法和冷冻干燥法等制备方法.目前,环糊精包合物常用的制备方法为溶液共沉淀法,该方法将聚合物和环糊精两种溶液混合,剧烈搅拌后生成包合物晶体[5].叶酸 (folic acid) 又称为蝶酰谷氨酸、叶片酸、抗贫血因子、R因子和U因子,是一组化学结构相似、生化特征相近的化合物的统称[6].甲氨蝶呤(MTX)为具有叶酸类似结构的抗叶酸类抗肿瘤药,其余叶酸结构上区别于独特的蝶啶杂环[7].叶酸和甲氨蝶呤在医药领域得到广泛应用.基于此,以叶酸和甲氨蝶呤为原料,利用超声辅助法制备环糊精包合物,并通过高效液相色谱法对包合率进行测定.
1 试剂与仪器
1.1 试剂
叶酸(CAS:59-30-3)、甲氨蝶呤(CAS:59-05-2)、环糊精,阿拉丁试剂(上海)有限公司;磷酸氢二钠、氢氧化钠、乙腈,均为分析纯,烟台市双双化工有限公司;薄层层析硅胶GF254,青岛谱科分离材料有限公司.
1.2 设备及仪器
CJJ78-1磁力加热搅拌器,金坛市大地自动化仪器厂;2XZ-2型旋片真空泵,浙江黄岩天龙真空泵厂;SHB-III循环水式多用真空泵、RE-1002经典旋转蒸发仪,郑州长城科工贸有限公司;GZX-9240 MBE数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂;HX501T电子天平,慈溪市天冬衡器厂;XMTD数显调节仪,余姚市金电仪表有限公司;XP204分析天平,梅特勒-托利多国际贸易(上海)有限公司;LC5090高效液相色谱仪,浙江福立分析仪器股份有限公司;布鲁克 AVANCE NEO 核磁共振 (NMR) 波谱仪,布鲁克(北京)科技有限公司;MPT-T4数字熔点仪,广州市赛拓仪器科技有限公司;LGJ-12NQT冷冻干燥机,上海继谱电子科技有限公司.
烧杯、锥形瓶、圆底烧瓶等玻璃器材购自四川蜀玻(集团)有限责任公司.
2 实验研究
叶酸和甲氨蝶呤都难溶于水,而环糊精则具有较好的水溶性.将300 mg叶酸和309 mg 甲氨蝶呤(物质的量比为1)分别在超声协助下分散于15 mL去离子水中,然后各加入772 mg(物质的量比为1)β-环糊精,在60 ℃下搅拌反应,过夜.反应停止后过滤,除去未反应的叶酸和甲氨蝶呤,将滤液置入摩尔质量为1 000的透析袋中,将透析袋浸入水中透析5 h.最后将保留液至于锥形瓶中冷冻干燥24 h得到包合产物.包裹实验过程如图1所示.
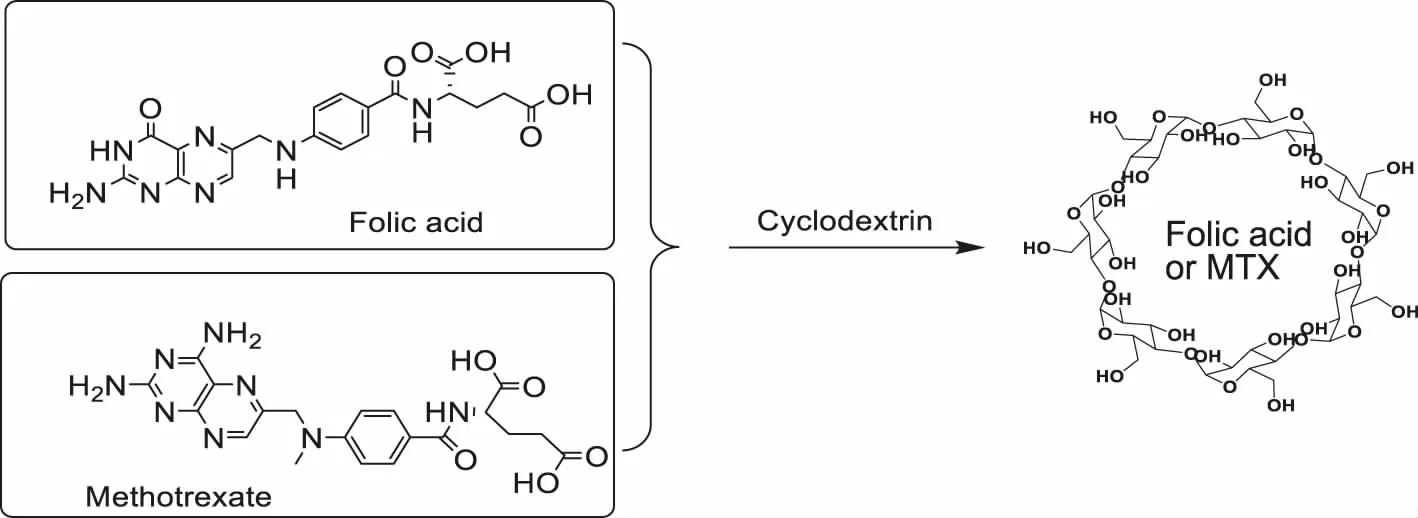
图1 包裹实验过程
3 结果与讨论
3.1 环糊精包合物的性状分析
环糊精包合物的熔点:叶酸为250 ℃,甲氨蝶呤为195 ℃.
Folic、MTX 、Folic-CD和MTX-CD分别用高分辨率质谱进行表征.可以看出,其中,Folic [M+H]+HRMS (ESI-TOF)m/z的计算值为441.139 7,实验值为441.135 6.MTX [M+H]+HRMS (ESI-TOF)m/z的计算值为454.171 3,实验值为454.176 6. Folic-CD [M+H]+HRMS (ESI-TOF)m/z的计算值为1 575.504 9,实验值为1 575.503 8.MTX -CD [M+H]+HRMS (ESI-TOF)m/z的计算值为1 588.541 1,实验值为1 588.542 9.
3.2CD和Folic-CD和MTX-CD的1H-NMR
以D2O为氘代试剂对CD、Folic-CD和MTX-CD分别进行1H-NMR测试,测试结果如图2所示.可以看出,未显现出药物分子的特征峰,二者的1H-NMR几乎完全一致,这可能是由于环糊精对两种药物进行完全包裹,使得药物分子的核磁信号被完全遮蔽.
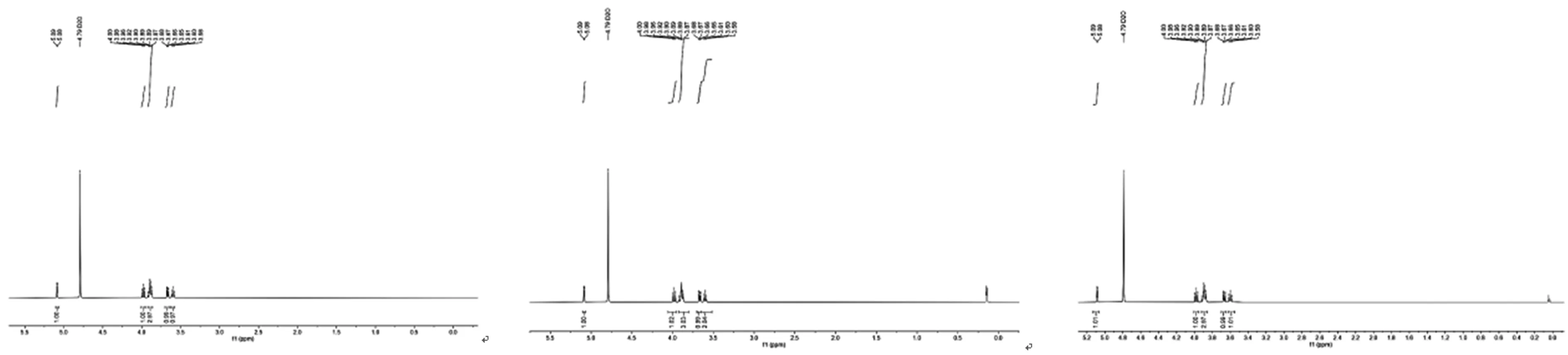
图2 CD(左)、Folic-CD(中)和MTX-CD(右)的1H-NMR
3.3 Folic、MTX、CD、Folic-CD和MTX-CD高效液相色谱分析
高效液相色谱分析如图3所示.使用依利特SinoPak C18色谱柱十八烷基键合硅胶反向固定柱为固定相,流动相使用CH3OH-H2O(30∶70),用H3PO4调节溶液的pH为4,对叶酸开展高效液相色谱分析,合成的叶酸样品的保留时间为4.8 min.流动相使用磷酸氢二钠溶液(0.025 mol/L,pH =5.41)-甲醇(76∶24,V/V),对甲氨蝶呤开展高效液相色谱分析,合成的甲氨蝶呤样品的保留时间为7.9 min.流动相使用90%的乙腈对CD、Folic-CD、MTX-CD开展高相液相色谱分析,此时CD的极性最大,保留时间最短为3.7min;而Folic-CD的极性与环糊精相比略小,但是保留时间较长,为4.4 min;MTX-CD的极性最小,保留时间最长,为6.2 min.
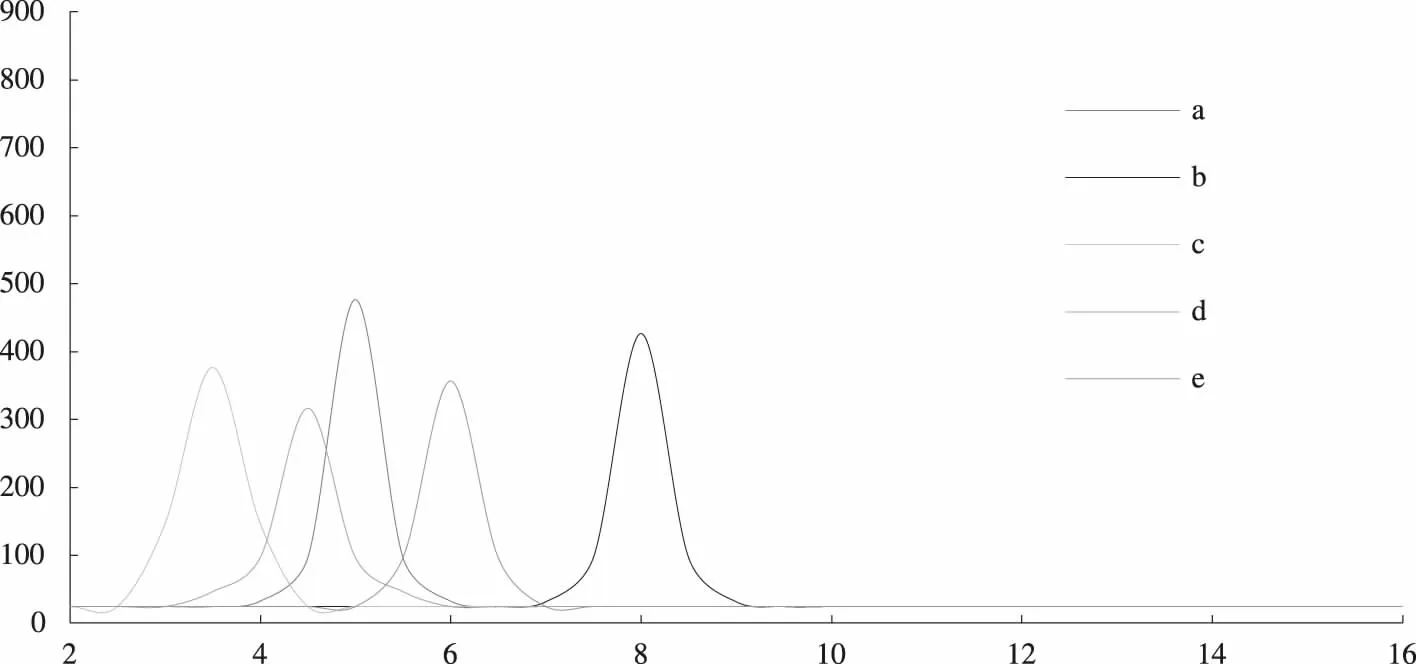
图3 Folic(a,红)、MTX(b,黑)、β-CD(c,绿)、Folic-CD(d,橙)和MTX-CD(e,蓝)的高效液相色谱图
3.4 β-环糊精包合率的测试
使用不同物质的量比的叶酸、甲氨蝶呤和环糊精进行包裹实验,通过高效液相色谱法对包合率进行测定.结果表明,提高叶酸和甲氨蝶呤的物质的量比反而会导致包合率下降,所以选择低物质的量比更有利于对配合物进行包裹.
利用高相液相色谱图的峰面积对包合率进行计算.首先称取113.4 mg的β-CD (0.1 mmol),用5 mL 去离子水溶解,利用高相液相色谱进行分析,计算出标准样品中β-CD的峰面积.然后分别移取44.11 mg/66.17 mg/88.22 mg叶酸(0.1 mmol/0.15 mmol/0.2 mmol),45.44 mg/68.16 mg/90.88 mg 甲氨蝶呤(0.1 mmol/0.15 mmol/0.2 mmol), 与113.4 mg CD (0.1 mmol),按上述合成方法制成包合物.过滤除去多余的叶酸和甲氨蝶呤,并对其水相进行高相液相色谱分析,计算出样品中未包合的CD的峰面积.包合率的计算公式为

环糊精包合物在不同含量(叶酸/甲氨蝶呤:环糊精)时的包合率如表1所示.可以看出,当叶酸/甲氨蝶呤:环糊精的物质的量比为1∶1时,最佳包合率为96%.
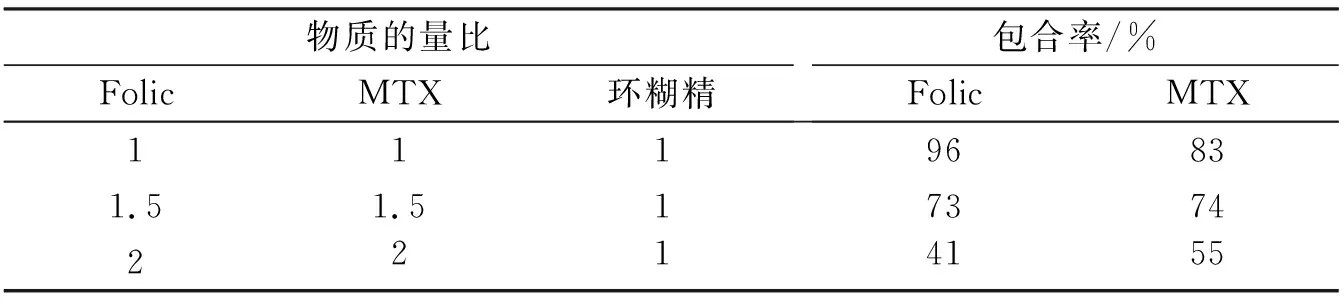
表1 环糊精包合物的包合率
4 结论
以叶酸和甲氨蝶呤为原料,采用超声辅助法制备对环糊精包合物,并通过改变叶酸、甲氨蝶呤、环糊精的含量来计算包合物的包合率.计算发现,当叶酸/甲氨蝶呤:环糊精的物质的量比为1∶1时,最佳包合率为96%.该研究对环糊精负载药物的合成具有参考意义.

