肠-脑轴影响棕色脂肪组织产热机制的研究进展
徐圣洁,席加秋,吴涛,王中琳
近年来肥胖在全世界范围内呈流行趋势,据估计目前约有11亿成年人超重,其中3.12亿成年人肥胖[1],这使得心脑血管疾病、糖尿病等一系列慢性病的发生风险明显升高[2-3],进而给医疗保健系统带来了沉重负担。与此同时,研究者也逐渐认识到脂肪组织在脂肪代谢中的重要作用[4]。白色脂肪组织(white adipose tissue,WAT)是哺乳动物的主要脂肪储存器官,棕色脂肪组织(brown adipose tissue,BAT)主要用于产热,以防止寒冷环境中的体温下降。与WAT不同,BAT能增加机体的能量消耗,进而达到改善肥胖的目的[5],而肠-脑轴可能是调节脂肪代谢并激活BAT产热的重要通路[6]。本文主要综述了肠-脑轴组成及其影响BAT产热的机制,以期从肠-脑轴与BAT的角度为防治肥胖提供潜在方案。
1 BAT概述
研究表明,成年人BAT的激活程度与其BMI呈负相关[7],且BAT在全身能量代谢中发挥着重要作用[8]。近年研究发现,激活BAT是平衡体质量与能量的关键,而肠道菌群及其代谢产物、肠道激素可直接或间接地激活BAT,故其有望成为新的BAT激活剂以对抗肥胖[9]。
与WAT不同,BAT无法直接为机体供能,其是以非颤抖性产热的形式快速氧化自身储存脂肪和循环底物,从而产生热量,提高机体代谢率[10]。众所周知,寒冷刺激是BAT产热的重要诱因,且近年研究发现,刺激迷走神经也能有效促进BAT产热[11]。下丘脑弓状核能接收迷走神经信号并将胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)、胆囊收缩素(cholecystokinin,CCK)等神经信号投射到室旁核,继而向交感神经系统(sympathetic nervous system,SNS)发出指令并将这些神经信号传导至交感神经末梢,之后交感神经末梢释放去甲肾上腺素并作用于BAT的β3-肾上腺素能受体[12],进而刺激细胞内合成第二信使环AMP,导致环AMP驱动的蛋白激酶A(protein kinase A,PKA)信号被激活。研究表明,PKA可以通过激活脂肪酶、增强脂肪水解和包括解偶联蛋白1(uncoupling protein 1,UCP1)在内的产热基因的转录表达而促进产热[13]。UCP1是一种线粒体膜内转运蛋白,其仅存于BAT的线粒体内膜中,活跃状态时其会从ATP合成中“解偶联”,使能量以热量的形式释放而非用于ATP合成,BAT正是依赖该过程实现非颤抖性产热[14]。另外,脂肪水解过程中释放的游离脂肪酸既是UCP1激活剂,也是产热的燃料[15]。
BAT的非颤抖性产热是一种高效的能量消耗机制,且其在降低肥胖发生风险方面具有潜在作用[16]。MESTDAGH等[17]研究证实,BAT与三酰甘油清除及葡萄糖代谢密切相关,小鼠BAT能够吸收其摄入的50%三酰甘油和75%葡萄糖;此外,BAT产热作为大脑的反馈信号可以促进饱腹、控制摄食,从而改善肥胖。
2 肠-脑轴组成及其影响BAT产热的机制
肠-脑轴是由肠道菌群、短链脂肪酸(short-chain fatty acids,SCFAs)、肠道内分泌细胞及肠道激素、神经系统〔包括中枢神经系统(central nervous system,CNS)、肠神经系统(enteric nervous system,ENS)、自主神经系统(autonomic nervous system,ANS)及其相关分支〕、神经内分泌信号、肠道相关免疫系统组成的双向调节通路[18]。其中CNS可以通过应激介导的相关基因表达而直接影响肠道菌群,也可以通过ANS介导的肠道功能(如免疫调节)而间接影响肠道菌群[19]。肠道菌群及其代谢产物可以通过激活肠道内分泌细胞而释放肠道激素,或被上皮细胞层吸收而进入血液循环,或激活迷走神经传入神经,进而诱导中枢反应[20]。
2.1 肠道菌群 肠道菌群是定植在宿主肠道内的微生物菌群,主要分为厚壁菌门、拟杆菌门、变形菌门、放线菌门、疣微菌门和梭杆菌门6个菌群门类,其通过调节碳水化合物、脂类和氨基酸代谢而在动脉粥样硬化、糖尿病、恶性肿瘤和自身免疫性疾病的发生发展中发挥关键作用[21-22]。研究表明,肠道菌群是串联大脑和胃肠道并维持机体代谢稳态的关键调节因子[23],CNS和ENS可以通过与肠道菌群的相互作用而调节脂肪等营养物质的代谢,肠道菌群也可以通过其代谢产物、肠道激素及迷走神经的传入通路等参与BAT产热[24]。
2.2 SCFAs 在肠道菌群产生的所有代谢物中,SCFAs是发酵膳食纤维的最终产物,该发酵过程主要产生乙酸盐、丙酸盐和丁酸盐[25]。其中血液中乙酸盐浓度远高于丙酸盐浓度和丁酸盐浓度[26],故推测乙酸盐介导了大部分SCFAs在外周组织中的作用,如乙酸盐经血液循环到达特定组织,并作为配体与G蛋白偶联受体(G protein-coupled receptor,GPR)结合。HU等[27]研究表明,乙酸盐通过激活GPR43而上调小鼠永生化棕色脂肪系细胞中过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptorsγ,PPARγ)mRNA和UCP1 mRNA的表达,表明乙酸盐能够促进永生化棕色脂肪系细胞的发育和分化。丁酸盐可参与维持肠道稳态和上皮细胞的完整性,是结肠腺细胞的能量来源,SHEN等[28]研究发现,三叶菌素不仅能有效减少肥胖大鼠肾周脂肪、附睾脂肪和BAT的蓄积,还可以促使SCFAs(尤其是丁酸盐)浓度增加并维持肠道菌群的多样性。GONG等[29]研究发现,抗衰老片可增加小鼠肠道菌群的多样性及促进丁酸盐的产生,并有效下调小鼠腹股沟WAT/肩胛间BAT比值,故推测肠道菌群的多样性及丁酸盐的增加与BAT激活存在偶联,但其具体作用通路仍不清楚。LI等[30]研究证实,口服丁酸盐可以激活BAT,当横膈膜下迷走神经被切断后,丁酸盐对BAT的激活作用被阻断,表明丁酸盐可能通过迷走神经通路激活BAT。组蛋白去甲基酶1(histone demethylase 1,LSD1)是一种组蛋白去甲基酶,也是丁酸盐诱导BAT产热的潜在中介。WANG等[31]研究发现,敲除LSD1基因可阻断丁酸盐诱导的BAT产热和能量消耗,揭示了丁酸盐通过LSD1调节脂肪产热的一种新的细胞自主机制。
2.3 肠道内分泌细胞及肠道激素
2.3.1 GLP-1 GLP-1是一种主要由肠道L细胞分泌的肽类激素,其具有抑制胃排空、减少肠蠕动等作用[32],故常用于控制进食。ADAMI等[33]曾提出减肥手术后BAT产热的激活与肠道GLP-1产生增加有关。实际上,肠道GLP-1会被二肽基肽酶-4快速酶降解,难以到达下丘脑并与胰高血糖素样肽1受体(glucagon-like peptide-1 receptor,GLP-1R)结合,故推测肠道GLP-1可能通过某些感觉神经传入通路控制BAT产热。ZHOU等[34]认为,GLP-1R激动剂利拉鲁肽通过激活AMPKSIRT-1-PGC1-α信号通路而使BAT的PPARγ表达上调,继而刺激BAT产热,且BAT产热可能在GLP-1介导的减重过程中起主要作用。KRIEGER等[35]利用病毒跨突触示踪剂(如伪狂犬病毒、嗜神经病毒等)首次证明,迷走神经传入神经纤维可以提供中枢体温调节位点及控制BAT产热相关的内脏感觉信息;此外,在tdTomato(PRV-263)标记的迷走传入神经中GLP-1R mRNA高度富集,表明迷走神经传入神经纤维通过突触连接介导了GLP-1引发的BAT产热。上述研究证实,肠道GLP-1可以通过迷走神经传入通路控制BAT产热。
2.3.2 胆汁酸(bile acids,BA) BA是一种具有代谢和内分泌功能的多效性激素样信号分子,一方面,肠道菌群通过去羟基化修饰BA,形成次级胆汁酸,次级胆汁酸的多样性和胆汁酸池的组成又会受到不同个体肠道菌群的影响[36];另一方面,BA具有抑菌作用,如脱氧胆酸能够抑制金黄色葡萄球菌[37],其在一定程度上能够影响肠道菌群的组成。研究表明,BA是激活BAT产热程序的重要分子[38]。FAN等[39]认为,BA激活BAT并诱导其产热的作用是由BA与BAT细胞膜上的TGR5结合而介导的,BA与TGR5结合后可上调环AMP表达,而环AMP又通过促进BAT中的2型碘甲腺原氨酸脱碘酶的表达而催化活性甲状腺激素三碘甲状腺原氨酸的产生,导致线粒体解偶联和产热增强。此外,BA还可以经血液循环穿过血脑屏障而到达下丘脑,通过激活AgRP/神经肽Y(neuropeptide Y,NPY)神经元表面的TGR5而控制饱腹感的负反馈回路[40],进而抑制食欲。
2.3.3 CCK CCK具有内分泌激素和神经递质的作用,其是一种存在于肠内分泌细胞及大脑神经元的脑肠肽[41]。肠道迷走传入神经中存在CCK受体1。YAMAZAKI等[42]研究发现,腹腔注射CCK受体1拮抗剂后,大鼠BAT交感神经活性受到明显抑制,当切断横膈膜下迷走神经后,这种对BAT交感神经活性的抑制作用立即被阻断,表明CCK通过CCK1受体1及迷走神经途径激活BAT的SNS并诱导其产热。除作用于局部迷走神经表达受体外,CCK还被释放到血液循环中。CCK能够通过血液循环透过血脑屏障而到达CNS,并直接作用于孤束核及下丘脑中部-基底区的CCK受体[43]。大脑CCK能够直接作用于下丘脑中的NPY神经元,NPY也是一种中枢神经调节剂,其通过调节交感神经活性而激活腹股沟和肩胛间的BAT[44]。另外,CCK还可以促进降钙素分泌并引发强烈的厌食反应,从而控制进食。
2.3.4 促胰液素(secretin,SCT) SCT是一种能够刺激胰腺分泌碳酸氢盐以中和肠道酸性物质的肠道激素。LI等[45]研究发现,促胰液素受体(secretin receptor,SCTR)在BAT中呈高表达,SCT能够直接与小鼠肩胛间BAT中的SCTR结合而激活脂解作用,进而激活BAT产热,而非依赖SNS的介导;同时,该研究还观察到,注射SCT后小鼠下丘脑中的阿片黑素促皮质激素原(pro opiomelanocortin,POMC)水平升高,POMC神经元中的TRPV1呈高表达,而TRPV1又能够直接感知大脑的局部温度变化,即温度升高TRPV1活性增强。因此,笔者推测BAT产热引起的局部大脑温度升高很可能是产生饱腹感的关键信号。LAURILA等[46]首次在健康成年人中证实了上述观点,其指出BAT作为中间器官,其产热功能能最终调节食欲,从而治疗代谢性疾病,尤其是肥胖症。
2.4 神经系统、神经内分泌信号及肠道相关免疫系统组成的双向调节通路
2.4.1 神经系统 肠道菌群通过影响迷走神经途径而与CNS产生联系,迷走神经是连接胃肠道和孤束核及从孤束核到下丘脑和新皮质的主要神经通路,迷走神经上分布着大量肠道调节肽和肠道代谢成分受体[47],可将信号传到大脑。大脑通过迷走神经的交感和副交感神经通路对ENS产生影响,肠道菌群衍生的内分泌信号也通过“肠内分泌细胞-ENS-迷走神经”途径而影响CNS[48],CNS与ENS之间不是单一的指挥与被指挥关系,而是呈现一种双向交流关系,这种双向交流便是肠-脑轴的核心。
在诸多肠道受体中,化学感受器主要负责识别化学刺激物(如肠道激素、神经递质等),如肠内分泌细胞能够识别SCFAs,从而将钙信号传递到肠上皮中迷走神经的特定纤维[49]。有动物实验证实,迷走神经是调节肠脑交流行为的重要神经[50]。MANO-OTAGIRI等[51]研究发现,大鼠通过影响迷走神经而介导CNS的外周信号,进而支配BAT内的交感神经,从而诱导BAT产热。下丘脑弓状核负责接收迷走神经的传递信号,并将其投射到脑室旁核,进而向SNS和甲状腺轴释放信号[52]。研究表明,静脉注射生长素释放肽可以抑制BAT 中去甲肾上腺素的释放,而迷走神经切断术可以阻断这种抑制[51],这进一步佐证了迷走神经信号参与BAT产热的观点。总之,迷走神经途径在交感神经诱导的BAT活性增强中具有重要作用。
2.4.2 神经内分泌信号 肠道菌群代谢产生的多种细胞因子和神经递质可以调节细胞分泌,且某些分泌产物的增多可能会影响CNS。GU等[53]研究发现,干酪乳杆菌能够上调去甲肾上腺素表达水平,而去甲肾上腺素能够与BAT中的β3-肾上腺素能受体结合并将其激活,表明干酪乳杆菌能够间接激活BAT。肠道菌群的代谢产物能刺激肠内分泌细胞并释放肠道激素,肠道激素编码的信号会通过血液循环或小肠中的迷走神经通路而到达大脑,并作用于下丘脑的神经元。SCT通过血液循环到达BAT并直接与其受体结合,以激活BAT产热。研究者发现,这种产热作用引发的饱腹信号能够通过迷走神经通路传递至下丘脑[54]。
2.4.3 肠道相关免疫系统 研究证实,肠道菌群的变化会直接影响免疫细胞功能[55]。小胶质细胞被视为大脑中的第一免疫应答者,在抗原呈递、吞噬及调控炎症的过程中发挥着关键作用,CAETANO-SILVA等[56]研究证实,SCFAs可通过肠-脑轴发出信号或直接到达大脑而调节小胶质细胞炎症反应,进一步验证了免疫系统在调控大脑与肠道动态平衡中的中介作用。事实上,许多免疫细胞和炎症细胞参与了BAT产热及WAT褐变的调节,并最终调控能量平衡。BAT除了含有棕色脂肪细胞和前脂肪细胞外,还包含多种免疫细胞,如巨噬细胞、中性粒细胞和淋巴细胞等。OMRAN等[57]研究证实,免疫细胞和脂肪细胞分泌的促炎递质可抑制BAT产热及WAT褐变。WOLF等[58]研究发现,敲除巨噬细胞中的Mecp2基因会使BAT中交感神经纤维的分布及去甲肾上腺素信号通路发生改变,从而影响UCP1的表达和产热作用,但这种方式难以在短时间内控制BAT产热。目前,对免疫细胞控制BAT产热的研究相对较少,研究结果仍存在局限性。
3 小结与展望
BAT的产热机制已成为肥胖和代谢相关疾病领域的研究热点,研究证实,脂肪组织在促进能量消耗、维持代谢稳态中具有重要作用[59]。肠-脑轴参与调控BAT产热的途径大致有3条,即迷走神经途径、神经内分泌途径及免疫途径,且各条途径不是完全独立存在,其可能并行或相互作用,如不论是肠道激素还是炎症信号,均可以经迷走神经通路向CNS传递信号,任何一条途径的变化均可能影响另外两条途径。BAT与脑-肠轴的关系见图1。且有研究表明,通过调控肠道菌群来刺激BAT产热对于改善肥胖有效[60],这为研发安全、高效的BAT产热激活剂提供了新方向。
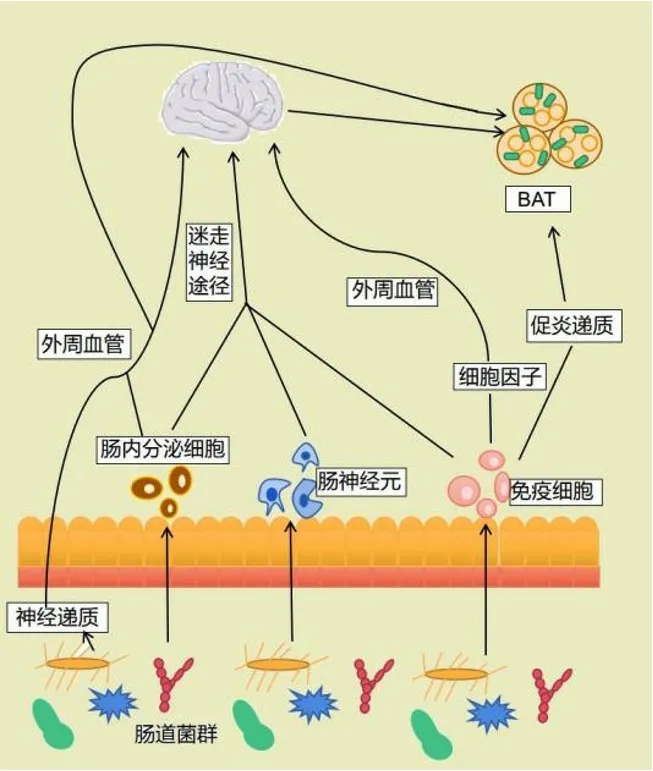
图1 BAT与肠-脑轴的关系Figure 1 Relationship between BAT and gut-brain axis
但目前仍有很多关键问题值得深入研究。首先,肠道菌群的个体变异程度及对菌群区分的精确度限制了对BAT与肠道菌群关系的深入研究;其次,目前对于BAT的产热能力及产热持续时间并不完全明确;最后,肥胖患者BAT的减少与许多负面代谢有关,但对其潜在机制的了解有限。
作者贡献:徐圣洁、吴涛进行文章的构思与设计;席加秋、王中琳进行文章的可行性分析;徐圣洁进行文献/资料收集、整理;徐圣洁、吴涛、王中琳撰写、修订论文;王中琳负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。

